pcr چیست؟
مقدمه
واکنش زنجیرهای پلیمراز (PCR) یک تکنیک آزمایشگاهی است که برای تولید میلیونها نسخه از یک بخش خاص از DNA استفاده میشود. در زیستشناسی مولکولی، از PCR برای ساخت (تکثیر) تعداد زیادی نسخه از بخشهای کوچک DNA یا یک ژن استفاده میشود.
این روش امکان آن را فراهم میکند که تنها از مقدار بسیار کمی DNA اولیه، میلیونها نسخه از یک ناحیه مشخص ساخته شود.
این تکنیک در سال ۱۹۸۵ توسط مالیس و همکاران معرفی شد و بعدها جایزه نوبل را برای این کار دریافت کردند. PCR ابزاری عظیم در علوم بیومولکولی است که به دلیل توانایی بالای آن در شناسایی و بررسی بخشهای تقویتشده DNA، بسیار پرکاربرد است.
PCR فرآیندی است که به طور انتخابی بر بخش بسیار کوچکی از DNA درون یک لوله آزمایش تمرکز میکند. ویژگی پایداری در برابر گرما (ترموستابیلیتی)، امکان مقاومت DNA و آنزیم در برابر تغییرات برگشتناپذیر در دماهای شدید را فراهم میکند. به همین دلیل، تاک پلیمراز به دلیل پایداری حرارتی خود، انتخاب مناسبی برای ادامه سنتز DNA حتی در مواجهه با پرایمرها پس از چندین چرخه دناتوراسیون و بازپیوند است. به علت حساسیت بالای PCR، این تکنیک بهطور گسترده در تشخیص عفونتهای باکتریایی و ویروسی و غربالگری اختلالات ژنتیکی استفاده میشود و بهعنوان استاندارد طلایی در بسیاری از آزمایشها محسوب میگردد.
مراحل آزمایش
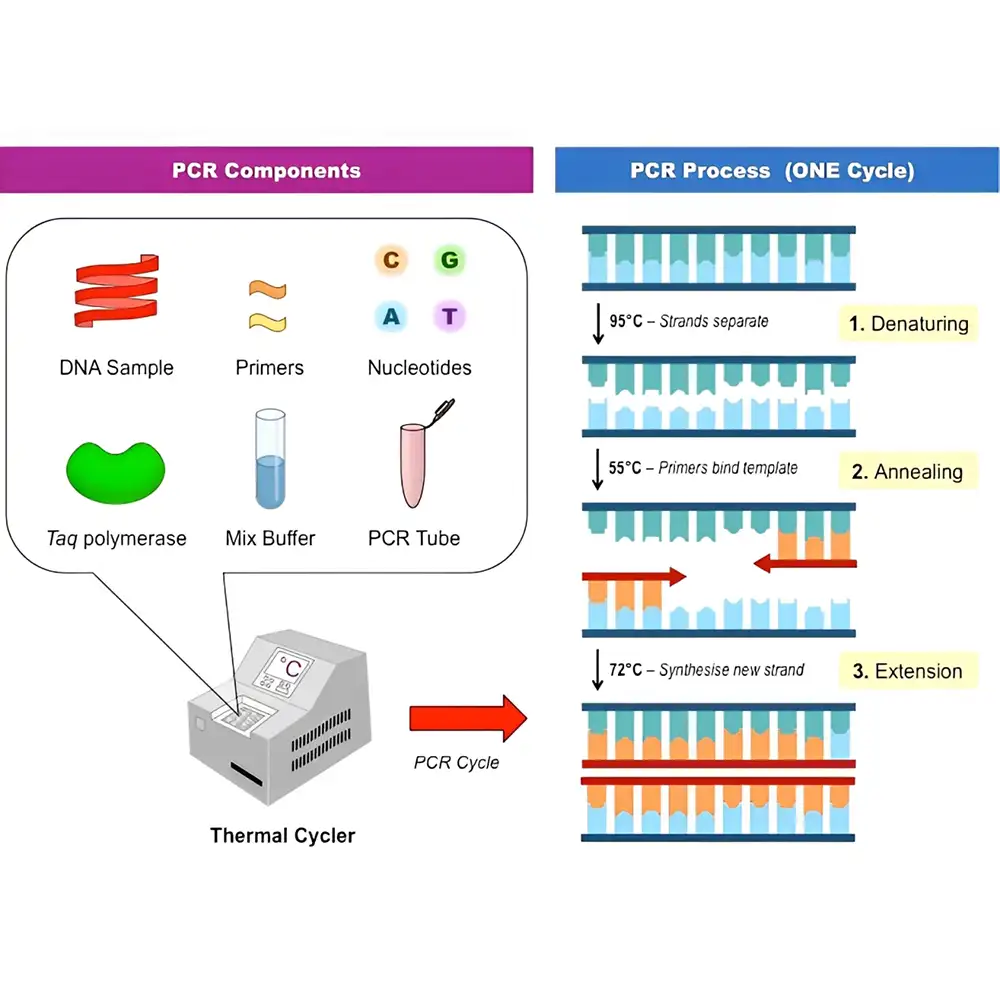
PCR با جمعآوری یک نمونه کوچک DNA درون لوله آزمایش آغاز میشود. این تکنیک شامل سه مرحله اصلی است: دناتوراسیون (جدا شدن رشتهها)، اتصال یا هیبریداسیون پرایمرها (Annealing)، و طویلسازی (Elongation).
در مرحله دناتوراسیون، DNA تا دمای ۹۵ درجه سانتیگراد گرم میشود تا پیوندهای هیدروژنی بین بازهای مکمل دو رشته DNA شکسته شود. بلافاصله پس از آن، مرحله Annealing رخ میدهد که طی آن DNA تا دمای ۳۷ تا ۷۲ درجه کاهش می یابد تا پیوندهای هیدروژنی مجدداً شکل گیرند. بهترین دمای Annealing معمولاً بین ۵۵ تا ۷۲ درجه است و این دما بر اساس ویژگیهای پرایمرهای مورد استفاده تعیین میشود.
پرایمرها معمولاً دارای طول ۲۰ تا ۲۵ نوکلئوتید هستند و به محلهای مکمل خود در انتهای 3’ رشته الگو متصل میشوند. این اتصال باعث تشکیل دو مولکول دو رشتهای جدید میشود. مرحله بعد، دمای مناسب برای فعالیت آنزیم، بین ۷۵ تا ۸۰ درجه سانتیگراد انتخاب میشود تا DNA پلیمراز بتواند بهدرستی سنتز DNA را انجام دهد.
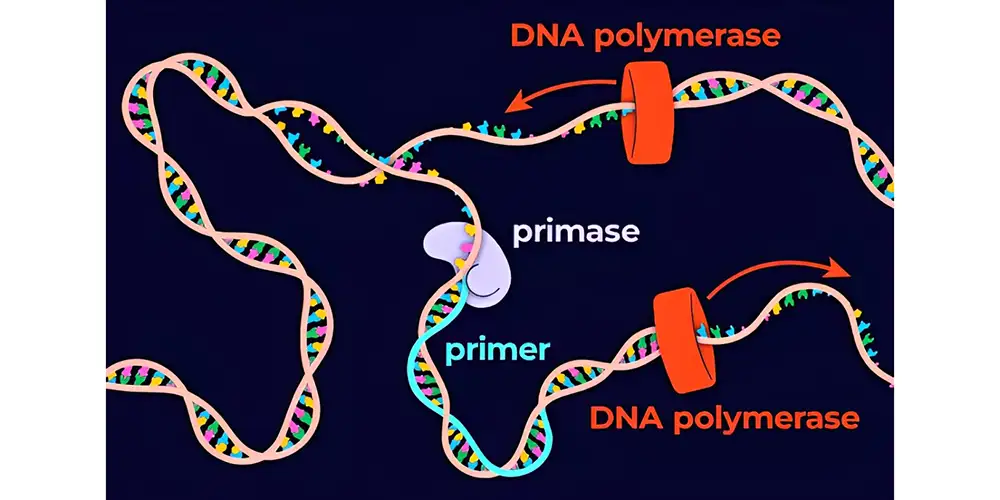
برای عملکرد DNA پلیمراز، حضور DNA دو رشتهای ضروری است. آنزیم، سنتز DNA جدید را در جهت 5′ به 3′ انجام داده و رشتههایی مشابه با الگوی اصلی تولید میکند. این فرآیند در یک دستگاه به نام ترموسایکلر (Thermal Cycler) که دما و زمان هر چرخه را کنترل میکند، چندین بار تکرار میشود.
پس از حدود ۳۰ تا ۴۰ چرخه، افزایش تکثیر به دلیل محدودیت مواد واکنشدهنده و عواملی مانند تجمع مولکولهای پیروفسفات، اتصال بیش از حد پرایمرها به خود (Self-Annealing) و وجود بازدارندهها در نمونه، کاهش مییابد. از جمله بازدارندههای متداول میتوان به پروتئیناز K (که موجب تخریب تاک پلیمراز میشود)، فنول، EDTA، شویندههای یونی، هپارین، اسپرمیدین، هموگلوبین، رنگهای برموفنول و زایلن سیانول اشاره کرد.
برای رفع این مشکلات، از روشهایی مانند دیالیز، رسوبدهی با اتانول، استخراج با کلروفرم و کروماتوگرافی برای خالصسازی DNA استفاده میشود.
پس از تکثیر DNA، برای مشاهده نتایج، از الکتروفورز ژل آگارز همراه با رنگآمیزی با اتیدیوم بروماید استفاده میشود و ژل با نور فرابنفش بررسی میشود. مرحلهای کلیدی در این روند، بررسی اختصاصیت نتایج با استفاده از هایبریداسیون Southern Blot است که به حذف تکثیرهای غیراختصاصی مانند دایمرهای پرایمر کمک میکند.
PCR سه مرحله اصلی دارد که شامل یک فرایند گرم و سرد کردن متوالی است:
مرحله اول، دناتوراسیون (Denaturing):
در این مرحله، DNA دو رشتهای که بهعنوان قالب (template) استفاده میشود، گرم میشود.
افزایش دما باعث شکسته شدن پیوندهای هیدروژنی بین دو رشته DNA میشود و در نتیجه، این دو رشته از هم جدا میشوند و دو رشته تک رشتهای بهوجود میآید.
مرحله دوم، اتصال پرایمرها (Annealing):
در این مرحله، دما کاهش پیدا میکند تا پرایمرهای DNA بتوانند به نقاط خاصی از DNA قالب متصل شوند.
این پرایمرها، دو سمت ناحیهای را که باید تکثیر شود، مشخص میکنند.
مرحله سوم، گسترش یا بسط دادن (Extending):
در این مرحله، دوباره دما افزایش داده میشود و آنزیم Taq پلیمراز شروع به کار میکند.
این آنزیم، بازهای نوکلئوتیدی را به رشته جدید اضافه میکند و در نتیجه، یک رشته جدید DNA ساخته میشود که مکمل رشته قالب است.

این سه مرحله (دناتوراسیون، اتصال پرایمر و گسترش) ۲۰ تا ۴۰ بار تکرار میشوند.
در هر چرخه، تعداد نسخههای DNA دو برابر میشود.
این فرایند به نام چرخه حرارتی یا Thermal Cycling شناخته میشود و توسط دستگاهی انجام میشود . این دستگاه که PCR را انجام میدهد، ترمال سایکلر (Thermal Cycler) نام دارد.
بسته به سرعت این دستگاه، انجام PCR میتواند کمتر از یک ساعت یا چند ساعت طول بکشد.
پس از پایان واکنش PCR، میتوان از روشی به نام الکتروفورز (Electrophoresis) استفاده کرد تا مقدار و اندازه قطعات DNA تولید شده بررسی و مشاهده شوند.
در هر مرحله از PCR چه اتفاقی میافتد؟
مرحله اول: دناتوراسیون (Denaturing)
در این مرحله، مخلوط واکنش تا دمای ۹۴ تا ۹۵ درجه سانتیگراد گرم میشود و این دما برای مدت ۱۵ تا ۳۰ ثانیه حفظ میگردد.
در اثر این دمای بالا، پیوندهای هیدروژنی بین بازهای آلی (بازهای نوکلئوتیدی) موجود در دو رشته DNA قالب شکسته میشوند و در نتیجه، دو رشته DNA از یکدیگر جدا میشوند.
در اثر این جداسازی، دو رشته تکرشتهای DNA بهوجود میآید که هر کدام از آنها بهعنوان قالبی برای ساخت نسخه جدید از رشته DNA عمل خواهند کرد.
در این مرحله، خیلی مهم است که دمای بالا به مدت کافی حفظ شود تا مطمئن شویم که رشتههای DNA به طور کامل از هم جدا شدهاند.
مرحله دوم: اتصال (Annealing)
در این مرحله، واکنش سرد میشود تا امکان اتصال (باند شدن) پرایمرها به مکان خاصی روی رشته تکرشتهای DNA قالب از طریق پیوندهای هیدروژنی فراهم شود.
دمای مورد نیاز در این مرحله بسته به ویژگیهای پرایمر متفاوت است، اما معمولاً بین ۵۰ تا ۶۵ درجه سانتیگراد قرار دارد.
دو رشته جداشده DNA مکمل یکدیگر هستند و در جهتهای مخالف حرکت میکنند (یکی از سر ۵ پریم (5’) به ۳ پریم (3’) و دیگری برعکس). به همین دلیل، دو پرایمر مورد نیاز است: یک پرایمر رو به جلو (forward primer) و یک پرایمر معکوس (reverse primer).
این مرحله بسیار مهم است زیرا پرایمرها نقطه شروع سنتز DNA را فراهم میکنند؛ آنها یک ناحیه کوتاه از DNA دو رشتهای ایجاد میکنند تا آنزیم پلیمراز بتواند فعالیت خود را آغاز کند. فقط زمانی که پرایمر متصل شود، آنزیم DNA پلیمراز میتواند متصل شده و رشته مکمل جدید DNA را بسازد.
در این مرحله، آنزیم با استفاده از بازهای آزاد DNA که در محل واکنش وجود دارند، در مرحله بعدی (گسترش یا Extending) سنتز DNA را آغاز میکند.
مدت زمان این مرحله معمولاً بین ۱۰ تا ۳۰ ثانیه است.
مرحله سوم: گسترش (Extending)
در این مرحله، دمای واکنش به ۷۲ درجه سانتیگراد افزایش پیدا میکند تا آنزیم خاصی به نام Taq DNA پلیمراز بتواند رشته جدید DNA را بسازد و بازهای نوکلئوتیدی DNA را به رشته اضافه کند.
Taq DNA پلیمراز آنزیمی است که از باکتری Thermus aquaticus (مخفف آن: Taq) گرفته شده است:
این باکتری معمولاً در چشمههای آب گرم زندگی میکند، بنابراین میتواند دماهای بالاتر از ۸۰ درجه سانتیگراد را تحمل کند، اما دمای بهینه فعالیت آن ۷۲ درجه سانتیگراد است.
پلیمراز این باکتری در برابر دماهای بالا بسیار مقاوم است، به همین دلیل میتواند دمای بالایی را که در مرحله دناتوراسیون برای شکستن رشتههای DNA لازم است، تحمل کند.
پلیمراز DNA بیشتر موجودات دیگر نمیتواند چنین دماهایی را تحمل کند؛ برای مثال، پلیمراز انسان در دمای ۳۷ درجه سانتیگراد (دمای بدن) بهترین عملکرد را دارد.
در دمای ۷۲ درجه سانتیگراد، Taq پلیمراز کار خود را آغاز کرده و شروع به ساخت رشته مکمل میکند. این آنزیم ابتدا به پرایمر متصل میشود و سپس بازهای نوکلئوتیدی را یکییکی در جهت ۵ پریم به ۳ پریم (5’ → 3’) به رشته اضافه میکند.
نتیجه این فرآیند، تشکیل یک رشته جدید DNA و در نهایت یک مولکول DNA دو رشتهای کامل است.
مدت زمان این مرحله بستگی به طول توالی DNA دارد که قرار است تکثیر شود. معمولاً کپی کردن هر ۱۰۰۰ باز DNA حدود یک دقیقه زمان میبرد.
تکرار فرآیند
این سه مرحله چرخه حرارتی (thermal cycling) بین ۲۰ تا ۴۰ بار تکرار میشود تا تعداد زیادی از توالی مورد نظر DNA تولید شود.
جالب است بدانید که قطعههای جدید DNA که در طی PCR ساخته میشوند نیز به عنوان قالبهای جدید عمل میکنند، که آنزیم DNA پلیمراز میتواند به آنها متصل شود و فرآیند ساخت DNA را مجدد آغاز کند.
نتیجه نهایی، تولید تعداد بسیار زیادی نسخه از یک بخش خاص DNA در مدت زمانی نسبتاً کوتاه است.

نکات مهم برای به حداقل رساندن خطاهای PCR و دستیابی به بهترین نتایج
🔬 ۱. استفاده از DNA الگو با کیفیت بالا
-
مطمئن شوید DNA شما خالص و عاری از آلودگیهایی مثل پروتئین، اتانول، فنل یا EDTA است.
-
با استفاده از طیفسنج (مانند نسبت A260/A280) یا فلورومتر میزان خلوص و غلظت DNA را بررسی کنید.
🧪 ۲. طراحی دقیق پرایمرها
-
طول پرایمر باید حدود ۱۸ تا ۲۵ نوکلئوتید باشد.
-
دمای ذوب (Tm) بین ۵۵ تا ۶۵ درجه سانتیگراد و در هر دو پرایمر نزدیک به هم (اختلاف کمتر از ۲–۳ درجه) باشد.
-
از تشکیل ساختارهای ثانویه مانند هیرپین یا دایمر پرهیز کنید.
-
از ابزارهای آنلاین مانند Primer3، NCBI Primer-BLAST یا OligoAnalyzer برای طراحی استفاده کنید.
🧬 ۳. بهینهسازی غلظت منیزیم (Mg²⁺)
-
منیزیم بر فعالیت و اختصاصیت آنزیم تاثیر مستقیم دارد.
-
غلظت معمولاً در بازه ۱٫۵ تا ۲٫۵ میلیمولار تنظیم میشود.
-
غلظت کم = بازده پایین | غلظت زیاد = محصولات غیر اختصاصی
⚗️ ۴. استفاده از DNA پلیمراز Hot-Start یا High-Fidelity (در صورت نیاز)
-
آنزیمهای High-Fidelity (مثل Phusion یا Q5) احتمال خطا را کاهش میدهند.
-
پلیمرازهای Hot-Start تنها در دمای بالا فعال میشوند و از تولید باندهای غیر اختصاصی جلوگیری میکنند.
📋 ۵. محیط کار تمیز داشته باشید
-
از مناطق جداگانه و پیپتهای مجزا برای آمادهسازی مواد، اضافه کردن DNA و آنالیز بعد از PCR استفاده کنید.
-
از دستکش، نوکپیپت فیلتر دار و روشهای جلوگیری از آلودگی استفاده کنید.
🔁 ۶. بهینهسازی دمای اتصال (Annealing)
-
برای یافتن بهترین دمای اتصال، از PCR گرادیان استفاده کنید.
-
دمای پایین = اتصال غیر اختصاصی | دمای بالا = عدم تکثیر
🧊 ۷. خنک نگه داشتن مواد قبل از شروع PCR
-
خصوصاً آنزیم Taq و پرایمرها باید روی یخ نگهداری شوند تا از فعال شدن زودهنگام جلوگیری شود.
⏱️ ۸. استفاده از شرایط مناسب چرخههای دمایی
مقادیر پیشنهادی:
-
Denaturation (باز شدن رشتهها): ۹۴–۹۵ درجه، ۱۵–۳۰ ثانیه
-
Annealing (اتصال پرایمرها): حدود ۵۵–۶۵ درجه، ۱۵–۳۰ ثانیه
-
Extension (بسط رشته جدید): ۷۲ درجه، حدود ۱ دقیقه به ازای هر kb
بیش از ۳۵ چرخه توصیه نمیشود، چون باعث ایجاد محصولات غیراختصاصی میشود.
🧼 ۹. استفاده از کنترلهای مناسب
-
کنترل مثبت: بررسی کارکرد درست PCR
-
کنترل منفی (بدون DNA الگو): تشخیص آلودگی
-
کنترل بدون آنزیم RT (در RT-PCR): بررسی وجود یا عدم وجود DNA ژنومی
🧬 ۱۰. بررسی محصولات PCR با ژل الکتروفورز
-
محصولات PCR خود را روی ژل آگارز اجرا کنید تا از اندازه درست و خلوص آنها مطمئن شوید.
⚠️ نکات اضافی برای جلوگیری از خطا
-
از لولههای PCR یکبار مصرف استفاده کنید.
-
لولهها را واضح و دقیق برچسب بزنید.
-
آنزیمها را وُرتکس نکنید، فقط بهآرامی با پیپت مخلوط کنید.
مواد و تجهیزات مورد نیاز برای انجام PCR (واکنش زنجیرهای پلیمراز)
🧪 الف. مواد (مواد شیمیایی مورد نیاز)
۱. الگوی DNA (DNA Template)
این ماده همان DNA اولیهی شماست که حاوی ناحیه مورد نظر برای تکثیر است. میتواند از باکتری، سلول انسانی، گیاهی یا حیوانی استخراج شده باشد. کیفیت و خلوص این DNA تأثیر مستقیمی بر موفقیت PCR دارد.
۲. پرایمرها (Forward و Reverse)
دو توالی کوتاه و اختصاصی از DNA که ابتدای و انتهای ناحیهی هدف را مشخص میکنند. پرایمرها به طور اختصاصی به رشتهی مکمل خود در الگو متصل میشوند و به آنزیم اجازه میدهند که از آن نقطه شروع به تکثیر کند. طراحی صحیح پرایمر برای اختصاصی بودن PCR بسیار مهم است.
۳. dNTPs (نوکلئوتیدهای سهفسفاته)
این چهار مولکول (dATP، dTTP، dCTP، dGTP) مواد خامی هستند که آنزیم پلیمراز از آنها برای ساخت رشته جدید DNA استفاده میکند. نبود یا عدم تعادل این نوکلئوتیدها باعث توقف یا خطا در تکثیر میشود.
۴. آنزیم DNA پلیمراز
آنزیمی است که نوکلئوتیدها را به توالی مکمل DNA اضافه میکند. رایجترین نوع آن، Taq پلیمراز است که از باکتری Thermus aquaticus استخراج شده و نسبت به دمای بالا مقاوم است. آنزیمهای دقیقتری مانند Phusion و Q5 برای کاربردهایی که دقت بالا نیاز دارند استفاده میشوند. نوع Hot-Start برای کاهش تولید باندهای غیر اختصاصی در آغاز واکنش توصیه میشود.
۵. MgCl₂ (منیزیم کلراید)
یون منیزیم بهعنوان کوفاکتور ضروری برای فعالیت آنزیم پلیمراز عمل میکند. مقدار آن باید دقیق تنظیم شود، زیرا کم بودن باعث کاهش فعالیت آنزیم و زیاد بودن منجر به تکثیر غیر اختصاصی میشود.
۶. بافر PCR
محیط شیمیایی مناسب (از نظر pH و غلظت یونها) را برای عملکرد صحیح آنزیم پلیمراز فراهم میکند. این بافر معمولاً همراه آنزیم عرضه میشود و نقش کلیدی در پایداری واکنش دارد.
۷. آب بدون آنزیم نوکلئاز (Nuclease-Free Water)
برای رقیقسازی واکنش و رسیدن به حجم نهایی استفاده میشود. این آب باید استریل و عاری از آنزیمهایی مانند DNase و RNase باشد تا از تخریب DNA جلوگیری شود.
🧫 ب. مواد اختیاری
۱. افزودنیهایی مانند DMSO یا بتائین
این مواد به کاهش ساختارهای ثانویه DNA کمک میکنند، مخصوصاً در نواحی با درصد GC بالا یا رشتههای مو شکل (hairpin). در نتیجه، باعث بهبود کارایی تکثیر و کاهش باندهای غیر اختصاصی میشوند.
۲. رنگ بارگذاری (Loading Dye)
به واکنش PCR اضافه نمیشود، اما قبل از بارگذاری محصول روی ژل الکتروفورز استفاده میشود. این رنگ به سنگین شدن نمونه کمک میکند تا در چاهک ژل بماند و همچنین مهاجرت نمونه را در حین الکتروفورز قابل مشاهده میکند.
🧰 ج. تجهیزات
۱. ترموسایکلر (Thermal Cycler)
دستگاهی است که بهصورت دقیق مراحل دمایی واکنش PCR (Denaturation، Annealing و Extension) را کنترل میکند. تنظیم درست برنامه دمایی، اساس موفقیت PCR است.
۲. میکروپیپتها
برای اندازهگیری دقیق حجمهای کم از مواد مورد استفاده قرار میگیرند. حجمهای مختلف پیپت برای اجزای مختلف واکنش نیاز هستند. دقت در پیپتکردن، مانع آلودگی و خطا در غلظت مواد میشود.
۳. سریهای فیلتر دار (Filtered Tips)
سرهای یکبار مصرف با فیلتر داخلی، که مانع از ورود آئروسل یا ذرات ریز به داخل پیپت میشوند. استفاده از آنها احتمال آلودگی متقاطع را کاهش میدهد، بهویژه در آزمایشهایی با حساسیت بالا مانند PCR.
۴. تیوبهای PCR (0.2 یا 0.5 میلیلیتر)
لولههای مخصوص با دیواره نازک که به انتقال سریع حرارت از دستگاه ترمال سایکلر به محتویات کمک میکنند. این تیوبها درب محکمی دارند که از تبخیر جلوگیری میکند.
۵. رک لوله (Tube Rack)
وسیلهای برای نگهداری ایستاده و منظم تیوبها روی یخ یا در دمای اتاق. استفاده از رک احتمال ریختن یا گم شدن نمونهها را کاهش میدهد.
۶. سطل یخ یا بلوک خنککننده
برای نگهداری اجزای حساس به دما مانند آنزیم یا مستر میکس در حین آمادهسازی واکنش. نگهداشتن آنها در دمای پایین تا لحظه افزودن به واکنش، کیفیت PCR را افزایش میدهد.
🧪 د. تجهیزات مورد نیاز برای آنالیز PCR (اختیاری ولی پرکاربرد)
۱. سیستم الکتروفورز ژل آگارز
برای بررسی وجود و اندازهی محصول PCR استفاده میشود. مواد مورد نیاز:
-
آگارز: برای ساخت ژل نیمهجامد که DNA در آن تفکیک میشود.
-
بافر (TAE یا TBE): هدایت جریان برق را در ژل فراهم میکند.
-
مارکر DNA: راهنمای اندازهگیری نوارهای حاصل از PCR.
-
سینی و شانه: برای ریختن ژل و ایجاد چاهکها.
-
منبع تغذیه و تانک ژل: برای اعمال ولتاژ و حرکت DNA در ژل.
۲. رنگآمیزی و مشاهده DNA
برای مشاهده نوارهای DNA بعد از الکتروفورز از رنگهایی مانند اتیدیوم بروماید، SYBR Safe یا GelRed استفاده میشود. نوارهای رنگشده توسط ترانسایلومیناتور UV یا نور آبی قابل مشاهده هستند.
📦 ه. گزینههای آماده برای صرفهجویی در زمان
۱. PCR Master Mix
مخلوط آمادهای است که شامل آنزیم، dNTP، بافر و MgCl₂ است. با استفاده از این مخلوط، تنها کافیست پرایمر، DNA و آب اضافه شود. این روش باعث کاهش خطا و افزایش سرعت در تنظیم واکنش میشود.
۲. کیتهای PCR
این کیتها شامل تمام اجزای مورد نیاز با غلظتها و شرایط بهینهشده هستند. برای کاربران تازهکار یا آزمایشهای روتین گزینهای مناسب و قابل اعتمادند.
🔬 در صورت استفاده از Real-Time PCR (qPCR)
۱. رنگهای فلورسانس یا پروبها
در qPCR بهجای رنگزنی پس از واکنش، از رنگهای فلورسانس مانند SYBR Green یا پروبهایی مانند TaqMan استفاده میشود که به صورت همزمان و در لحظهی تکثیر، سیگنال نوری تولید میکنند.
۲. دستگاه Real-Time PCR
این دستگاه امکان مشاهدهی لحظهای و کمّی شدن میزان DNA تکثیرشده را فراهم میکند. برای مطالعات دقیق بیانی ژن، تشخیص بیماری و بررسی سطح ویروس در نمونهها کاربرد دارد.
مزایا و انواع پیشرفته PCR
استفاده از PCR در علوم پایه و زیستپزشکی مزایای زیادی دارد. از جمله تولید سریع نتایج (معمولاً طی چند ساعت تا ۳ روز)، نیاز به مقدار کم DNA یا RNA (۰.۱ تا ۵ میکروگرم)، و توانایی برای تکثیر ۱۰⁶ تا ۱۰⁹ نسخه DNA در زمان کوتاه.
Real-Time PCR
ریل تایم پی سی آر (Real-time PCR)، از رنگهای فلورسانس برای تشخیص سریعتر و حذف مراحل پس از PCR استفاده میشود. این روش به دلیل توانایی در تشخیص سریع آمپیلیکونها، بسیار محبوب است، اما به دلیل نیاز به مواد خاص فلورسانس و سختافزارهای گرانقیمت، هزینه بالاتری دارد.
واکنش زنجیرهای پلیمراز رونویسی معکوس (RT-PCR)
در RT-PCR، از RNA پیامرسان برای سنتز DNA مکمل استفاده میشود که توسط آنزیم DNA پلیمراز مشتقشده از رتروویروسها انجام میشود. این روش میتواند همراه با PCR معمولی برای تحلیل کیفی بیان ژن بهکار رود. ترکیب RT-PCR با PCR زمان واقعی، امکان تحلیل کمی تفاوت بیان ژنها را فراهم میسازد.
در طول پاندمی COVID-19 واکنش زنجیرهای پلیمراز رونویسی معکوس (RT-PCR) بهعنوان ابزار اصلی تشخیص مورد استفاده قرار گرفت. نمونهها معمولاً از نواحی فوقانی دستگاه تنفس (نزدیک بینی، حلق، دهان) با استفاده از سواب، شستشو یا لاواژ برونکوآلوئولار جمعآوری میشوند.
عوامل مداخلهگر
آزمایش PCR با وجود دقت بالا، چند ایراد مهم دارد. این تست بسیار حساس است و حتی مقدار بسیار کمی آلودگی در DNA یا RNA را شناسایی میکند، که ممکن است باعث نتایج نادرست شود. طراحی آغازگرها (Primers) در این روش نیازمند توالیهای خاصی برای شناسایی دقیق عوامل بیماریزا و ژنهای هدف است.
گاهی اوقات، این آغازگرها به طور غیر اختصاصی به ژنهایی که شباهت زیادی به ژن هدف دارند ولی دقیقاً یکسان نیستند، متصل میشوند که این نیز میتواند در روند آزمایش اختلال ایجاد کند.
همچنین احتمال تشکیل دایمرهای آغازگر (Primer-dimers) وجود دارد که توسط آنزیم DNA پلیمراز تقویت میشوند و ممکن است با سایر مواد مورد استفاده در واکنش رقابت کنند و بر دقت نتیجه تأثیر بگذارند.
نتایج، گزارشدهی و یافتههای مهم
در آزمایش PCR، فرآیند تکثیر DNA با استفاده از رنگهای فلورسانس که به DNA دو رشتهای یا به پروبهای اختصاصی توالی متصل میشوند، قابل مشاهده است. این واکنش شامل یک چرخه به نام چرخهی کمی (Cq) است. Cq نشاندهنده تعداد چرخههایی است که لازم است تا شدت فلورسانس به یک حد مشخص برسد و بتوان آن را اندازهگیری کرد.
پس از مشخص شدن مقدار Cq، میتوان نتیجهای کیفی (مثلاً مثبت یا منفی بودن نمونه) گرفت، یا در صورت نیاز، تحلیل کمی دقیقتری انجام داد. مقدار Cq وابسته به کارایی PCR است؛ کارایی PCR به معنای میزان افزایش DNA در هر چرخه است که بین ۱ تا ۲ برابر متغیر است. اگر مقدار افزایش برابر ۲ باشد، به معنی ۱۰۰٪ کارایی PCR است. این کارایی معمولاً با استفاده از منحنیهای استاندارد و منحنیهای تکثیر بهدست میآید.
با این حال، استفاده از منحنی استاندارد احتمال بروز خطا در رقیقسازی نمونهها را بالا میبرد و میتواند بر دقت اندازهگیری نمونههای بالینی و بیولوژیکی تأثیر بگذارد. در مقابل، منحنیهای تکثیر جداگانه عوامل مداخلهگر کمتری دارند و ممکن است نتایج متفاوتی نسبت به منحنیهای استاندارد در یک تست مشخص ارائه دهند. بنابراین، برای دستیابی به نتایج دقیق، محاسبه درست مقدار هدف و کارایی تکثیر اهمیت زیادی دارد.
وقتی کارایی PCR پایین باشد، برای رسیدن به سطح مناسب فلورسانس، چرخههای بیشتری نیاز است که باعث افزایش مقدار Cq میشود. اگر از پروبهای معتبر استفاده شده باشد و تکثیر مشاهده شود، نشاندهنده وجود ژن هدف در نمونه است و نتیجه مثبت گزارش میشود. اما به دلیل تنوع طبیعی در فرآیند واکنش (که به آن تغییرات پواسون گفته میشود)، عدم مشاهده تکثیر لزوماً به معنی منفی بودن نتیجه نیست.
همانطور که پیشتر گفته شد، در qPCR اندازهگیری DNA یا RNA با استفاده از مقدار Cq انجام میشود. در بسیاری از مواقع، فرض بر این است که کارایی PCR صد درصد است. همچنین، گزارشهای qPCR معمولاً شامل مقدار Cq، دلتا Cq یا دلتا-دلتا Cq هستند. برای تحلیل دقیقتر دادههای بالینی، آزمایشگاهی و تشخیصی، اصلاح بر اساس کارایی PCR باید انجام شود.
در تحلیل نتایج و گزارشدهی PCR، باید این موارد در نظر گرفته شوند تا نتیجهگیری قابل اعتماد باشد.
ارزش تشخیصی مقدار Ct (Cycle Threshold):
مقدار Ct میتواند با علائم بالینی و سابقه بیماری بیمار ترکیب شود تا مرحله و شدت بیماری را بهتر مشخص کند. همچنین، پزشکان میتوانند با تکرار تست PCR در زمانهای مختلف و مقایسه مقادیر Ct بهدستآمده، روند پیشرفت یا بهبود بیماری را ارزیابی کنند. مقدار Ct همچنین میتواند به ردیابی بیماران با بار ویروسی بالاتر کمک کند، چرا که این افراد خطر بیشتری برای انتقال بیماری دارند.

اهمیت بالینی
آزمایش PCR به دلیل حساسیت بالا، ویژگی اختصاصی (اختصاصیت) قوی و زمان پردازش سریع، کاربرد گستردهای در علوم پایه و علوم زیستپزشکی دارد و آن را به ابزاری ارزشمند هم در محیطهای آزمایشگاهی و هم در محیطهای بالینی تبدیل کرده است. این تکنیک به طور مکرر برای شناسایی انواع میکروارگانیسمهای عامل بیماریهای عفونی ویروسی به کار گرفته شده است. برخی از پاتوژنهای ویروسی که از طریق PCR قابل شناسایی هستند شامل ویروس پاپیلوم انسانی (HPV)، ویروس HIV، ویروس هرپس سیمپلکس، ویروس SARS-CoV-2 (کرونای جدید)، ویروس واریسلا زوستر (عامل آبله مرغان)، انتروویروسها، سیتومگالوویروس و ویروسهای هپاتیت B، C، D و E میباشند.
از طریق PCR میتوان حضور عوامل باکتریایی، قارچی و انگلی و همچنین انواع نقصهای ایمنی را نیز شناسایی کرد، که این ویژگی، آن را به ابزاری مهم و حیاتی در تشخیصهای بالینی و پزشکی تبدیل کرده است.
شناسایی سریع عوامل بیماریزای میکروبی از طریق PCR در ریل تایم پی سی آر (Real-time PCR) به پزشکان این امکان را میدهد تا به سرعت درمانی متناسب و هدفمند را برای بیمار آغاز کنند. این موضوع باعث کاهش مدت بستری در بیمارستان و همچنین جلوگیری از تجویز نادرست آنتیبیوتیکها میشود و در نتیجه به کاهش مقاومت آنتیبیوتیکی کمک میکند.
ریل تایم پی سی آر (Real-time PCR) قابلیت شناسایی گونههای خاصی از باکتریها را دارد، مانند گونههای مایکوباکتریوم، گونههای لپتوسپیرا، گونههای کلامیدیا، باکتری لژیونلا پنوموفیلا، لیستریا مونوسیتوژنز و نایسریا مننژیتیدیس.
همچنین اثبات شده که ریل تایم پی سی آر (Real-time PCR) میتواند گونههای مقاوم به آنتیبیوتیک را نیز با دقت بالا شناسایی و بررسی کند، از جمله استافیلوکوکوس اورئوس، استافیلوکوکوس اپیدرمیدیس، هلیکوباکتر پیلوری و انتروکوکوس.
افزون بر این، بیماریهای شدید و حاد (fulminant) نیز بهدلیل حساسیت و ویژگی بالای این تست و سرعت زیاد آن، در مراحل ابتدایی شناسایی و بررسی میشوند، که همین مسئله باعث میشود این روش به گزینهای ایدهآل برای تشخیص بیماریهایی مانند مننژیت، سپسیس (عفونت خونی) و بیماریهای التهابی روده تبدیل شود.
عوامل بیماریزای میکروبی دیگری که در بروز بیماریهای منتقله از غذا نقش دارند، مانند استرپتوکوک گروه B، گونههای مایکوباکتریوم، باکتروئیدس وولگاتوس و اشریشیا کلی، نیز میتوانند از طریق تست PCR در زمان واقعی شناسایی شوند.
سرعت بالای این تست امکان شناسایی زودهنگام را فراهم میکند، که به ردیابی منبع آلودگی و کنترل شیوعهای فعلی یا بالقوه کمک میکند.
پاتوژنهای قارچی، انگلی و پروتوزوآیی مانند آسپرژیلوس فومیگاتوس، آسپرژیلوس فلاووس، کریپتوسپوریدیوم پاروم و توکسوپلاسما گوندی نیز از طریق این تست قابل شناسایی هستند.
علاوه بر این، از PCR برای بررسی هیستوپاتولوژی ژنهای ویروسی و سلولی جهت درک و تشخیص بیماریهای بدخیم انسانی استفاده میشود.
PCR همچنین در تجزیه و تحلیل نمونههای جرمشناسی، بررسی موتاسیونهای نقطهای (Point Mutations)، توالییابی DNA و in vitro موتاژنز (in vitro mutagenesis) نیز کاربرد دارد.
این تکنیک توانایی بالایی در غربالگری و شناسایی سریع آللهای خاص دارد که آن را برای آزمایشهای ژنتیکی پیش از تولد جهت بررسی وضعیت ناقلی (Carrier status) ایدهآل میسازد.
PCR همچنین قادر به شناسایی حضور بیماری یا جهشهای ژنی هم در دوران جنینی (in utero) و هم در بزرگسالی است.
کنترل کیفیت و ایمنی آزمایشگاه
به دلیل نتایج امیدوارکنندهای که تکنیک PCR ارائه میدهد، PCR معمولی (Conventional PCR) به عنوان استاندارد طلایی برای غربالگری و شناسایی در حوزههای مختلف علمی شناخته میشود. با این حال، رعایت دقیق مراحل کار پس از انجام PCR برای ارزیابی صحیح محصول تکثیر شده (آمپلیکون) بسیار ضروری است. در صورتی که پس از انجام PCR، مراحل بعدی بهدرستی مدیریت نشوند، ممکن است آمپلیکونها به میزان زیاد در فضای آزمایشگاه پخش شوند و باعث آلودگی شوند.
برای جلوگیری از آلودگی در فرآیند PCR، بسیار مهم است که یک بخش خاص از آزمایشگاه بهطور اختصاصی برای انجام تست PCR در نظر گرفته شود، تا از هرگونه آشفتگی و تداخل غیرضروری در این ناحیه جلوگیری شود. استفاده از ماسک صورت، دستکش و کلاه مخصوص مو در محیط آزمایشگاه الزامی است تا از ورود آلودگی جلوگیری شود. محل آمادهسازی و نگهداری محلولها، مانند پیپتها، ظروف شیشهای و پلاستیکی، نباید آلوده به DNA باشند یا در معرض DNA قرار گرفته باشند.
در یک قسمت خاص از فریزر که نزدیکترین فاصله را با هود لامینار دارد، باید آنزیمها و بافرها نگهداری شوند. هر نوع معرف یا ماده شیمیایی که استفاده میشود، باید بلافاصله پس از استفاده دور ریخته شود. مناسبترین مکان برای انجام PCR در آزمایشگاه، هود لامینار با چراغ فرابنفش (UV) است. تجهیزاتی مانند پیپتها، دستکشهای استریل و میکروسانتریفیوژ نیز باید در داخل هود لامینار قرار داده شوند.
منابع :
https://www.ncbi.nlm.nih.gov/books/NBK589663/
https://www.yourgenome.org/theme/what-is-pcr-polymerase-chain-reaction/