
اسید آزمایشگاه
اسید یک مولکول یا یونی است که قادر به اهدای پروتون (یعنی یون هیدروژن،(H+ است که به عنوان اسید برونستد-لوری شناخته میشود، یا یک پیوند کووالانسی با یک جفت الکترون به نام اسید لوئیس تشکیل میدهد.
اولین دسته از اسیدها، اهداکنندگان پروتون یا اسیدهای برونستد-لوری هستند.همچنین در محلول های آبی، اهداکنندگان پروتون یون هیدرونیوم H3O+ را تشکیل می دهند و به نام اسیدهای آرنیوس شناخته میشوند. اسید برونستد یا آرنیوس معمولاً حاوی یک اتم هیدروژن است که به یک ساختار شیمیایی پیوند خورده است که پس از از دست دادن H + همچنان از نظر انرژی مطلوب است.
دسته دوم اسیدها، اسیدهای لوئیس هستند که با انتقال جفت الکترون تشکیل پیوند کووالانسی می دهند. به عنوان مثال تری فلوئورید بور (BF3) است که اتم بور آن دارای یک اوربیتال خالی است که می تواند با انتقال جفت الکترون تنها روی یک اتم در یک پایه، به عنوان مثال اتم نیتروژن در آمونیاک (NH3) یک پیوند کووالانسی تشکیل دهد.
اسیدها موادی دارای طعم ترش هستند که با بازها و برخی فلزات (مانند کلسیم) واکنش داده و نمکها را تشکیل میدهند. کلمه اسید از کلمه لاتین acidus/acēre به معنای ترش گرفته شده است. اسید ها دارای pH کمتر از 7 هستند. pH پایین تر به معنای اسیدیته بالاتر و در نتیجه غلظت بالاتر یون های هیدروژن مثبت در محلول است. اسیدها رسانای خوبی برای الکتریسیته هستند.
اسید آزمایشگاهی
اسیدهای آرنیوس
در سال 1884، Svante Arrhenius خواص اسیدیته را به یون های هیدروژن (H+) نسبت داد که بعدها به عنوان پروتون یا هیدرون توصیف شد. اسید آرنیوس ماده ای است که وقتی به آب اضافه می شود، غلظت یون های H+ را در آب افزایش می دهد. توجه داشته باشید که شیمیدانان اغلب H+(aq) را می نویسند و در هنگام توصیف واکنش های اسید-باز به یون هیدروژن اشاره می کنند، اما هسته هیدروژن آزاد، یک پروتون، به تنهایی در آب وجود ندارد، به عنوان یون هیدرونیوم (H3O+) یا اشکال دیگر وجود دارد ( H5O2+، H9O4+ ) . بنابراین، اسید آرنیوس را میتوان به عنوان مادهای توصیف کرد که غلظت یونهای هیدرونیوم را هنگام اضافه شدن به آب افزایش میدهد. به عنوان مثال می توان به مواد مولکولی مانند اسید کلریدریک و اسید استیک اشاره کرد.
با توجه به این تعادل، هر گونه افزایش در غلظت هیدرونیوم با کاهش غلظت هیدروکسید همراه است. بنابراین، اسید آرنیوس نیز می تواند اسیدی باشد که غلظت هیدروکسید را کاهش می دهد، در حالی که یک باز آرنیوس آن را افزایش میدهد.
اسید های آزمایشگاه
در حالی که مفهوم آرنیوس برای توصیف بسیاری از واکنش ها مفید است، دامنه آن نیز کاملاً محدود است. در سال 1923، شیمیدانان یوهانس نیکولاس برونستد و توماس مارتین لوری هر کدام بطور جداگانه ای متوجه شدند که واکنش های اسید-باز شامل انتقال یک پروتون است. نظریه اسید-باز برونستد-لوری دارای مزایایی نسبت به نظریه آرنیوس است. واکنش های زیر را در مورد اسید استیک (CH3COOH) در نظر بگیرید، اسید آلی که به سرکه طعم خاص آن را می دهد: CH3COOH + H2O ⇌ CH3COO− + H3O+CH3COOH + NH3 ⇌ CH3COO− + NH4+ هر دو نظریه به راحتی اولین واکنش را توصیف می کنند: CH3COOH به عنوان یک اسید آرنیوس عمل می کند زیرا وقتی در آب حل می شود به عنوان منبع H3O+ عمل می کند و با اهدای پروتون به آب به عنوان یک اسید برونستد عمل می کند. در مثال دوم CH3COOH دستخوش همان تبدیل می شود، در این مورد پروتون را به آمونیاک (NH3) اهدا میکند، اما به تعریف اسید آرنیوس مربوط نمی شود زیرا واکنش هیدرونیوم تولید نمی کند. با این وجود، CH3COOH هم یک اسید آرنیوس و هم یک اسید برونستد-لوری است.
نظریه برونستد-لوری را می توان برای توصیف واکنش های ترکیبات مولکولی در محلول غیرآبی یا فاز گاز استفاده کرد.
اسیدهای لوئیس
سومین تعریفی که برای نوعی خاصی از اسید ها بیان میشود در سال 1923 توسط گیلبرت ان. لوئیس نظریه پردازی شد که شامل واکنش اسید-باز است با انتقال جفت الکترون به جای انتقال پروتون می شود. اسید لوئیس گونه ای است که به انتقال یک جفت الکترون از گونه ای به گونه ی دیگر می پردازد. به عبارت دیگر، گیرنده جفت الکترون است. واکنشهای اسید-باز برونستد واکنشهای انتقال پروتون هستند در حالی که واکنشهای اسید-باز لوئیس، انتقال جفت الکترون هستند. بسیاری از اسیدهای لوئیس، اسیدهای برونستد-لوری نیستند.
اسید آزمایشگاهی
در اولین واکنش، یک یون فلوئور، F- یک جفت الکترون به تری فلوئور بور می دهد تا محصول تری فلوئوروبورات را تشکیل دهد. فلوئور واکنش دوم را می توان با استفاده از هر دو نظریه توصیف کرد. یک پروتون از یک اسید برونستد نامشخص به آمونیاک، یک باز برونستد منتقل می شود. به طور متناوب، آمونیاک به عنوان یک پایه لوئیس عمل می کند و یک جفت الکترون را برای تشکیل پیوند با یون هیدروژن منتقل می کند. مولکولی که دریافت کننده ی جفت الکترون میباشد اسید لوئیس است. برای مثال، اتم اکسیژن در H3O+ هنگامی که یکی از پیوندهای H-O شکسته شود و الکترون های مشترک در پیوند روی اکسیژن موضعی شوند، یک جفت الکترون به دست می آورد. بسته به زمینه، اسید لوئیس ممکن است به عنوان اکسید کننده یا الکتروفیل نیز توصیف شود. اسیدهای برونستد آلی مانند اسید استیک، سیتریک یا اگزالیک اسید لوئیس نیستند. آنها در آب تجزیه می شوند تا اسید لوئیس، H+ تولید کنند، اما در عین حال مقدار مساوی از یک باز لوئیس (به ترتیب استات، سیترات، یا اگزالات، برای اسیدهای ذکر شده) تولید می کنند.
اساس واکنش پذیری
واکنشهای اسیدها اغلب به شکل HA ⇌ H+ + A- تعمیم مییابند، که در آن HA نماینده اسید و A- باز مزدوج است.این واکنش به عنوان پروتولیز شناخته می شود.شکل پروتونه (HA) یک اسید نیز گاهی اوقات به عنوان اسیدآزاد نامیده میشود.
اسید و باز مزدوج میتوانند با افزودن یا حذف یک پروتون به یکدیگر تبدیل شوند. در محلول بین اسید و باز مزدوج آن تعادلی وجود دارد و میزان این تعادل با ثابت تعادل K بیان میشود. براکت ها غلظت را نشان می دهند، به طوری که [H2O] به معنای غلظت H2O است. ثابت تفکیک اسید Ka به طور کلی در زمینه واکنش های اسید-باز استفاده می شود. و از طریق فرمول زیر محاسبه میشود:
اسید قویتر Ka بالاتر از اسید ضعیفتر خواهد داشت. نسبت یونهای هیدروژن به اسید برای اسید قویتر بیشتر خواهد بود، زیرا اسید قویتر تمایل بیشتری به از دست دادن پروتون دارد. از آنجایی که ممکن است مقادیر Ka بسیار زیاد باشد ، ثابت قابل کنترل تر، pKa بیشتر مورد استفاده قرار میگیرد، جایی که pKa = -log10 Ka. اسیدهای قویتر pKa کمتری نسبت به اسیدهای ضعیف دارند.
شناسایی و سنجش اسیدها
برای شناسایی اسیدها از کاغذ تورنسل استفاده می شود. چنانچه کاغذ تورنسل در مجاورت با ماده ای به رنگ قرمز در آمد یعنی آن ماده اسید می باشد یا حاوی اسیدی است. همچنین دانشمندان از واحد pH برای اندازه گیری اسیدی یا بازی بودن یک ماده استفاده می کنند و مقدار pH مواد توسط pH متراندازه گیری میشود. برای تعیین غلظت یک اسید در محلول آبی، معمولاً تیتراسیون اسید-باز انجام می شود.
کاربرد اسیدها
اسید در صنعت
اسیدها معرف های اساسی در درمان تقریباً تمام فرآیندها در صنعت مدرن هستند. اسید سولفوریک، یک اسید دی پروتیک، پرمصرف ترین اسید در صنعت است و همچنین پرمصرف ترین ماده شیمیایی صنعتی در جهان است. به طور عمده در تولید کود، مواد شوینده، باتری و رنگ و همچنین در پردازش بسیاری از محصولات مانند حذف ناخالصی ها ، از بین بردن زنگ زدگی و خوردگی فلزات استفاده می شود.
اسید سولفوریک (H2SO4) در باتری خودرو استفاده می شود.
اسید سولفوریک (H2SO4) همچنین برای تولید رنگ، رنگ، الیاف مصنوعی و غیره استفاده می شود.
از اسیدهای نیتریک (HNO3) در تولید کودها استفاده می شود.
اسید در غذا
اسید تارتاریک یکی از اجزای مهم برخی از موادغذایی مانند تمر هندی است. سرکه، محلول رقیق شده اسید استیک، کاربردهای خانگی مختلفی دارد. در درجه اول به عنوان نگهدارنده مواد غذایی استفاده می شود.
اسید سیتریک در لیمو و پرتقال وجود دارد وهمچنین می توان از آن در نگهداری مواد غذایی استفاده کرد.
اسید کربنیک (H2CO3) در نوشیدنی های سرد گازدار ما وجود دارد.
اسید در بدن انسان
اسید موجود در معده که عمدتاً از اسید هیدروکلریک -- یا HCl تشکیل شده است یک مایع گوارشی بی رنگ و آبکی است که هدف اصلی آن تجزیه غذا است.
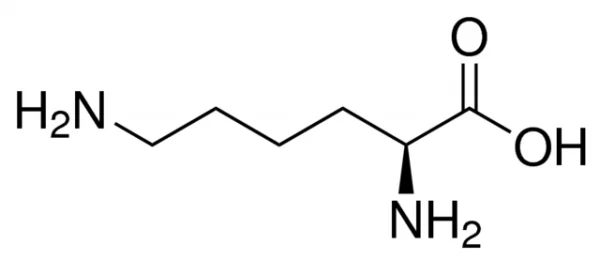
بدن انسان از اسیدهای آمینه برای ساختن پروتئین رشد ترمیم بافت بدن برای کمک به بدن استفاده می کند.
اسیدهای چرب منابع انرژی هستند که بر متابولیسم سلولی و بافتی، عملکرد و پاسخگویی به سیگنال های هورمونی و دیگر تأثیر می گذارد.
دئوکسی ریبونوکلئیک اسید (DNA) به عنوان ماده ژنتیکی که در سلول های یوکاریوتی در هسته قرار دارد، نقش منحصر به فردی دارد. انواع مختلف اسید ریبونوکلئیک (RNA) در تعدادی از فعالیت های سلولی شرکت می کنند.
نقش اسید کربنیک در انتقال دی اکسید کربن در خون مهم است.
کاتالیز اسیدی
اسیدها و بازها هر دو واکنش های مختلفی را کاتالیز می کنند. به عنوان مثال، تجزیه ساکارز به گلوکز و فروکتوز در اسید سولفوریک.
نامگذاری اسید ها
اسیدهای آرنیوس با توجه به آنیون هایشان نامگذاری می شوند. در سیستم نامگذاری کلاسیک، طبق جدول زیر، پسوند یونی حذف شده و با پسوند جدیدی جایگزین می شود. پیشوند "hydro-" زمانی استفاده می شود که اسید فقط از هیدروژن و یک عنصر دیگر تشکیل شده باشد. به عنوان مثال، HCl دارای کلرید به عنوان آنیون آن است، بنابراین از پیشوند hydro- استفاده می شود، و پسوند -ide باعث می شود نام به شکل اسید هیدروکلریک در بیاید.
اسید های رایج
اسید های معدنی
هالیدهای هیدروژن و محلول های آنها: اسید هیدروفلوئوریک (HF)، اسید هیدروکلریک (HCl)، اسید هیدروبرمیک (HBr)، اسید هیدرویدیک (HI)
اکسواسیدهای هالوژن: هیپوکلرو اسید (HClO)، اسید کلر (HClO2)، اسید کلریک (HClO3)، اسید پرکلریک (HClO4)، و آنالوگ های مربوط به برم و ید
هیپوفلوروس اسید (HFO)، تنها اکسواسید شناخته شده برای فلوئور.
اسید سولفوریک (H2SO4)
اسید فلوروسولفوریک (HSO3F)
اسید نیتریک (HNO3)
اسید فسفریک (H3PO4)
اسید کرومیک (H2CrO4)
اسید بوریک (H3BO3)
اسیدهای کربوکسیلیک
کربوکسیلیک اسید را می توان ترکیبی بین دو گروه کاربردی در نظر گرفت: یک گروه الکل، شامل یک هیدروژن متصل به یک اکسیژن، که به یک گروه کربونیل متصل می شود، که شامل یک کربن مضاعف به یک اکسیژن است.
اسید استیک (CH3COOH)
اسید سیتریک (C6H8O7)
اسید فرمیک (HCOOH)
اسید گلوکونیک HOCH2 -(CHOH)4 -COOH
اسید لاکتیک (CH3-CHOH-COOH)
اسید اگزالیک (HOOC-COOH)
اسید تارتاریک (HOOC-CHOH-CHOH-COOH)
اسیدهای نوکلئیک
دئوکسی ریبونوکلئیک اسید (DNA)
اسید ریبونوکلئیک (RNA)