کربوهیدرات متابولیزم: گلوکگونز، گلوکولیز و گلیکوژنس
مقدمهای بر متابولیسم کربوهیدراتها
کربوهیدراتها از مهمترین ترکیبات آلی در طبیعت هستند که نقش حیاتی در تأمین انرژی موجودات زنده ایفا میکنند. این گروه از مواد مغذی بهعنوان اولین و سریعترین منبع تأمین ATP شناخته میشوند و تقریباً در تمام سلولهای بدن مورد استفاده قرار میگیرند. گلوکز، رایجترین و فراوانترین نوع کربوهیدرات، نقش مرکزی در سوخت و ساز بدن ایفا کرده و بهعنوان سوخت اصلی مغز، گلبولهای قرمز و سلولهای عضلانی در هنگام فعالیت شدید محسوب میشود.
علاوه بر نقش انرژیزا، کربوهیدراتها در ساختارهای زیستی نظیر ریبونوکلئیک اسید (RNA)، دئوکسیریبونوکلئیک اسید (DNA)، گلیکوپروتئینها و گلیکولیپیدها حضور دارند و در سیگنالدهی سلولی، چسبندگی سلولها و تنظیم پاسخ ایمنی دخیلاند.
نقش متابولیسم گلوکز در هموستاز انرژی بدن
متابولیسم کربوهیدراتها مجموعهای از مسیرهای آنزیمی است که به بدن اجازه میدهد بین ذخیرهسازی، تولید و مصرف انرژی گلوکز تعادل برقرار کند. سه مسیر اصلی بیوشیمیایی که در این فرآیند نقش دارند عبارتند از:
-
گلیکولیز : فرآیندی که طی آن گلوکز به پیرووات تبدیل شده و انرژی آزاد میشود.
-
گلوکونئوژنز : تولید گلوکز از ترکیبات غیرقندی مانند لاکتات، آمینواسیدها و گلیسرول.
-
گلیکوژنز و گلیکوژنولیز : ذخیرهسازی گلوکز به صورت گلیکوژن و آزادسازی آن در زمان نیاز.
این مسیرها تحت کنترل دقیق هورمونهایی نظیر انسولین، گلوکاگون، کورتیزول و آدرنالین قرار دارند و بسته به وضعیت تغذیهای، فعالیت فیزیکی یا استرسهای فیزیولوژیکی، میزان فعالسازی آنها تغییر میکند.
در افراد سالم، این سیستم تنظیمی باعث میشود سطح گلوکز خون در محدودهی مشخص (حدود 70 تا 110 میلیگرم در دسیلیتر) حفظ شود. اختلال در هر یک از این مسیرها میتواند منجر به بروز بیماریهایی مانند دیابت، هیپوگلیسمی، یا اختلالات متابولیکی ژنتیکی شود.
گلیکولیز: مسیر تجزیهی گلوکز
تعریف و اهمیت گلیکولیز در متابولیسم انرژی
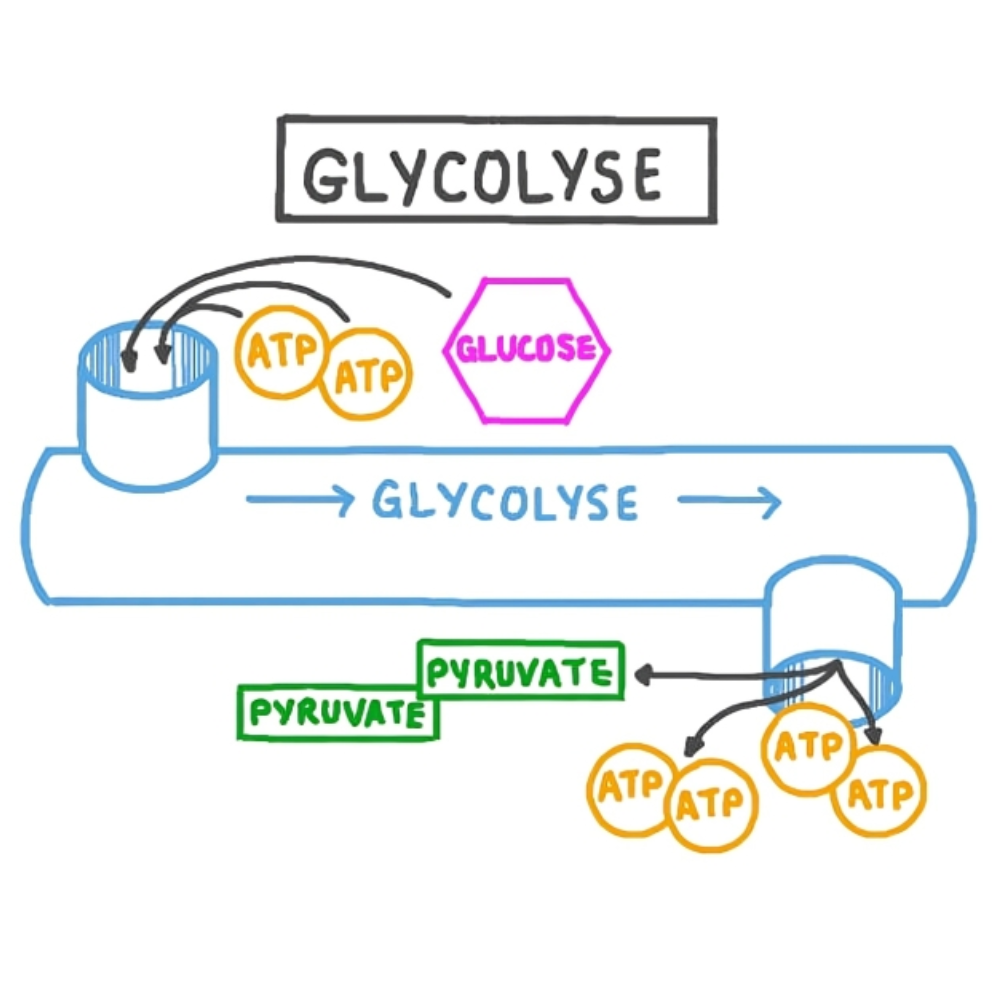
گلیکولیز (Glycolysis) یکی از قدیمیترین و حیاتیترین مسیرهای متابولیک در سلولهای زنده است که طی آن، یک مولکول گلوکز شش کربنه به دو مولکول پیرووات سه کربنه تجزیه میشود. این مسیر در سیتوپلاسم تمام سلولهای یوکاریوتی و پروکاریوتی انجام میگیرد و نیاز به حضور اکسیژن ندارد؛ به همین دلیل، نقش کلیدی در شرایط بیهوازی (anaerobic) ایفا میکند.
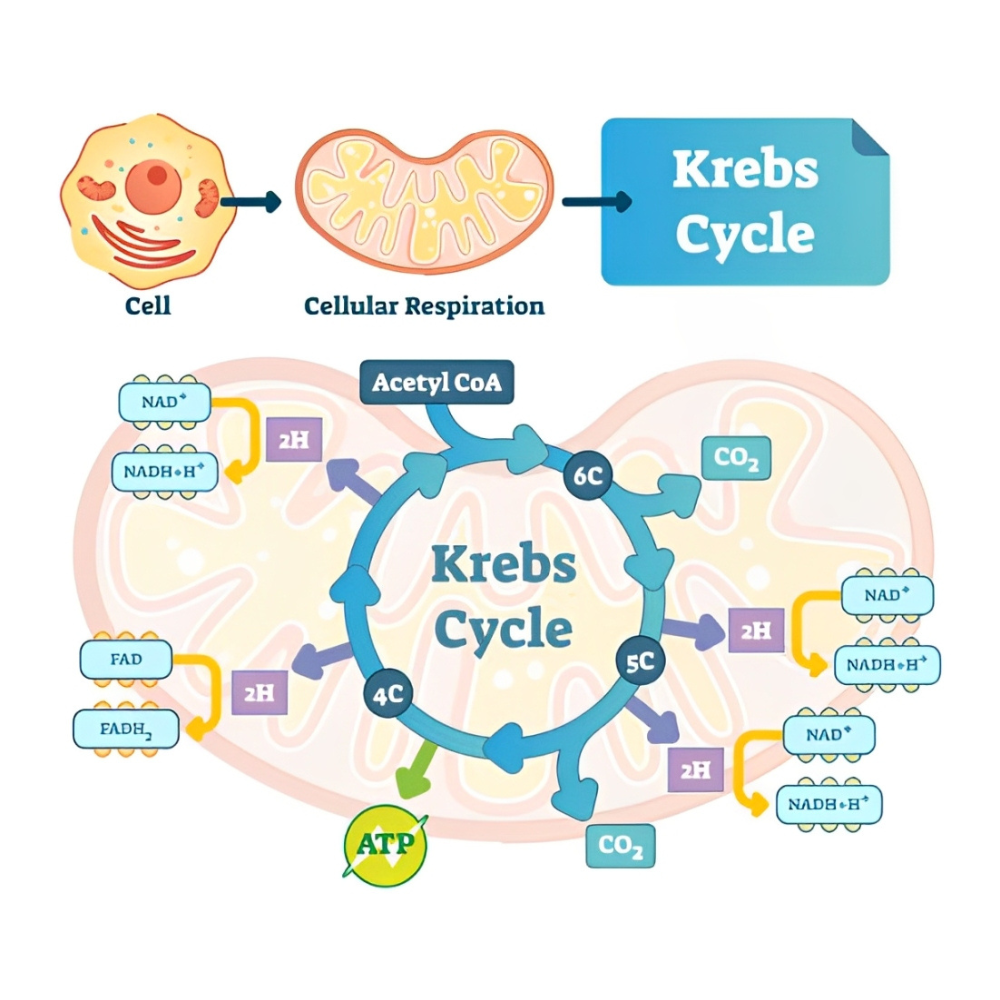
اهمیت گلیکولیز در این است که علاوه بر تولید ATP سریع در شرایط اضطراری، مقدمهای برای ورود به سایر مسیرهای متابولیک مهم از جمله چرخهی اسید سیتریک (TCA) و زنجیره انتقال الکترون است.
مراحل گلیکولیز: از گلوکز تا پیرووات
گلیکولیز شامل ده واکنش آنزیمی متوالی است که به دو فاز کلی تقسیم میشود:
فاز مصرف ATP ) فاز سرمایهگذاری انرژی(
در این فاز، دو مولکول ATP مصرف میشود تا گلوکز فعال سازی شود و در نهایت به دو مولکول گلیسرآلدهید-۳-فسفات (G3P) تبدیل شود.
مراحل مهم این فاز عبارتند از:
-
فسفوریلاسیون گلوکز توسط آنزیم هگزوکیناز یا گلوکوکیناز (در کبد)
-
ایزومریزاسیون گلوکز-۶-فسفات به فروکتوز-۶-فسفات
-
فسفوریلاسیون فروکتوز-۶-فسفات به فروکتوز-۱،۶-بیسفسفات توسط آنزیم فسفوفروکتوکیناز-۱ (PFK-1)، که مرحله محدودکننده سرعت گلیکولیز است
فاز تولید ATP (فاز بازدهی انرژی)
در این فاز، هر مولکول گلیسرآلدهید-۳-فسفات طی چند مرحله به پیرووات تبدیل میشود و در این مسیر، چهار مولکول ATP و دو مولکول NADH تولید میشود.
از جمله آنزیمهای کلیدی این مرحله:
-
گلیسرآلدهید-۳-فسفات دهیدروژناز (تولید NADH )
-
پیرووات کیناز (تولید نهایی ATP و پیرووات)
تنظیم گلیکولیز: نقش هورمونها و آنزیمها
گلیکولیز بهشدت تحت کنترل آنزیمی قرار دارد. مهمترین نقاط تنظیمی آن شامل آنزیمهای زیر هستند:
-
هگزوکیناز/گلوکوکیناز : مهار توسط گلوکز-۶-فسفات
-
PFK-1 : فعالسازی توسط AMP و فروکتوز-2،6-بیسفسفات، مهار توسط ATP و سیترات
-
پیرووات کیناز : تنظیم توسط فسفوریلاسیون، فعالسازی توسط فروکتوز-1،6-بیس فسفات
همچنین، انسولین و گلوکاگون به عنوان دو هورمون متقابل، نقش کلیدی در تنظیم سطح فعالیت گلیکولیز در بافتهایی مانند کبد ایفا میکنند. انسولین باعث افزایش گلیکولیز و گلوکاگون باعث کاهش آن از طریق اثر بر آنزیمهای کلیدی میشود.
گلیکولیز و شرایط بیهوازی
در شرایط بیهوازی (مانند فعالیت عضلانی شدید یا کمبود اکسیژن)، پیرووات حاصل از گلیکولیز به لاکتات تبدیل میشود. این فرآیند باعث میشود گلیکولیز ادامه یابد چون NAD+ که در گلیکولیز مصرف شده بود، مجدداً احیا میشود. در مقابل، در شرایط هوازی، پیرووات وارد میتوکندری شده و در چرخه کربس و زنجیره انتقال الکترون به مصرف میرسد.
کاربردهای بالینی و اختلالات گلیکولیتیک
اختلال در آنزیمهای گلیکولیز میتواند منجر به بیماریهای متابولیکی نادر مانند کمخونی همولیتیک ارثی شود. همچنین، در سرطانها، سلولهای توموری تمایل دارند از گلیکولیز حتی در حضور اکسیژن استفاده کنند که به آن اثر واربورگ (Warburg Effect) میگویند. این ویژگی، امروزه بهعنوان یک نشانگر زیستی بالقوه برای تشخیص و و درمان سرطانها مورد بررسی قرار دارد.
گلوکونئوژنز: ساخت گلوکز از ترکیبات غیرقندی
مقدمهای بر گلوکونئوژنز
گلوکونئوژنز (Gluconeogenesis) یکی از مسیرهای حیاتی برای حفظ هموستاز گلوکز در بدن است، به ویژه در شرایط روزه داری، گرسنگی، ورزش شدید یا استرس متابولیک مانند سوختگیها یا عفونتهای شدید. در این مسیر، بدن میتواند از ترکیبات غیرقندی مانند اسیدهای آمینه، لاکتات و گلیسرول، گلوکز سنتز کند و آن را در اختیار بافتهایی قرار دهد که به شدت به گلوکز وابستهاند؛ از جمله مغز، گلبولهای قرمز و کلیهها.
گلوکونئوژنز در انسان عمدتاً در کبد (بیش از 90 (% و تا حدی در کلیهها انجام میشود و به تنظیم قند خون در شرایط بی غذایی کمک میکند.
پیشسازهای گلوکونئوژنز
مهمترین ترکیباتی که بهعنوان منبع تولید گلوکز استفاده میشوند عبارتند از:
-
لاکتات: حاصل از گلیکولیز بیهوازی در عضلات و گلبولهای قرمز
-
اسیدهای آمینه گلوکوژنیک: مانند آلانین، که در چرخه گلوکز–آلانین بین عضلات و کبد نقش دارد
-
گلیسرول : آزاد شده از تجزیه چربیهای ذخیرهای (تریگلیسریدها)
-
پروپیونات: عمدتاً در نشخوارکنندگان و برخی شرایط خاص در انسان
نکته مهم این است که اسیدهای چرب بهطور مستقیم نمیتوانند وارد گلوکونئوژنز شوند، زیرا تبدیل آنها به استیلکوآ منجر به تشکیل گلوکز نمیشود.
مراحل کلیدی گلوکونئوژنز
گلوکونئوژنز بسیاری از مراحل گلیکولیز را بهصورت معکوس دنبال میکند، اما در سه نقطه کلیدی که گلیکولیز غیرقابل برگشت است، مسیر جایگزین بهکار میرود:
-
تبدیل پیرووات به فسفوانول پیرووات (PEP)
این واکنش در دو مرحله صورت میگیرد:-
پیرووات → اگزالواستات (توسط پیرووات کربوکسیلاز)
-
اگزالواستات ) PEP → توسط PEP کربوکسیکیناز)
-
-
تبدیل فروکتوز-1،6-بیسفسفات به فروکتوز-6-فسفات
توسط آنزیم فروکتوز-1،6-بیسفسفاتاز -
تبدیل گلوکز-6-فسفات به گلوکز آزاد
توسط آنزیم گلوکز-6-فسفاتاز که فقط در کبد و کلیه وجود دارد و همین آنزیم است که گلوکز نهایی را به جریان خون آزاد میکند.
تنظیم گلوکونئوژنز : کنترل هورمونی و تغذیهای
گلوکونئوژنز تحت تأثیر شدید تنظیم هورمونی قرار دارد:
-
انسولین: مهارکننده قوی گلوکونئوژنز است. در شرایط پرخوری و پس از صرف وعده غذایی، ترشح انسولین افزایش مییابد و باعث سرکوب این مسیر میشود.
-
گلوکاگون و کورتیزول : فعالکنندههای اصلی گلوکونئوژنز هستند. آنها با افزایش بیان آنزیمهای کلیدی و تحریک لیپولیز (جهت تأمین ATP مورد نیاز گلوکونئوژنز) باعث افزایش تولید گلوکز میشوند.
-
آدرنالین : در شرایط استرس یا فعالیت بدنی شدید، گلوکونئوژنز را تحریک میکند.
این تنظیمات تضمین میکنند که بدن در شرایط مختلف، توازن بین تولید و مصرف گلوکز را حفظ کند.
ارتباط گلوکونئوژنز با دیگر مسیرهای متابولیک
گلوکونئوژنز یک مسیر انرژیبر است و برای سنتز هر مولکول گلوکز به 6 مولکول پرانرژی ATP)، GTP و (NADH نیاز دارد. این انرژی از اکسیداسیون اسیدهای چرب در کبد تأمین میشود، که نشان میدهد چگونه مسیرهای متابولیک مختلف با هم در ارتباط هستند.
همچنین، لاکتات تولید شده در گلیکولیز بیهوازی، از طریق چرخه کوری (Cori Cycle) به کبد بازمیگردد و در گلوکونئوژنز به گلوکز تبدیل میشود، که مجدداً در عضلات مصرف میگردد.
اختلالات بالینی مرتبط با گلوکونئوژنز
نقص در آنزیمهای گلوکونئوژنز میتواند منجر به هیپوگلیسمی شدید، اسیدوز لاکتیک و حتی مرگ نوزادان شود. همچنین، در دیابت نوع 2، افزایش بی رویه گلوکونئوژنز یکی از دلایل اصلی افزایش قند خون در حالت ناشتا است، که بهعنوان هدف درمانی برای داروهای ضد دیابت مانند متفورمین مطرح شده است.
گلیکوژنز و گلیکوژنولیز: چرخهی ذخیره و آزادسازی گلوکز
مقدمهای بر چرخهی گلیکوژن
گلیکوژن پلیساکاریدی شاخه دار و محلول در آب است که شکل ذخیرهای گلوکز در بدن انسان بهشمار میرود. این ترکیب در سلولهای کبدی و عضلانی به مقدار قابل توجهی ذخیره میشود و نقش مهمی در تنظیم قند خون و تأمین انرژی عضلانی دارد.
دو مسیر متابولیکی متضاد اما مکمل برای تنظیم گلیکوژن وجود دارد:
-
گلیکوژنز (Glycogenesis) : سنتز گلیکوژن از گلوکز
-
گلیکوژنولیز (Glycogenolysis) : تجزیه گلیکوژن به گلوکز یا مشتقات آن
این چرخه به بدن اجازه میدهد در شرایط تغذیهای یا فعالیتهای فیزیکی متغیر، تأمین گلوکز را بهصورت پویا و تنظیمشده انجام دهد.
گلیکوژنز: ذخیرهسازی گلوکز بهصورت گلیکوژن
گلیکوژنز عمدتاً پس از صرف وعده غذایی و افزایش سطح گلوکز خون، بهویژه در کبد و عضله اسکلتی فعال میشود. مراحل اصلی آن عبارتاند از:
-
فسفریلاسیون گلوکز توسط آنزیم هگزوکیناز (در عضله) یا گلوکوکیناز (در کبد) به گلوکز-6-فسفات
-
تبدیل گلوکز-6-فسفات به گلوکز-1-فسفات
-
فعالسازی گلوکز-1-فسفات توسط UTP و تشکیل UDP-گلوکز
-
انتقال واحدهای گلوکز به زنجیره گلیکوژن توسط آنزیم گلیکوژن سنتاز
-
ایجاد شاخهها در مولکول گلیکوژن توسط آنزیم شاخهساز (branching enzyme)
گلیکوژن حاصل، در کبد برای تنظیم گلوکز خون و در عضلات برای تأمین انرژی موضعی ذخیره میشود.
گلیکوژنولیز: بازیابی گلوکز از گلیکوژن
گلیکوژنولیز در شرایط ناشتا، فعالیت بدنی یا استرس فعال میشود تا گلوکز یا سوخت قابل استفاده را در اختیار بافتها قرار دهد. مراحل این فرایند شامل:
-
تجزیه پیوندهای α(1→4) گلیکوژن توسط آنزیم گلیکوژن فسفریلاز و تولید گلوکز-1-فسفات
-
تبدیل گلوکز-1-فسفات به گلوکز-6-فسفات
-
در کبد، گلوکز-6-فسفاتاز گلوکز-6-فسفات را به گلوکز آزاد تبدیل میکند و آن را به خون میفرستد
-
در عضله، گلوکز-6-فسفات وارد مسیر گلیکولیز میشود و انرژی تولید میکند
نکته مهم اینکه عضلات فاقد آنزیم گلوکز-6-فسفاتاز هستند، بنابراین نمیتوانند گلوکز آزاد به خون بدهند و تنها از گلیکوژن خود برای مصرف داخلی استفاده میکنند.
تنظیم هورمونی چرخه گلیکوژن
-
انسولین : پس از وعده غذایی ترشح شده و گلیکوژنز را تحریک و گلیکوژنولیز را مهار میکند.
-
گلوکاگون: در شرایط ناشتا ترشح میشود و با فعالسازی مسیرهای فسفریلاسیون، گلیکوژنولیز را فعال و گلیکوژنز را مهار میکند.
-
آدرنالین : بهویژه در عضلات در پاسخ به استرس یا ورزش شدید ترشح میشود و مسیر گلیکوژنولیز عضلانی را فعال میسازد.
این تنظیم هورمونی، پاسخ متابولیکی بدن را در شرایط گوناگون تضمین میکند.
اهمیت بالینی و بیماریهای مرتبط
اختلال در آنزیمهای چرخه گلیکوژن میتواند منجر به بیماریهای ذخیرهای گلیکوژن (Glycogen Storage Diseases) شود. این اختلالات ژنتیکی میتوانند باعث تجمع گلیکوژن غیرطبیعی در کبد یا عضلات شوند و به علائمی مانند هیپوگلیسمی، ضعف عضلانی، بزرگی کبد و اسیدوز لاکتیک منجر شوند.
از جمله این بیماریها میتوان به بیماری فونگیرکه نوع I ، بیماری مکآردل نوع V ، و بیماری کوری نوع III اشاره کرد.
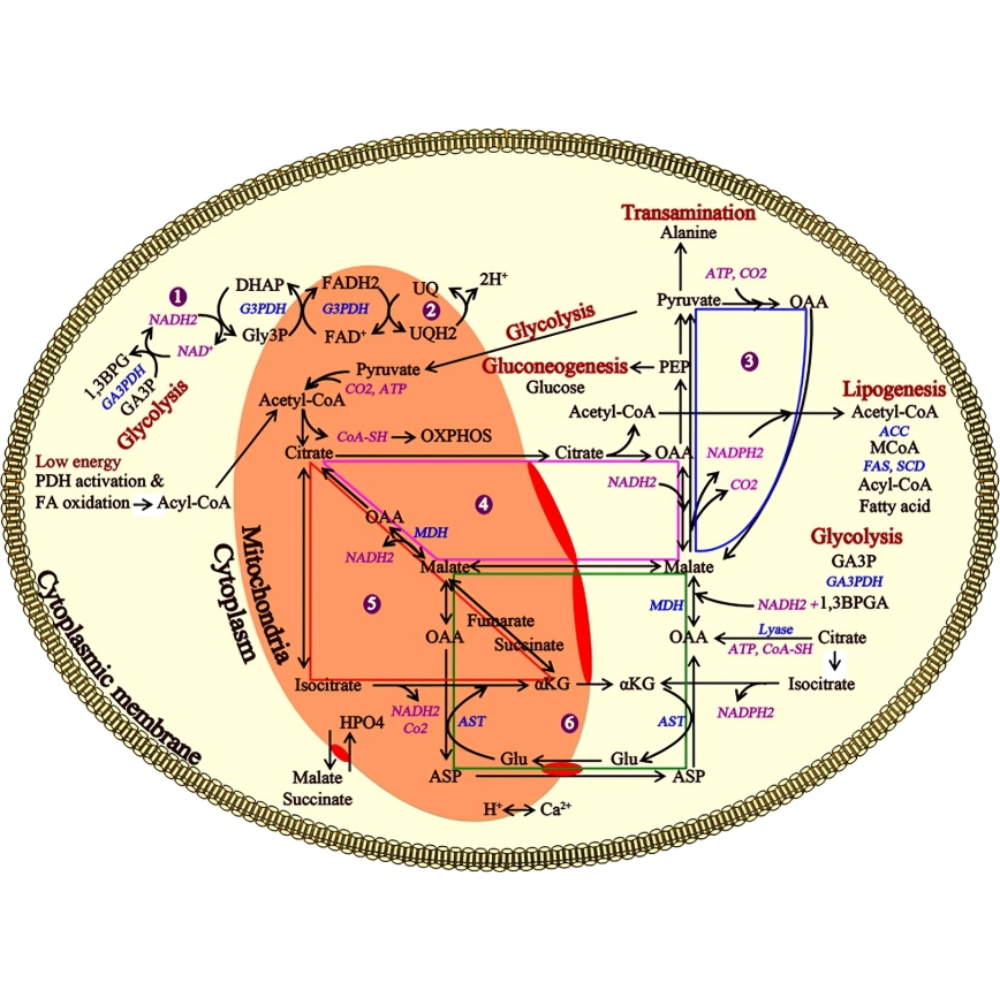
نقش کبد در متابولیسم کربوهیدراتها
کبد: مرکز تنظیم هموستاز گلوکز
کبد به عنوان یکی از اندامهای کلیدی در تنظیم متابولیسم کربوهیدراتها، نقش حیاتی در حفظ سطح قند خون در محدودهی فیزیولوژیک دارد. این اندام نهتنها گلوکز را ذخیره میکند، بلکه در شرایط گوناگون میتواند آن را از منابع مختلف سنتز یا آزاد نماید.
در شرایط ناشتا، کبد با تجزیهی گلیکوژن (گلیکوژنولیز) و سپس ساخت گلوکز از منابع غیرقندی (گلوکونئوژنز)، مانع افت قند خون میشود. در مقابل، پس از صرف وعدهی غذایی، با سنتز گلیکوژن (گلیکوژنز) و تبدیل گلوکز به ترکیبات غیرقندی مانند چربیها، به حفظ تعادل گلوکز کمک میکند.
فرایندهای متابولیکی اصلی کبد در رابطه با کربوهیدراتها
-
گلیکوژنز: کبد گلوکز اضافی را پس از وعدههای غذایی به شکل گلیکوژن ذخیره میکند. این فرایند توسط انسولین تحریک میشود.
-
گلیکوژنولیز: در زمان گرسنگی، کبد با تجزیه گلیکوژن به گلوکز، نیاز بدن به انرژی را تأمین میکند. این مسیر تحت کنترل گلوکاگون و آدرنالین فعال میشود.
-
گلوکونئوژنز: سنتز گلوکز از ترکیبات غیرقندی مانند لاکتات، گلیسرول، و اسیدهای آمینه گلوکوژنیک در کبد انجام میشود. این مسیر در شرایط روزهداری طولانی، منبع اصلی گلوکز برای مغز محسوب میشود.
-
گلیکولیز: کبد در شرایط تغذیهای، گلوکز را از طریق گلیکولیز به پیروات و نهایتاً چربیها تبدیل میکند.
-
تبدیل گلوکز به تریگلیسرید: گلوکز اضافی میتواند از طریق مسیر گلیکولیز و سپس لیپوژنز، به اسیدهای چرب و تریگلیسریدها تبدیل شود که در بافت چربی ذخیره میشوند.
تنظیم هورمونی عملکرد کبد
کبد با دریافت سیگنالهای هورمونی مختلف، متابولیسم گلوکز را تنظیم میکند:
-
انسولین : افزایش جذب گلوکز توسط کبد، تحریک سنتز گلیکوژن و مهار گلوکونئوژنز
-
گلوکاگون : فعالسازی گلوکونئوژنز و گلیکوژنولیز
-
آدرنالین و کورتیزول : افزایش گلوکز خون در پاسخ به استرس
ترکیب دقیق پاسخهای هورمونی کبد، امکان تنظیم پویا و سریع سطح گلوکز خون را فراهم میسازد.
کبد و هموستاز گلوکز در روزهداری و تغذیه
در فازهای مختلف متابولیکی بدن:
-
پس از وعده غذایی : کبد با تبدیل گلوکز به گلیکوژن یا چربی، افزایش قند خون را مهار میکند.
-
در فاصله بین وعدهها: کبد با آزادسازی گلوکز از گلیکوژن، سطح گلوکز خون را پایدار نگه میدارد.
-
در روزهداری طولانی: منابع گلیکوژن کبد تمام میشود و گلوکونئوژنز به منبع اصلی گلوکز تبدیل میشود.
اختلالات کبدی و اثر آن بر متابولیسم گلوکز
بیماریهای کبدی نظیر سیروز، هپاتیت، یا کبد چرب غیرالکلی میتوانند متابولیسم گلوکز را مختل کنند و منجر به:
-
هیپوگلیسمی ناشتا به دلیل کاهش توانایی گلوکونئوژنز
-
عدم تحمل گلوکز به دلیل کاهش پاسخ به انسولین
-
افزایش خطر ابتلا به دیابت نوع ۲ به دلیل مقاومت انسولینی ناشی از چربیکبدی
بنابراین سلامت کبد ارتباط تنگاتنگی با تنظیم متابولیسم کربوهیدراتها و پیشگیری از اختلالات متابولیکی دارد.
متابولیسم کربوهیدراتها در شرایط فیزیولوژیکی خاص
درک انعطافپذیری متابولیسم کربوهیدراتها
بدن انسان دارای سیستمهای تنظیمی دقیقی است که امکان انطباق متابولیسم کربوهیدراتها با شرایط فیزیولوژیکی مختلف را فراهم میسازد. این شرایط شامل روزهداری، ورزش، بارداری، استرس و بیماریها میشود. تغییر در میزان دسترسی به گلوکز، نیاز انرژی سلولها، و تنظیمات هورمونی، الگوهای مصرف و ذخیرهسازی کربوهیدراتها را به شدت تحت تأثیر قرار میدهد.
روزهداری و گرسنگی
در شرایط ناشتا یا گرسنگی، ذخایر گلیکوژن کبدی نخستین منبع گلوکز برای حفظ سطح قند خون محسوب میشوند. پس از حدود ۱۲–۱۸ ساعت روزهداری، منابع گلیکوژن کاهش مییابند و بدن برای تأمین گلوکز مورد نیاز مغز و گلبولهای قرمز به گلوکونئوژنز وابسته میشود.
در روزهداری طولانیتر، سوخت اصلی بدن از گلوکز به کتون بادیها تغییر مییابد، که عمدتاً از تجزیه اسیدهای چرب در کبد تولید میشوند. این سازوکار برای حفظ پروتئینهای بدن و کاهش تخریب عضلات طراحی شده است.
فعالیت ورزشی
در طول فعالیتهای فیزیکی، عضلات اسکلتی گلوکز را از طریق دو مسیر تأمین میکنند:
-
گلیکوژن درونعضلهای : منبع سریع انرژی در ورزشهای کوتاهمدت و شدید.
-
گلوکز خون : که توسط کبد از طریق گلیکوژنولیز و گلوکونئوژنز تأمین میشود.
ورزشهای طولانی یا استقامتی باعث افزایش حساسیت انسولینی، تسریع برداشت گلوکز توسط عضله، و تقویت بازسازی گلیکوژن پس از تمرین میشود.
بارداری و شیردهی
در دوران بارداری، تغییرات هورمونی منجر به مقاومت نسبی به انسولین در مادر میشود تا گلوکز بیشتری برای جنین فراهم شود. در صورت عدم جبران این مقاومت، ممکن است دیابت بارداری ایجاد شود.
در دوران شیردهی، نیاز انرژی بالا باعث تحریک لیپولیز و گلوکونئوژنز میشود تا هم برای مادر و هم برای تولید شیر، منابع انرژی تأمین شود.
استرس و پاسخ التهابی
در شرایط استرسزا مانند تروما، سوختگی، جراحی یا عفونتهای شدید، سطح هورمونهای کاتابولیک مانند کورتیزول، آدرنالین و گلوکاگون افزایش مییابد. این وضعیت باعث:
-
افزایش گلوکونئوژنز
-
مهار مصرف گلوکز در بافتها
-
افزایش قند خون (هیپرگلیسمی استرسی)
در چنین شرایطی، کنترل متابولیسم گلوکز میتواند یک چالش مهم در مدیریت بیمار محسوب شود.
دیابت و سایر اختلالات متابولیکی
در بیماری دیابت نوع ۱، نبود انسولین منجر به مهار جذب گلوکز توسط بافتها و افزایش گلوکونئوژنز کبدی میشود. در دیابت نوع ۲، مقاومت به انسولین منجر به عدم پاسخ مناسب سلولها به وجود گلوکز در خون میشود. در هر دو حالت، افزایش مزمن قند خون میتواند آسیبهای گستردهای به چشم، کلیه، اعصاب و قلب وارد کند.
نقش تغذیه و الگوهای رژیمی
رژیمهای غذایی کمکربوهیدرات یا کتوژنیک نیز متابولیسم گلوکز را تحت تأثیر قرار میدهند و بدن را به استفاده بیشتر از چربی و کتون بادیها سوق میدهند. در مقابل، رژیمهای با شاخص گلیسمی بالا میتوانند موجب افزایش سریع قند خون و تحریک ترشح انسولین شوند که در طولانیمدت ممکن است زمینهساز مقاومت انسولینی شود.
اختلالات متابولیسم کربوهیدراتها
بررسی کلی اختلالات متابولیک
متابولیسم کربوهیدراتها در حالت طبیعی توسط مجموعهای از آنزیمها و مسیرهای بیوشیمیایی منظم تنظیم میشود. با این حال، اختلال در عملکرد آنزیمها، گیرندهها یا مسیرهای هورمونی میتواند منجر به بروز بیماریهایی شود که به عنوان اختلالات متابولیسم کربوهیدراتها شناخته میشوند. این اختلالات میتوانند ژنتیکی، اکتسابی یا ناشی از آسیبهای سیستم ایمنی و التهابی باشند.
دیابت شیرین: شایعترین اختلال متابولیسم کربوهیدراتها
دیابت یک بیماری متابولیکی مزمن است که با افزایش غیرطبیعی قند خون مشخص میشود. دو نوع اصلی آن عبارتاند از:
-
دیابت نوع ۱ : نتیجه تخریب خودایمنی سلولهای بتای پانکراس است که باعث فقدان کامل یا شدید انسولین میشود.
-
دیابت نوع ۲ : ناشی از مقاومت انسولینی همراه با اختلال نسبی در ترشح انسولین.
دیابت در صورت کنترلنشدن میتواند به عوارض مزمنی مانند آسیب شبکیه (رتینوپاتی)، نارسایی کلیه (نفروپاتی)، نوروپاتی محیطی و بیماریهای قلبیعروقی منجر شود.
هیپوگلیسمی: کاهش شدید قند خون
هیپوگلیسمی حالتی است که در آن سطح قند خون بهطور غیرطبیعی پایین میآید (معمولاً کمتر از 70 میلیگرم بر دسیلیتر). این وضعیت ممکن است در اثر:
-
مصرف بیش از حد انسولین
-
روزهداری طولانی
-
بیماریهای کبدی یا غدد فوق کلیوی
-
نقص آنزیمهای گلوکونئوژنز یا گلیکوژنولیز
رخ دهد. علائم آن شامل تعریق، لرزش، گیجی، تاری دید و در موارد شدید، تشنج یا کما است.
گلیکوژنوزها (Glycogen Storage Diseases)
این گروه از بیماریها ناشی از نقص آنزیمهای مرتبط با گلیکوژنز یا گلیکوژنولیز هستند که منجر به تجمع یا اختلال در مصرف گلیکوژن در کبد و عضلات میشوند. برخی از مهمترین انواع گلیکوژنوزها عبارتاند از:
-
بیماری فون ژیرکه (نوع I ) : ناشی از نقص گلوکز-6-فسفاتاز، منجر به هیپوگلیسمی شدید و تجمع گلیکوژن در کبد.
-
بیماری پومپه (نوع( II : تجمع گلیکوژن در لیزوزومهای عضلات اسکلتی و قلبی.
-
بیماری مکآردل (نوع V) : نقص در آنزیم گلیکوژن فسفریلاز عضله، منجر به ضعف عضلانی و کرامپ هنگام ورزش.
عدم تحمل فروکتوز و گالاکتوزمی
در برخی افراد، اختلالات ژنتیکی باعث عدم توانایی در تجزیه یا متابولیزه کردن برخی قندها میشود:
-
عدم تحمل فروکتوز ارثی: ناشی از کمبود آنزیم آلدولاز B که منجر به تجمع فروکتوز-1-فسفات و آسیب کبدی میشود.
-
گالاکتوزمی کلاسیک: ناشی از نقص در آنزیم گالاکتوز-1-فسفات یوریدیل ترانسفراز، که باعث آسیب به کبد، کلیه و مغز در نوزادان میشود.
نقصهای مادرزادی در گلوکونئوژنز یا گلیکولیز
برخی نوزادان به طور ژنتیکی دچار نقص آنزیمی در مسیرهای گلوکونئوژنز یا گلیکولیز هستند که باعث بروز اختلالات متابولیکی شدید، اسیدوز لاکتیک، نارسایی رشد و ناهنجاریهای نورولوژیک میشود. این بیماریها بسیار نادر هستند و اغلب نیاز به تشخیص زودهنگام و مراقبتهای تخصصی دارند.
پیوند میان اختلالات متابولیسم کربوهیدراتها با بیماریهای مزمن
مطالعات نشان دادهاند که نوسانات مزمن قند خون، حتی در محدوده پیشدیابت، میتواند زمینهساز بیماریهایی نظیر:
-
چاقی و سندروم متابولیک
-
نارسایی قلبی و سکته
-
آلزایمر (که گاه به عنوان دیابت نوع ۳ شناخته میشود)
باشد. بنابراین، حفظ تعادل در متابولیسم کربوهیدراتها نه تنها برای تولید انرژی بلکه برای پیشگیری از بسیاری از بیماریهای مزمن نیز حیاتی است.
تنظیم هورمونی متابولیسم
اهمیت تنظیم هورمونی در حفظ تعادل گلوکز خون
متابولیسم گلوکز یک فرآیند پیچیده و دقیق است که توسط مجموعهای از هورمونها تنظیم میشود. حفظ هموستاز گلوکز در خون برای تأمین انرژی سلولها، بهویژه سلولهای مغزی و عضلانی، حیاتی است. این تعادل بهواسطهی تعامل دینامیک بین هورمونهای افزاینده و کاهندهی قند خون برقرار میشود.
انسولین: تنها هورمون کاهنده قند خون
انسولین که از سلولهای بتای پانکراس ترشح میشود، تنها هورمون شناختهشدهای است که سطح قند خون را کاهش میدهد. عملکردهای کلیدی انسولین عبارتاند از:
-
افزایش برداشت گلوکز توسط سلولهای ماهیچهای و چربی از طریق افزایش بیان ناقلهای گلوکز (GLUT4)
-
تحریک گلیکولیز و گلیکوژنز در کبد
-
مهار گلوکونئوژنز و گلیکوژنولیز
-
افزایش سنتز لیپید و پروتئین
عملکرد درست انسولین برای جلوگیری از هیپرگلیسمی و دیابت ضروری است.
گلوکاگون: هورمون افزایشدهنده قند خون
گلوکاگون که از سلولهای آلفای پانکراس ترشح میشود، دارای عملکردی متضاد با انسولین است. این هورمون در شرایط ناشتا یا هیپوگلیسمی فعال شده و باعث:
-
تحریک گلیکوژنولیز در کبد برای آزادسازی گلوکز
-
فعالسازی گلوکونئوژنز
-
مهار گلیکولیز در کبد
میشود. گلوکاگون از طریق گیرندههای G-پروتئینی به مسیر cAMP متصل شده و فعالیت آنزیمهای کلیدی را تحت تأثیر قرار میدهد.
هورمونهای استرس و نقش آنها در متابولیسم گلوکز
در شرایط استرسزا، ترشح هورمونهایی که باعث افزایش سطح گلوکز میشوند افزایش مییابد:
-
آدرنالین (اپینفرین): با تحریک گلیکوژنولیز در کبد و عضله، تأمین سریع انرژی را فراهم میسازد.
-
کورتیزول : با تحریک گلوکونئوژنز و کاهش حساسیت سلولها به انسولین، به حفظ قند خون در شرایط طولانیمدت استرس کمک میکند.
-
هورمون رشد (GH ) : با مهار برداشت گلوکز توسط سلولها و افزایش تجزیه چربی، ذخایر گلوکز را حفظ میکند.
اثر هورمون تیروئید بر متابولیسم گلوکز
هورمونهای تیروئیدی مانند T3 و T4 باعث افزایش نرخ متابولیسم پایه شده و در نتیجه:
-
مصرف گلوکز توسط سلولها را افزایش میدهند
-
گلیکولیز، گلوکونئوژنز و جذب گلوکز را در کبد تقویت میکنند
اختلال در عملکرد تیروئید میتواند منجر به تغییرات قابل توجهی در سطح قند خون شود.
سوماتوستاتین: تنظیمکننده تعادلی
سوماتوستاتین که توسط سلولهای دلتای پانکراس ترشح میشود، نقش مهارکننده ترشح انسولین و گلوکاگون را دارد و در تنظیم ظریف تعادل بین این دو هورمون اثرگذار است.
همکاری هورمونی در تنظیم دقیق گلوکز
در شرایط طبیعی، تعامل بین انسولین و گلوکاگون به شکلی کاملاً سینرژیک و پویــا عمل میکند تا سطح گلوکز در دامنه فیزیولوژیک (حدود 70 تا 110 mg/dL) باقی بماند. هرگونه اختلال در این محور میتواند منجر به شرایطی نظیر:
-
دیابت )کاهش انسولین یا مقاومت به آن)
-
هیپوگلیسمی )ترشح بیشازحد انسولین یا کاهش گلوکاگون)
-
سندرم کوشینگ یا فئوکروموسیتوما )ترشح بیشازحد هورمونهای ضدانسولینی(
شود که نیاز به تشخیص و درمان مناسب دارند.
منابع طبیعی و دارویی در تنظیم متابولیسم گلوکز
اهمیت استفاده از ترکیبات طبیعی و دارویی در کنترل قند خون
افزایش شیوع بیماریهایی مانند دیابت نوع ۲ باعث شده است که توجه گستردهای به ترکیبات دارویی و منابع طبیعی برای تنظیم متابولیسم گلوکز جلب شود. در کنار داروهای کلاسیک، بسیاری از ترکیبات گیاهی و مواد فعال زیستی به دلیل اثرگذاری بر مسیرهای گلیکولیز، گلوکونئوژنز و ترشح انسولین، بهعنوان مکملهای درمانی یا جایگزینهای دارویی در نظر گرفته میشوند.
ترکیبات دارویی موثر در متابولیسم گلوکز
-
متفورمین : متفورمین یکی از رایجترین داروهای خوراکی برای دیابت نوع ۲ است که با کاهش گلوکونئوژنز کبدی و افزایش حساسیت به انسولین عمل میکند. این دارو همچنین مصرف گلوکز توسط بافتهای محیطی را افزایش میدهد.
-
سولفونیلاورهها: این گروه از داروها با تحریک ترشح انسولین از سلولهای بتای پانکراس باعث کاهش قند خون میشوند. نمونههایی از آنها شامل گلیبنکلامید و گلیپیزید هستند.
-
مهارکنندههای SGLT2: این داروها مانند داپاگلیفلوزین با مهار بازجذب گلوکز در کلیهها باعث افزایش دفع گلوکز از طریق ادرار میشوند.
-
مهارکنندههای DPP-4 و آگونیستهای GLP-1 : این ترکیبات باعث افزایش اثر انسولین و مهار گلوکاگون میشوند، در نتیجه قند خون بعد از صرف غذا کاهش مییابد.
منابع گیاهی مؤثر در تنظیم قند خون
مطالعات گستردهای نشان دادهاند که گیاهان دارویی و عصارههای طبیعی میتوانند در تنظیم متابولیسم گلوکز نقش قابل توجهی داشته باشند:
-
دارچین (Cinnamomum spp.) : دارای ترکیباتی است که حساسیت به انسولین را افزایش میدهند و برداشت گلوکز توسط سلولها را بهبود میبخشند.
-
شنبلیله (Trigonella foenum-graecum) : سرشار از فیبر محلول و ساپونینهاست که باعث کاهش جذب گلوکز از روده و افزایش ترشح انسولین میشوند.
-
مورینگا (Moringa oleifera) : دارای اثرات ضداکسیدانی و کاهشدهنده قند خون ناشی از گلوکونئوژنز است.
-
آلوئهورا: با افزایش سنتز گلوکوکیناز و بهبود حساسیت به انسولین در کبد، به تنظیم گلوکز خون کمک میکند.
-
بیتر ملون (Momordica charantia) : دارای ترکیباتی مشابه انسولین است که میتوانند قند خون را کاهش دهند.
مکانیسمهای بیوشیمیایی ترکیبات طبیعی در تنظیم قند خون
ترکیبات گیاهی و طبیعی اغلب از طریق مسیرهای زیر تأثیر خود را اعمال میکنند:
-
افزایش ترشح انسولین یا اثرگذاری بر گیرندههای آن
-
کاهش جذب گلوکز در دستگاه گوارش
-
مهار آنزیمهای دخیل در گلوکونئوژنز و گلیکوژنولیز
-
کاهش استرس اکسیداتیو و التهاب در بافتهای هدف
-
فعالسازی مسیر AMP-activated protein kinase (AMPK) بهعنوان حسگر انرژی سلول
چالشها و چشماندازها
با وجود اثرات امیدوارکننده، برخی چالشها در استفاده از ترکیبات طبیعی وجود دارد:
-
ناهمگونی در ترکیب عصارهها
-
نبود دوز مشخص و استاندارد
-
امکان تداخل با داروهای رایج دیابت
با این حال، مطالعات پیشبالینی و بالینی در حال گسترش هستند تا فرمولاسیونهای ایمن و مؤثری از ترکیبات طبیعی طراحی شود که بهعنوان درمانهای مکمل یا جایگزین در بیماران مبتلا به دیابت یا اختلالات متابولیسم گلوکز استفاده شوند.
آینده پژوهی و مسیرهای نوین درمانی
ضرورت نوآوری در درمان اختلالات متابولیسم کربوهیدراتها
با توجه به رشد فزایندهی بیماریهایی مانند دیابت نوع ۲، چاقی متابولیک و سندرم متابولیک، نیاز به رویکردهای نوین در مدیریت متابولیسم کربوهیدراتها امری اجتناب ناپذیر است. درمانهای فعلی اگرچه مؤثرند، اما در بسیاری از بیماران کنترل بلند مدت و پایداری ایجاد نمیکنند. از این رو، تحقیقات آیندهنگر و درمانهای هدفمند نقش کلیدی در بهبود پیامدهای بالینی خواهند داشت.
پزشکی شخصی و ژندرمانی در کنترل متابولیسم گلوکز
پیشرفت در حوزهی ژنومیک و اپیژنتیک موجب شده است که پزشکان بتوانند درمانها را بر اساس ویژگیهای ژنتیکی بیمار تنظیم کنند. در این راستا، مفاهیم پزشکی شخصی و پزشکی دقیق مطرح شدهاند که شامل موارد زیر هستند:
-
شناسایی پلیمورفیسمهای ژنتیکی مؤثر بر عملکرد انسولین و آنزیمهای متابولیسم گلوکز
-
استفاده از RNAهای مداخلهگر( siRNA و miRNA) برای مهار ژنهای دخیل در گلوکونئوژنز
-
مهندسی ژنتیک سلولهای بتای پانکراس برای افزایش ترشح انسولین یا محافظت در برابر مرگ سلولی
تکنولوژیهای نوین مانند نانوپزشکی و نانوحاملها
در حوزه دارورسانی، فناوری نانو توانسته تحول بزرگی در مسیر درمانی ایجاد کند. نانوذرات بهعنوان حاملهایی هوشمند برای انتقال هدفمند داروها یا ترکیبات طبیعی تنظیمکننده قند خون استفاده میشوند. برخی کاربردهای نانوپزشکی عبارتند از:
-
کپسولهسازی انسولین یا ترکیبات طبیعی مانند کورکومین در نانوذرات برای افزایش پایداری زیستی و فراهمی زیستی آنها.
-
سیستمهای رهایش هوشمند مبتنی بر سطح گلوکز که دارو را تنها در حضور قند بالا آزاد میکنند.
-
نانوپپتیدها با عملکرد شبهانسولینی که میتوانند گیرندههای انسولین را فعال کنند.
بیوانفورماتیک و مدلسازی مسیرهای متابولیک
ابزارهای مدلسازی محاسباتی و بیوانفورماتیک امکان شبیهسازی دقیق مسیرهای پیچیده مانند گلیکولیز، گلوکونئوژنز و گلیکوژنز را فراهم کردهاند. این مدلها میتوانند برای موارد زیر بهکار روند:
-
پیشبینی پاسخ بدن به داروهای مختلف در شرایط فیزیولوژیکی خاص
-
بهینهسازی طراحی داروهای جدید با بیشترین اثر بر مسیرهای کلیدی متابولیکی
-
تحلیل شبکههای متابولیکی بهعنوان سیستمهای پیچیده برای شناسایی نقاط کلیدی مداخلهگر
درمانهای مبتنی بر سلول و بافتهای مهندسیشده
از دیگر مسیرهای نوین درمانی، استفاده از سلولهای بنیادی برای بازسازی عملکرد پانکراس و تولید انسولین در بیماران دیابتی است. همچنین پژوهشهایی در حال انجام است که با مهندسی بافتی، پانکراس مصنوعی یا سلولهای انسولینساز جایگزین طراحی میکنند.
افق آینده: درمان ترکیبی و چندهدفه
آینده درمانهای متابولیکی در استفاده از رویکردهای چندوجهی و ترکیبی نهفته است. درمانهایی که بهصورت همزمان:
-
گلوکونئوژنز را مهار میکنند
-
سنتز گلیکوژن را تحریک میکنند
-
فعالیت انسولین را تقویت مینمایند
-
اثر آنتیاکسیدانی و ضد التهابی دارند
میتوانند به کنترل جامعتری بر متابولیسم کربوهیدراتها منجر شوند و کیفیت زندگی بیماران را به طرز قابل توجهی بهبود بخشند.
جمعبندی و پاسخ به پرسشهای پرتکرار متخصصان
خلاصهای از اهمیت متابولیسم کربوهیدراتها
متابولیسم کربوهیدراتها نقشی بنیادی و حیاتی در تأمین انرژی بدن و حفظ هموستاز گلوکز دارد. مسیرهای اصلی مانند گلیکولیز، گلوکونئوژنز، گلیکوژنز و گلیکوژنولیز به صورت متعادل و تحت تنظیم هورمونی دقیق، انرژی لازم را در شرایط مختلف فیزیولوژیکی فراهم میکنند. اختلال در این فرآیندها میتواند منجر به بیماریهای متابولیکی جدی مانند دیابت شود.
پرسشهای متداول و پاسخهای علمی
پرسش: چرا کبد نقش کلیدی در متابولیسم کربوهیدراتها دارد؟
پاسخ: کبد به عنوان مرکز تنظیمکننده گلوکز خون، با ذخیرهسازی گلیکوژن، تولید گلوکز از ترکیبات غیرقندی و تنظیم هورمونی نقش حیاتی ایفا میکند. این اندام به کمک آنزیمهای تخصصی و مسیرهای متابولیکی، میزان گلوکز را به دقت کنترل میکند تا سلولها در شرایط مختلف انرژی کافی داشته باشند.
پرسش: تفاوت اصلی بین گلیکولیز و گلوکونئوژنز چیست؟
پاسخ: گلیکولیز مسیر تجزیه گلوکز به پیرووات و تولید انرژی است، در حالی که گلوکونئوژنز فرآیندی معکوس است که در آن گلوکز از پیشمادههای غیرکربوهیدراتی ساخته میشود. این دو مسیر به طور دقیق تنظیم شدهاند تا از مصرف همزمان و بینتیجه انرژی جلوگیری شود.
پرسش: چگونه هورمونها متابولیسم کربوهیدراتها را تنظیم میکنند؟
پاسخ: هورمونهایی مانند انسولین و گلوکاگون به طور متقابل عملکرد مسیرهای متابولیک را تنظیم میکنند. انسولین باعث کاهش قند خون با تحریک جذب گلوکز و سنتز گلیکوژن میشود، در حالی که گلوکاگون در شرایط کمبود انرژی، گلوکز را آزاد کرده و تولید آن را افزایش میدهد.
پرسش: نقش منابع طبیعی در درمان اختلالات متابولیسم گلوکز چیست؟
پاسخ: بسیاری از ترکیبات طبیعی مانند کورکومین، جینسینگ، و فلاونوئیدها دارای خواص تنظیمکننده قند خون هستند که میتوانند به عنوان مکملهای درمانی به کار روند. این منابع معمولاً کمعوارض بوده و میتوانند اثر داروهای شیمیایی را تقویت یا جایگزین کنند.
نگاهی به آینده و اهمیت تحقیقات مستمر
پیشرفتهای علمی در حوزههای ژندرمانی، نانوپزشکی، و پزشکی شخصی نویدبخش درمانهای موثرتر و کمعارضهتر برای بیماران مبتلا به اختلالات متابولیسم کربوهیدراتها هستند. مطالعات میانرشتهای و همکاریهای بینالمللی برای شناسایی مسیرهای جدید و بهینهسازی روشهای درمانی، کلید موفقیت در این زمینه است