پپتید و پروتئین: تفاوت، توابع و ساختار
تعریف و تفاوت پپتیدها و پروتئینها
پپتید چیست؟
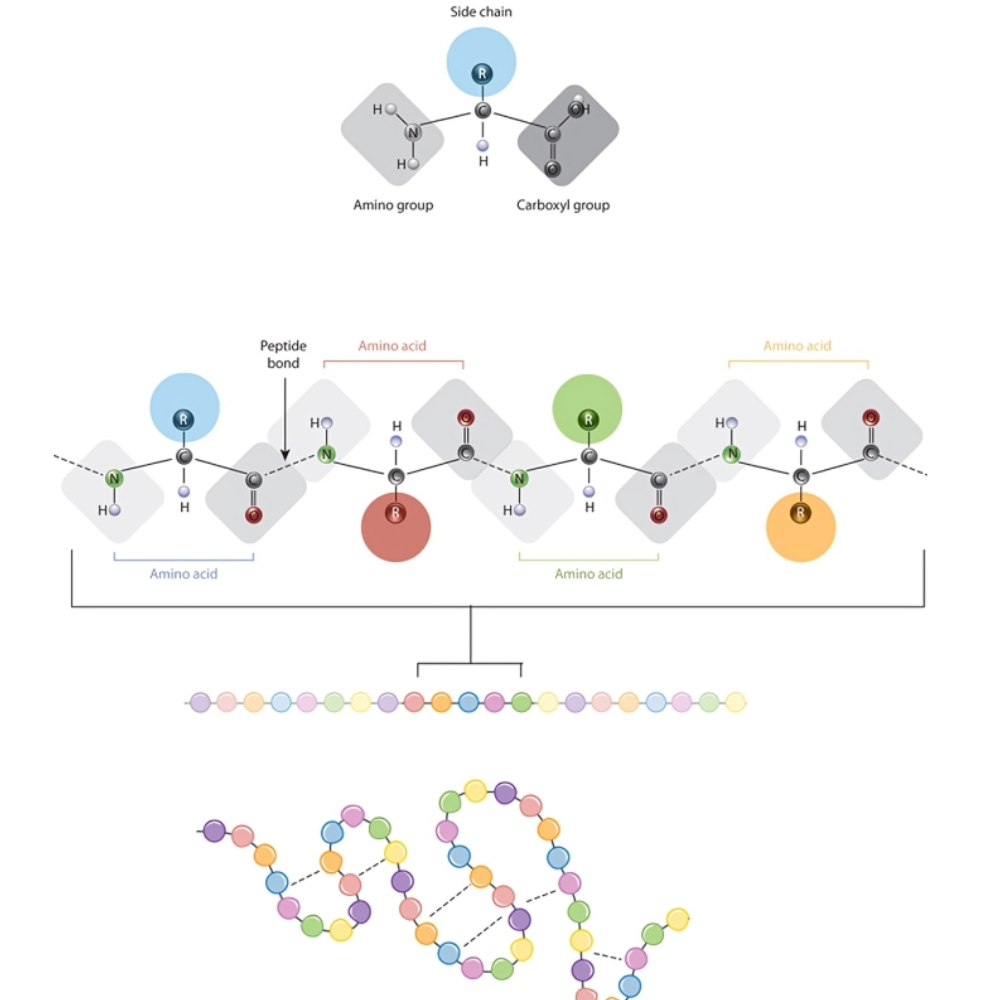
پپتیدها مولکولهای زیستی کوچکی هستند که از اتصال زنجیرهای تعداد محدودی اسیدآمینه به یکدیگر از طریق پیوند پپتیدی تشکیل شدهاند. این پیوند میان گروه آمین (-NH₂) یک اسیدآمینه و گروه کربوکسیلیک (-COOH) اسیدآمینه دیگر برقرار میشود. زمانی که دو اسیدآمینه به هم متصل شوند، دیپپتید ایجاد میشود و با افزودن اسیدآمینههای بیشتر، الیگوپپتید (۳ تا ۱۰ اسیدآمینه) و سپس پلیپپتید (بیش از ۱۰ اسیدآمینه) شکل میگیرند.
پپتیدها معمولاً وزن مولکولی پایینی دارند (کمتر از ۱۰ کیلو دالتون) و اغلب به عنوان مولکولهای سیگنالدهنده در بدن انسان عمل میکنند؛ بهعنوان مثال، هورمون انسولین در قالب پپتیدی تولید و ترشح میشود.
پروتئین چیست؟
پروتئینها ماکرومولکولهایی بزرگتر از پپتیدها هستند که از صدها تا هزاران اسیدآمینه تشکیل شدهاند و بهوسیله ساختارهای پیچیده فضایی (مانند تاخوردگی ثانویه، ثالثیه و گاهاً چهارم) به شکلهای ویژهای سازمان مییابند. ساختارهای پیچیدهتر به پروتئینها اجازه میدهد تا طیف گستردهای از عملکردهای زیستی را ایفا کنند؛ از جمله آنزیمها، آنتیبادیها، گیرندهها، پروتئینهای ساختاری (مانند کراتین و کلاژن) و حاملها (مانند هموگلوبین).
تفاوتهای کلیدی بین پپتید و پروتئین
|
پپتید |
پروتئین |
ویژگی |
|
کوچک (کمتر از ۵۰ اسیدآمینه) |
بزرگ (بیش از ۵۰ اسیدآمینه) |
اندازه |
|
اغلب ساده و خطی |
ساختار پیچیده (ثانویه، ثالثیه و چهارم) |
ساختار فضایی |
|
سیگنالدهی، هورمون، ضد میکروبی |
آنزیمی، ساختاری، ایمنی، حملونقل |
عملکرد |
|
معمولاً کمتر از پروتئینها |
اغلب پایدارتر در شرایط فیزیولوژیکی |
پایداری زیستی |
|
سنتز شیمیایی آسانتر |
غالباً نیاز به بیان ژنی و تخلیص پیچیدهتر |
روش تولید |
همپوشانیهای عملکردی
برخی پپتیدها، با وجود اندازه کوچک، فعالیتهایی دارند که به طور سنتی به پروتئینها نسبت داده میشد، از جمله فعالیت آنزیمی یا ساختارهای شبهپروتئینی. همچنین، بسیاری از پروتئینها از پیشپروتئینها یا پروپپتیدها مشتق میشوند که در طی فرایندهای پس ترجمهای فعال میشوند. این همپوشانی عملکردی، مرز دقیق میان پپتیدها و پروتئینها را در برخی موارد مبهم میسازد.
اهمیت تشخیص صحیح
در حوزههای مختلف مانند داروسازی، بیوتکنولوژی، طراحی نانوحاملها، و درمانهای هدفمند، درک تفاوتهای ساختاری و عملکردی میان پپتیدها و پروتئینها، نقش کلیدی در انتخاب روش تولید، پایداری، مسیر انتقال و دوز مصرفی دارو ایفا میکند.
ساختار مولکولی پپتیدها و پروتئینها
ساختار مولکولی، اساس عملکرد هر پپتید یا پروتئین را شکل میدهد. از ابتداییترین پیوندهای میان اسیدآمینهها تا پیچیدهترین آرایشهای فضایی، درک این ساختارها برای تحلیل دقیق عملکرد زیستی، طراحی داروها و حتی توسعه نانوزیستفناوریها ضروری است.
ساختار اولیه (Primary Structure)
ساختار اولیه به توالی خطی اسیدآمینهها در زنجیره پپتیدی یا پروتئینی اطلاق میشود. هر اسیدآمینه در این توالی با پیوند پپتیدی به دیگری متصل میشود و این توالی دقیقاً توسط کد ژنتیکی مشخص میشود.
ویژگی مهم: یک تغییر جزئی در ترتیب اسیدآمینهها (مانند موتاسیون نقطهای) میتواند به تغییرات شدید عملکردی یا حتی بیماری منجر شود (مانند آنمی داسیشکل ناشی از جهش در هموگلوبین)
ساختار ثانویه (Secondary Structure)
در این سطح، زنجیره پلیپپتیدی شروع به تا خوردن میکند و الگوهای پایدار مانند آلفا-هلیکس (α -helix) و بتا-برگ (β-sheet) تشکیل میدهد. این ساختارها از طریق پیوندهای هیدروژنی میان گروههای کربونیل و آمینی زنجیره اصلی پایداری مییابند.
مثال: کراتین در موها و ناخنها بهطور عمده دارای ساختار آلفا-هلیکس است که باعث کشسانی آنها میشود.
ساختار سوم (Tertiary Structure)
ساختار سوم، به آرایش سهبعدی کل زنجیره پپتیدی اشاره دارد و از برهمکنشهای جانبی میان زنجیرههای جانبی اسیدآمینهها (R-groups) شکل میگیرد. این برهمکنشها میتواند شامل:
پیوندهای دیسولفیدی (بین سیستئینه(
پیوندهای هیدروژنی
برهمکنشهای هیدروفوبیک
پیوندهای یونی
باشد.
اهمیت: عملکرد زیستی پروتئینها، مثل خاصیت آنزیمی یا اتصال به گیرندهها، به شدت به ساختار سوم وابسته است.
ساختار چهارم (Quaternary Structure)
پروتئینهایی که از چند زنجیره پلیپپتیدی تشکیل شدهاند، دارای ساختار چهارم هستند. این زنجیرهها که زیرواحد (subunit) نامیده میشوند، با یکدیگر تعامل دارند و کل پروتئین را تشکیل میدهند.
نمونه بارز: هموگلوبین دارای چهار زیرواحد است (دو آلفا و دو بتا) که همکاری آنها برای حمل اکسیژن ضروری است.
دینامیک ساختار و انعطافپذیری
مطالعات اخیر (مانند مقاله “Dynamic Personalities of Proteins” - Nature 2007) نشان دادهاند که پروتئینها موجوداتی دینامیک هستند، نه ساختارهای ساکن. ساختار آنها بسته به شرایط محیطی، برهمکنشها و سیگنالهای سلولی میتواند دچار تغییر موقت (conformational change) شود.
این تغییرات برای بسیاری از عملکردها مانند باز و بسته شدن کانالهای یونی، فعال شدن گیرندهها، و حتی شروع تاخوردگی یا تخریب ضروری است.
تاخوردگی (Folding) و اهمیت آن
پروتئینها باید بهدرستی تا بخورند تا فعال شوند. فرآیند Protein Folding در سلول تحت هدایت مولکولهای شاپرونی (Molecular Chaperones) انجام میگیرد. هرگونه خطا در این فرآیند میتواند منجر به پروتئینهای ناقص یا تجمعیافته (Aggregates) شود که در بیماریهایی نظیر آلزایمر و پارکینسون نقش دارند.
تفاوت در ساختارهای پپتیدی و پروتئینی
پپتیدها معمولاً ساختارهای ثانویه یا سوم بسیار سادهتری دارند یا اصلاً ندارند. در نتیجه، فعالیت آنها محدود به سیگنالدهی، اتصال به گیرندهها، یا نقش در تنظیم موقتی برخی مسیرهای سلولی است. در مقابل، پروتئینها با ساختار پیچیدهتر، ظرفیت انجام واکنشهای شیمیایی پیچیده یا ایفای نقشهای ساختاری پایدار را دارند.
ساختار شیمیایی پپتیدها و پروتئینها
پپتیدها و پروتئینها، علیرغم تفاوت در اندازه و پیچیدگی، دارای پایههای شیمیایی مشابهی هستند. شناخت دقیق ساختار شیمیایی آنها برای درک عملکرد زیستی، طراحی دارو، اصلاح ساختاری و مهندسی مولکولی ضروری است. این بخش از مقاله با تمرکز بر عناصر شیمیایی سازنده، نوع پیوندها، ویژگیهای عملکردی و خواص فیزیکوشیمیایی پپتیدها و پروتئینها نوشته شده است.
اجزای سازنده: اسیدهای آمینه (Amino Acids)
اسیدهای آمینه، واحدهای سازنده اصلی پپتیدها و پروتئینها هستند. هر اسید آمینه از چهار بخش اصلی تشکیل شده است:
گروه آمینی (-NH₂)
گروه کربوکسیلیک (-COOH)
اتم کربن مرکزی (Cα)
زنجیره جانبی (R-group) که ویژگی و رفتار اسید آمینه را تعیین میکند.
در حالت فیزیولوژیک (pH=7.4)، اسید آمینهها به فرم زویتریون (Zwitterion) درمیآیند: گروه آمینی به شکل -NH₃⁺ و گروه کربوکسیل به شکل -COO⁻.
پیوند پپتیدی و ساختار زنجیرهای
پپتیدها و پروتئینها از طریق پیوند پپتیدی میان گروه کربوکسیل یک اسید آمینه و گروه آمینی اسید آمینه بعدی تشکیل میشوند. این پیوند نوعی پیوند کووالانسی است که در واکنش چگالش (condensation reaction) تشکیل شده و یک مولکول آب آزاد میشود.
ساختار کلی پپتیدها:
N-terminal — [Amino Acid]₁–[Amino Acid]₂–...–[Amino Acid]n — C-terminal
خواص شیمیایی زنجیره جانبی اسیدهای آمینه
زنجیره جانبی یا گروه R هر اسید آمینه رفتار شیمیایی آن را مشخص میکند:
آبدوست (Polar) : مانند سرین، ترئونین
آبگریز (Non-polar) : مانند آلانین، لوسین
بازی : مانند لیزین، آرژنین
اسیدی : مانند آسپارتیک اسید، گلوتامیک اسید
دارای حلقه آروماتیک: مانند فنیلآلانین، تیروزین، تریپتوفان
این گروههای جانبی باعث بروز برهمکنشهایی چون پیوندهای یونی، هیدروژنی، واندروالسی و هیدروفوبیک در ساختار پروتئین میشوند.
گروههای عمکردی ویژه و اصلاحات پس از ترجمه (Post-translational Modifications)
بسیاری از پروتئینها پس از ساختهشدن، توسط آنزیمها دستخوش تغییراتی میشوند که کارایی و عملکرد آنها را بهبود میدهد. این تغییرات شامل:
فسفوریلاسیون: افزودن گروه فسفات به سرین، ترئونین یا تیروزین
گلیکوزیلاسیون: اتصال قندها به زنجیره جانبی آسپاراژین یا سرین
آسیلدار شدن (Acylation): برای اهداف سیگنالی یا اتصال غشایی
پیوند دیسولفیدی: بین دو سیستئین برای پایداری ساختار سوم
طبق مقاله "Mechanisms of Specificity in Protein Phosphorylation" (Nature Reviews Molecular Cell Biology, 2007)، این اصلاحات نقش کلیدی در کنترل مسیرهای سیگنالدهی سلولی دارند.
ویژگیهای اسیدی- بازی و ایزوالکتریک (pI)
پپتیدها و پروتئینها بهدلیل وجود گروههای قابل یونیزه، دارای خواص اسیدی-بازی هستند. نقطه ایزوالکتریک Isoelectric Point مقداری از pH است که در آن مولکول بار خالص ندارد.
این ویژگی در تکنیکهایی مانند الکتروفورز ایزوالکتریک (IEF) و کروماتوگرافی تبادل یونی (Ion Exchange Chromatography) اهمیت حیاتی دارد.
پایداری شیمیایی و مقاومت به تخریب
پپتیدها و پروتئینها بهطور طبیعی نسبت به:
آنزیمهای پروتئولیتیک (مانند پپسین و تریپسین)
تغییرات pH
دمای بالا
اکسیداسیون یا دِآمیداسیون
آسیب پذیر هستند. در داروسازی و بیوتکنولوژی، برای افزایش پایداری آنها از روشهایی مانند PEGylation، انسداد آنزیمی، و اصلاح ساختاری استفاده میشود.
طبق مقاله “Protein Drug Stability: A Formulation Challenge” (Nature Reviews Drug Discovery), افزایش پایداری دارویی پپتیدها از طریق مهندسی ساختار و اصلاحات شیمیایی، موضوعی کلیدی در طراحی داروهای مدرن است.
خواص نوری و واکنشپذیری
برخی اسیدهای آمینه آروماتیک مانند تریپتوفان، تیروزین و فنیلآلانین دارای جذب نوری مشخصی در طولموج ۲۸۰ نانومتر هستند و برای اندازهگیری غلظت پروتئینها در روشهایی مانند اسپکتروفتومتری استفاده میشوند.
نحوهی سنتز پپتیدها و پروتئینها
سنتز پپتیدها و پروتئینها یکی از مهمترین فرآیندهای زیستی در سلولهای زنده است که به واسطه آن، اطلاعات ژنتیکی موجود در DNA به ساختارهای عملکردی تبدیل میشود. این فرآیند در دو سطح اصلی انجام میگیرد: سنتز زیستی داخل سلولی و سنتز شیمیایی آزمایشگاهی.
سنتز زیستی: ترجمه (Translation) در سلول
سنتز پروتئینها در سلولهای یوکاریوتی و پروکاریوتی از طریق فرآیندی به نام ترجمه (Translation) انجام میشود که در ریبوزومها صورت میگیرد.
مراحل اصلی ترجمه :
آمادهسازی mRNA : پس از رونویسی از DNA، mRNA پیامرسان حامل کدهای آمینواسیدی است.
شروع ترجمه (Initiation) :
شناخته شدن کد شروع (AUG) روی mRNA توسط ریبوزوم
اتصال tRNA مخصوص متیونین به کد شروع
بلند شدن زنجیره پپتیدی (Elongation):
tRNAهای حامل اسیدهای آمینه مختلف، کدهای mRNA را میخوانند
پیوند پپتیدی بین آمینواسیدهای متوالی ایجاد میشود
ریبوزوم در طول mRNA حرکت میکند و زنجیره در حال رشد میشود
پایان ترجمه (Termination) :
رسیدن به کد پایان (Stop codon)
آزادسازی زنجیره پپتیدی کامل شده
این روند شامل استفاده از آنزیمها و فاکتورهای کمکی متعدد است که به دقت فرآیند را تنظیم میکنند.
سنتز شیمیایی پپتیده ها (Chemical Peptide Synthesis)
سنتز پپتیدها در آزمایشگاه از اهمیت بالایی برخوردار است و معمولاً به دو روش اصلی انجام میشود:
سنتز در فاز جامد (Solid Phase Peptide Synthesis - SPPS) :
روش رایج و متداول برای ساخت پپتیدهای کوتاه و متوسط
اسید آمینهها به ترتیب روی یک رزین متصل به فاز جامد قرار میگیرند و پیوند پپتیدی ایجاد میشود
استفاده از محافظها (Protecting Groups) برای جلوگیری از واکنشهای ناخواسته
پس از پایان سنتز، پپتید از رزین جدا میشود و خالصسازی انجام میشود
سنتز در فاز محلول (Solution Phase Synthesis):
برای پپتیدهای بسیار کوتاه یا برای ایجاد تغییرات شیمیایی خاص
کنترل دقیقتر بر واکنشها ولی زمانبر و پیچیدهتر
سنتز شیمیایی پروتئینها : لیگیشن شیمیایی و فناوریهای نوین
سنتز کامل پروتئینهای بزرگ در آزمایشگاه به دلیل پیچیدگی و طول زنجیره مشکل است. تکنولوژیهای نوین مانند:
لیگیشن شیمیایی (Chemical Ligation) :
روشهایی مانند Native Chemical Ligation (NCL) که بخشهای کوتاهتر پپتید را به هم متصل میکنند تا پروتئینهای بزرگ ساخته شوند.
امکان وارد کردن اصلاحات خاص و دارویی در ساختار پروتئین
بیوراکتورهای مصنوعی و سنتز مبتنی بر سلول:
استفاده از سیستمهای سلولی اصلاح شده برای تولید پروتئینهای پیچیده با اصلاحات پس از ترجمه
فناوری DNA بازترکیبی
کنترل کیفیت و تصحیح خطا در سنتز زیستی
پروتئینها باید به درستی تاخورده و با ساختار سهبعدی مناسب شکل بگیرند تا عملکرد مطلوب داشته باشند. سیستمهای کنترل کیفیت سلولی شامل:
مولکولهای کمک کننده (Chaperones):
پروتئینهایی که به تاخوردن صحیح پروتئینها کمک میکنند.
جلوگیری از تجمع و تشکیل پروتئینهای معیوب
پروتئینهای پیشرفت دهنده تاخوردگی (Folding Enzymes) :
مانند پروتئین دیسولفید ایزومراز که پیوندهای دیسولفیدی را اصلاح میکند.
سیستم تخریب پروتئینهای معیوب (Proteasome) :
حذف پروتئینهای آسیب دیده یا نادرست تاخورده
اهمیت سنتز دقیق در کاربردهای دارویی و بیوتکنولوژی
سنتز دقیق پپتیدها و پروتئینها، به ویژه در ساخت داروهای بیولوژیک و واکسنها، اهمیت فراوان دارد. هر گونه خطا در توالی آمینواسیدی یا ساختار سهبعدی میتواند موجب کاهش اثربخشی یا ایجاد عوارض جانبی شود.
طبق مقاله "Synthesis of Native Proteins by Chemical Ligation" (Annual Review of Biochemistry, 2000)، پیشرفتهای شیمیایی و بیوتکنولوژیکی، امکانات جدیدی را برای تولید پروتئینهای پیچیده با خلوص و عملکرد بالا فراهم کردهاند.
توابع بیولوژیکی پپتیدها
پپتیدها، به عنوان مولکولهای زیستی کوچک اما بسیار تأثیرگذار، نقشهای متعددی در تنظیم فرآیندهای بیولوژیکی ایفا میکنند. این توابع به دلیل اندازه مناسب، قابلیت تعامل با گیرندهها و اثرات متنوع، اهمیت فراوانی در زیستشناسی و پزشکی دارند.
پپتیدهای سیگنالدهنده و تنظیمکننده
پپتیدها به عنوان مولکولهای پیامرسان (Signal Peptides) نقش کلیدی در انتقال پیامهای زیستی دارند. این پپتیدها میتوانند به صورت هورمون یا نوروترنسمیتر عمل کنند و فعالیتهای سلولی مختلفی را تنظیم کنند.
هورمونهای پپتیدی: مانند انسولین که کنترل سطح قند خون را بر عهده دارد.
نوروپپتیدها: مانند انکفالینها که در سیستم عصبی نقش تسکیندهنده درد را دارند.
پپتیدهای آنتیمیکروبیال (Antimicrobial Peptides - AMPs)
این گروه از پپتیدها به عنوان یکی از اولین خطوط دفاعی بدن در برابر میکروبها عمل میکنند. AMPs قابلیت از بین بردن باکتریها، ویروسها، قارچها و حتی برخی انگلها را دارند.
AMPs معمولاً با نفوذ به غشای سلولی میکروارگانیسمها موجب مرگ آنها میشوند.
بسیاری از AMPs خاصیت ایمنیزایی (Immunomodulatory) نیز دارند که پاسخ ایمنی را تقویت میکند.
پپتیدهای آنتیاکسیدانی و محافظتی
پپتیدهای آنتیاکسیدانی نقش مهمی در کاهش آسیبهای اکسیداتیو و پیشگیری از بیماریهای مزمن ایفا میکنند.
این پپتیدها از طریق خنثیسازی رادیکالهای آزاد، سلولها را از استرس اکسیداتیو محافظت میکنند.
منابع اصلی این پپتیدها، پروتئینهای غذایی و فرآوردههای پروتئینی هیدرولیز شده هستند.
پپتیدهای تنظیمکننده سیستم ایمنی
برخی پپتیدها مستقیماً روی سلولهای ایمنی تأثیر گذاشته و پاسخهای ایمنی را تنظیم میکنند.
این پپتیدها میتوانند پاسخهای التهابی را کاهش دهند یا تقویت کنند.
برخی از آنها برای درمان بیماریهای خودایمنی و التهابی به کار میروند.
پپتیدهای سیگنالینگ داخل سلولی
برخی پپتیدها به صورت سیگنالهای داخل سلولی عمل کرده و مسیرهای بیوشیمیایی خاصی را فعال یا مهار میکنند.
به عنوان مثال، پپتیدهای مهارکننده آنزیمها یا فاکتورهای رونویسی که تنظیم فعالیت سلولی را بر عهده دارند.
کاربردهای دارویی و درمانی پپتیدها
پپتیدها به دلیل ساختار کوچک و خاصیت هدفمندی بالا، به عنوان داروهای نسل جدید مورد توجه هستند.
استفاده در درمان بیماریهای مزمن مانند دیابت، سرطان، و بیماریهای قلبی
توسعه داروهای آنتیمیکروبی و آنتیویروسی
کاربرد در دارورسانی هدفمند با کاهش عوارض جانبی
پپتیدها با تنوع عملکردی بالا و ویژگیهای زیستی خاص، نقش اساسی در فرایندهای بیولوژیکی و درمان بیماریها دارند. تحقیقات نوین بر روی پپتیدهای زیستی و طراحی پپتیدهای سنتتیک، افقهای جدیدی را در علوم پزشکی و بیوتکنولوژی گشوده است.
. توابع بیولوژیکی پروتئینها
پروتئینها، مولکولهای بزرگی با ساختارهای پیچیده و متنوع، نقش اساسی در تمامی فرآیندهای زیستی ایفا میکنند. توابع بیولوژیکی پروتئینها گسترده و متنوع است و از آنها میتوان به عنوان ماشینهای مولکولی سلول یاد کرد.
پروتئینها به عنوان آنزیمها
آنزیمها پروتئینهایی هستند که واکنشهای شیمیایی را در سلولها کاتالیز میکنند و سرعت آنها را تا میلیونها برابر افزایش میدهند.
هر آنزیم دارای سایت فعال مشخصی است که به سوبسترا متصل میشود.
آنزیمها در مسیرهای متابولیکی، تخریب مواد زائد، و سنتز مولکولهای حیاتی نقش دارند.
پروتئینهای ساختاری
پروتئینهای ساختاری مانند کلاژن، کراتین و الاستین، اسکلت سلول و بافتها را شکل میدهند و به حفظ شکل و استحکام بافتها کمک میکنند.
کلاژن در پوست، استخوانها و رباطها یافت میشود.
کراتین در مو، ناخن و پوست نقش حفاظتی دارد.
پروتئینهای انتقال دهنده و ذخیرهکننده
این پروتئینها مولکولها و یونهای مهم را در بدن حمل و ذخیره میکنند.
هموگلوبین: اکسیژن را در خون حمل میکند.
میوگلوبین: اکسیژن را در عضلات ذخیره میکند.
فریتین: آهن را ذخیره میکند.
پروتئینهای سیگنالدهنده
پروتئینها نقش پیامرسانهای سلولی را دارند و انتقال پیامها و تنظیم فعالیتهای سلولی را به عهده دارند.
گیرندههای پروتئینی روی سطح سلول، سیگنالهای محیطی را دریافت میکنند.
پروتئینهای کیناز مسیرهای سیگنالینگ را فعال میکنند.
پروتئینهای ایمنی
آنتیبادیها (ایمونولوگلوبولینها) پروتئینهای کلیدی سیستم ایمنی هستند که با شناسایی عوامل بیگانه، پاسخ ایمنی را فعال میکنند.
هر آنتیبادی ساختار خاصی دارد که به آنتیژنهای مشخص متصل میشود.
پروتئینهای مکمل در فرایندهای دفاعی دخالت دارند.
پروتئینهای حرکت و انتقال سلولی
پروتئینهای موتور مانند میوزین، کینزین و دینئین مسئول حرکت اندامکها و مواد در داخل سلول و همچنین حرکت سلولها هستند.
این پروتئینها انرژی شیمیایی ATP را به حرکت مکانیکی تبدیل میکنند.
در تقسیم سلولی و جابجایی وزیکولها نقش حیاتی دارند.
پروتئینهای تنظیمکننده ژن
پروتئینهای تنظیمکننده مانند فاکتورهای رونویسی، با اتصال به DNA، بیان ژنها را کنترل میکنند.
این پروتئینها تعیین میکنند کدام ژنها در چه زمانی و به چه میزان بیان شوند.
نقش کلیدی در توسعه، تمایز سلولی و پاسخ به استرس دارند.
پروتئینهای ذخیره انرژی و متابولیسم
پروتئینهایی مانند آنزیمهای متابولیکی در فرایند تولید، ذخیره و مصرف انرژی در سلولها نقش دارند.
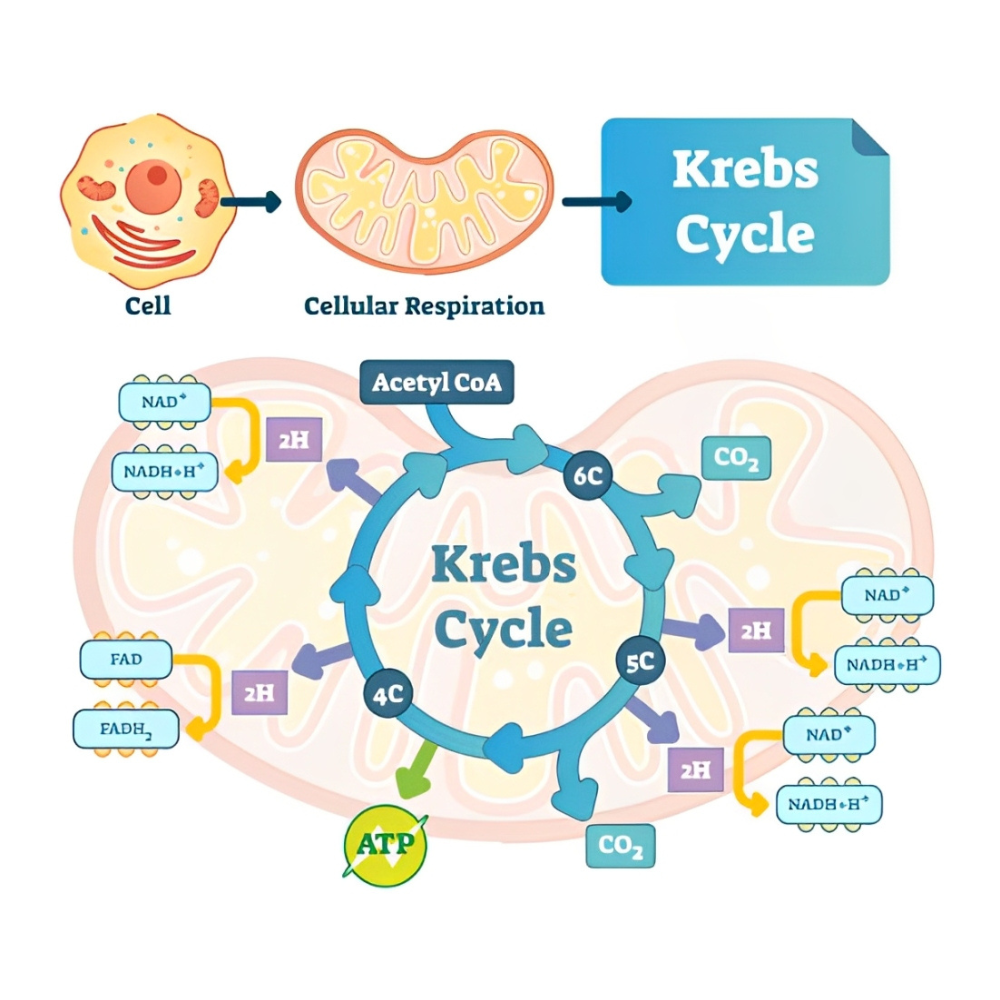
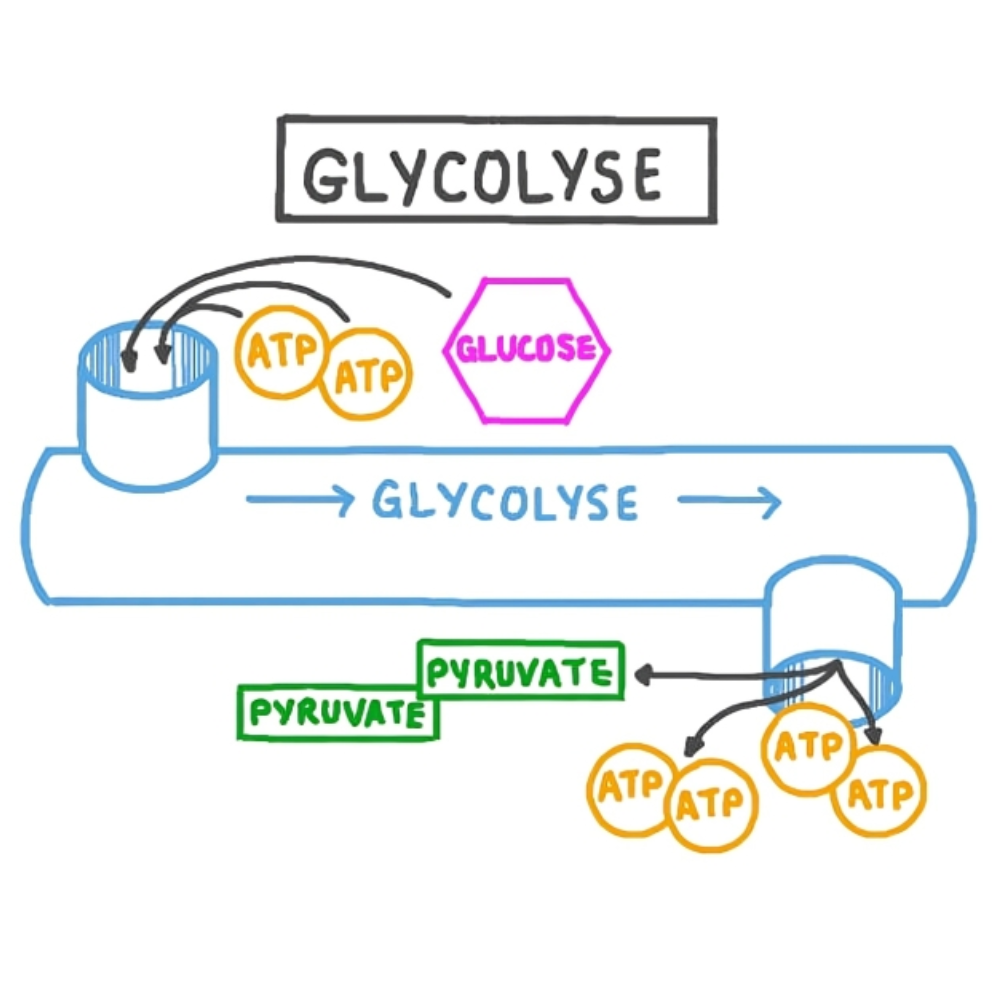
این پروتئینها در مسیرهای گلیکولیز، چرخه کربس، و زنجیره انتقال الکترون فعال هستند.
تنظیم دقیق فعالیت آنزیمها برای حفظ هموستازی انرژی ضروری است.
پروتئینها به دلیل ساختار پیچیده و متنوع خود، نقشهای کلیدی و متعددی در زیستشناسی و پزشکی ایفا میکنند. شناخت کامل توابع بیولوژیکی پروتئینها، پایهای برای درک عملکرد سلولها، توسعه داروها و درمان بیماریها است.
پروتئینها و پپتیدهای فعال زیستی
پروتئینها و پپتیدها علاوه بر نقشهای ساختاری و آنزیمی، میتوانند به صورت فعال زیستی در فرآیندهای بیولوژیکی مختلف نقش داشته باشند. این مولکولهای زیستی، به ویژه پپتیدهای فعال زیستی، دارای عملکردهای خاص و گوناگونی هستند که در سلامت و بیماری تأثیرگذارند.
تعریف پپتیدهای فعال زیستی
پپتیدهای فعال زیستی (Bioactive Peptides) کوتاهترین قطعات پروتئینی هستند که معمولاً از ۲ تا ۲۰ آمینواسید تشکیل شدهاند و پس از آزاد شدن از پروتئینهای بزرگتر، توانایی تنظیم فعالیتهای زیستی خاصی را دارند.
این پپتیدها میتوانند از طریق هیدرولیز پروتئینها در دستگاه گوارش، تخمیر و یا فرآیندهای صنعتی آزاد شوند.
فعالیتهای متنوعی مانند ضد میکروبی، ضد التهابی، آنتیاکسیدانی و تنظیم فشار خون دارند.
منابع و تولید پپتیدهای فعال زیستی
پپتیدهای فعال زیستی از منابع غذایی مختلف مانند شیر، تخم مرغ، ماهی، سویا و غلات استخراج میشوند.
تولید صنعتی آنها با استفاده از روشهایی مانند هیدرولیز آنزیمی، سنتز شیمیایی و بیوتکنولوژی انجام میشود.
عملکردهای بیولوژیکی پپتیدهای فعال
آنتیمیکروبیال: بسیاری از پپتیدهای فعال زیستی قادر به نابود کردن یا مهار رشد باکتریها، ویروسها و قارچها هستند.
آنتیاکسیدانی: کاهش استرس اکسیداتیو و حفاظت سلولها در برابر آسیبهای رادیکالی آزاد.
ضد التهابی: کاهش التهاب و تنظیم پاسخ ایمنی.
تنظیم فشار خون: برخی پپتیدها با مهار آنزیم مبدل آنژیوتانسین (ACE) به کاهش فشار خون کمک میکنند.
تنظیم سیستم ایمنی: تقویت یا تنظیم فعالیتهای ایمنی بدن.
پروتئینهای فعال زیستی
برخی پروتئینها به طور طبیعی دارای فعالیتهای بیولوژیکی فعال مانند هورمونها (انسولین، گلوکاگون)، فاکتورهای رشد و آنتیبادیها هستند.
این پروتئینها میتوانند به عنوان داروهای بیولوژیک در درمان بیماریها استفاده شوند.
کاربردهای پزشکی و صنعتی پپتیدها و پروتئینهای فعال زیستی
استفاده در داروسازی به عنوان درمانهای هدفمند و با عوارض کمتر.
کاربرد در صنایع غذایی برای تولید محصولات عملکردی (Functional Foods) با خواص سلامتمحور.
استفاده در محصولات آرایشی بهداشتی به دلیل خواص ضد پیری و ترمیمی.
چالشها و فرصتها
پایداری: پپتیدهای فعال زیستی معمولاً در برابر هضم آنزیمی و شرایط محیطی حساس هستند که نیاز به فرمولاسیونهای مناسب دارند.
تحویل هدفمند: توسعه سیستمهای تحویل مؤثر برای افزایش جذب و اثرگذاری آنها.
سنتز و تولید: هزینههای بالای تولید و نیاز به فناوریهای نوین برای افزایش بهرهوری.
پروتئینها و پپتیدهای فعال زیستی، با توجه به ویژگیهای منحصر به فردشان، فرصتهای وسیعی در پزشکی، تغذیه و صنعت دارویی فراهم کردهاند. توسعه دانش و فناوری در زمینه این مولکولها، میتواند به درمانهای نوین و بهبود کیفیت زندگی انسانها کمک شایانی کند.
پروتئینهای دارویی و پپتیدهای درمانی
پروتئینها و پپتیدها به عنوان داروهای درمانی در پزشکی مدرن جایگاه ویژهای دارند. این مولکولها به دلیل اختصاصی بودن، توانایی هدفگیری دقیق و عملکرد بیولوژیکی قوی، در درمان بیماریهای متعددی از جمله سرطان، بیماریهای التهابی، دیابت و عفونتها استفاده میشوند.
معرفی پروتئینها و پپتیدهای درمانی
پروتئینهای درمانی: پروتئینهایی مانند آنتیبادیها، فاکتورهای رشد، هورمونها و آنزیمها که به عنوان دارو مورد استفاده قرار میگیرند.
پپتیدهای درمانی: پپتیدهای کوتاهی که نقش درمانی داشته و معمولاً قابلیت سنتز شیمیایی یا بیوتکنولوژیکی دارند.
مزایا و محدودیتها
-
مزایا:
-
فعالیت اختصاصی و هدفمند
-
کمتر بودن عوارض جانبی نسبت به داروهای شیمیایی سنتی
-
امکان تنظیم فعالیت از طریق اصلاحات ساختاری
-
-
محدودیتها:
-
حساسیت بالا به تخریب آنزیمی و شرایط محیطی
-
نیاز به سیستمهای تحویل پیچیده برای رسیدن به محل هدف
-
هزینه بالای تولید و فرمولاسیون
-
انواع پروتئینها و پپتیدهای درمانی
-
آنتیبادیها : مهمترین دسته پروتئینهای درمانی با توانایی هدفگیری اختصاصی آنتیژنها؛ کاربرد در درمان سرطان، بیماریهای خودایمنی و عفونتها.
-
هورمونها : مانند انسولین، هورمون رشد، که در درمان بیماریهای متابولیکی و رشد استفاده میشوند.
-
آنزیمها: به منظور جایگزینی آنزیمهای معیوب یا افزایش فعالیت آنزیمی در بیماریهای خاص.
-
پپتیدهای ضد میکروبی : استفاده در درمان عفونتهای مقاوم به آنتیبیوتیکها.
-
پپتیدهای تنظیمکننده: مانند آگونیستها و آنتاگونیستهای گیرندهها برای تنظیم مسیرهای سیگنالینگ سلولی.
چالشهای فرمولاسیون و تحویل دارو
-
محافظت از پایداری پروتئینها و پپتیدها در برابر تخریبهای فیزیکی و شیمیایی
-
استفاده از نانوذرات، لیپوزومها، و سیستمهای تحویل دارویی برای افزایش بیوانفورماسیون و هدفمندی
-
توسعه روشهای تحویل غیر تزریقی (مانند خوراکی، استنشاقی، پوستی(
نمونههای موفق داروهای پروتئینی و پپتیدی
-
انسولین (درمان دیابت)
-
اریتروپویتین (تحریک تولید گلبولهای قرمز)
-
آنتیبادیهای مونوکلونال (درمان سرطانها و بیماریهای خودایمنی)
-
پپتیدهای ضد درد و ضد التهاب
چشمانداز آینده
پیشرفت در فناوریهای بیوتکنولوژی، طراحی مهندسی مولکولی و سیستمهای تحویل دارویی، باعث گسترش روزافزون کاربردهای پروتئینها و پپتیدهای درمانی خواهد شد. انتظار میرود در آینده نزدیک شاهد تولید داروهای با کارایی بالاتر، پایداری بهتر و عوارض کمتر باشیم.
برهمکنش پروتئین-پروتئین و نقش لینکرها در مهندسی ساختار
برهمکنشهای پروتئین-پروتئین ) Protein-Protein Interactions یا( PPI نقش حیاتی در بسیاری از فرآیندهای زیستی ایفا میکنند، از جمله سیگنال دهی سلولی، تشکیل ساختارهای مولکولی، و تنظیم فعالیتهای آنزیمی. این تعاملات میتوانند موقتی یا پایدار بوده و نحوه شکل گیری و پایداری آنها به ویژگیهای ساختاری و دینامیکی پروتئینها بستگی دارد.
اهمیت برهمکنشهای پروتئین-پروتئین
-
کنترل مسیرهای سیگنالینگ و واکنشهای بیوشیمیایی
-
تشکیل کمپلکسهای چند زیر واحدی برای عملکرد صحیح سلولی
-
تنظیم فعالیت آنزیمها و پروتئینهای ساختاری
-
تأثیر در فرآیندهای بیماریزایی و هدف گذاری دارویی
انواع برهمکنشها
-
برهمکنشهای موقتی (Transient) : معمولاً کوتاه مدت و قابل بازگشت، مانند تعاملات در مسیرهای سیگنالینگ.
-
برهمکنشهای پایدار (Stable) : تشکیل کمپلکسهای پایدار برای انجام وظایف ساختاری یا کاتالیزوری.
نقش لینکرها (Linkers) در ساختار و عملکرد
لینکرها، قطعات پیوندی انعطافپذیر یا نیمهسخت هستند که دو یا چند بخش پروتئینی را به هم متصل میکنند. این بخشها در مهندسی پروتئینها و طراحی داروهای زیستی اهمیت بالایی دارند:
-
ایجاد فاصله مناسب بین دامنههای عملکردی
-
افزایش پایداری و قابلیت تنظیم مولکولهای ترکیبی
-
بهبود عملکرد و کاهش اثرات ناخواسته (مانند تداخل ساختاری(
-
کنترل درجه انعطافپذیری و ثبات ساختاری
مهندسی لینکرها در طراحی پروتئینهای ترکیبی
-
استفاده از لینکرهای کوتاه یا بلند بسته به نیاز عملکردی
-
بهکارگیری لینکرهای انعطافپذیر یا سفت برای تنظیم دینامیک ساختاری
-
طراحی لینکرهای حساس به شرایط محیطی برای کنترل آزادسازی یا فعالیت
روشهای مطالعه و شناسایی برهمکنشهای PPI
-
روشهای بیوفیزیکی: طیفسنجی جرمی، کروماتوگرافی، NMR، کریستالوگرافی اشعه ایکس
-
روشهای زیستمولکولی: کشف برهمکنش با تکنیکهایی مثل Yeast Two-Hybrid، Co-immunoprecipitation
-
روشهای محاسباتی: مدلسازی مولکولی و شبیهسازی دینامیک مولکولی
کاربردهای دارویی و بیوتکنولوژیکی
-
طراحی داروهای هدفمند بر اساس برهمکنشهای PPI
-
توسعه آنتیبادیها و پروتئینهای مهندسی شده برای مداخله در مسیرهای بیماریزا
-
ساخت پروتئینهای چند عملکردی با استفاده از لینکرهای مهندسی شد
این بخش به درک عمیقتری از پیچیدگیهای ساختاری و عملکردی پروتئینها کمک کرده و افقهای جدیدی برای طراحی داروهای نوین باز میکند.
پپتیدها و نانوذرات: تعامل، کاربرد و آیندهپژوهی
ترکیب پپتیدها با نانوذرات به عنوان یک رویکرد نوین در علوم زیستی و نانوتکنولوژی، فرصتهای فراوانی را برای توسعه سیستمهای هدفمند دارورسانی، تشخیص بیماریها و مهندسی بافت فراهم کرده است. این تعاملات میتوانند ویژگیهای فیزیکی و شیمیایی نانوذرات را بهبود بخشیده و کارایی عملکرد پپتیدها را افزایش دهند.
تعاملات بین پپتیدها و نانوذرات
پپتیدها میتوانند به سطوح نانوذرات از طریق نیروهای غیرکووالانسی مانند هیدروفوبی، الکترواستاتیک و پیوند هیدروژنی متصل شوند. همچنین پیوندهای کووالانسی برای ایجاد اتصال پایدار بین پپتید و نانوذره مورد استفاده قرار میگیرد.
-
اثر پوشش پپتیدی: افزایش پایداری نانوذرات در محیطهای زیستی و جلوگیری از تجمع ناخواسته.
-
تغییر ویژگیهای سطحی: بهبود زیستسازگاری و قابلیت هدفگیری سلولی.
کاربردهای نانوذرات پپتیدی
-
دارورسانی هدفمند: استفاده از نانوذرات پوشیده شده با پپتیدها برای انتقال دقیق دارو به سلولهای هدف، کاهش عوارض جانبی و افزایش اثربخشی درمان.
-
تشخیص پزشکی: طراحی سیستمهای حسگری با نانوذرات پپتیدی برای شناسایی سریع و دقیق نشانگرهای بیماری.
-
مهندسی بافت و ترمیم: استفاده از نانوذرات حامل پپتیدها برای تحریک رشد سلولی و بهبود روند بهبود زخم و بازسازی بافت.
-
فعالیت ضد میکروبی: تقویت عملکرد ضدباکتریایی و ضد ویروسی پپتیدها با استفاده از نانوذرات فلزی مانند نقره یا طلا.
مزایا و چالشهای استفاده از نانوذرات پپتیدی
-
مزایا:
-
بهبود پایداری و زیستسازگاری پپتیدها
-
افزایش جذب سلولی و هدفگیری اختصاصی
-
امکان تنظیم رهایش دارو و کنترل زمان اثر
-
-
چالشها:
-
کنترل دقیق سطح پوشش پپتیدی روی نانوذرات
-
ارزیابی سمیت و ایمنی در بدن
-
پیچیدگی در فرآیند تولید و مقیاسپذیری
-
آیندهپژوهی و روندهای نوین
-
نانوذرات هوشمند : توسعه نانوذراتی که پاسخ دهی به محرکهای محیطی (pH، دما، آنزیمها) را دارا باشند.
-
بیومیمتیک: طراحی نانوذرات با الگوهای ساختاری و عملکردی مشابه سیستمهای زیستی برای بهبود تعاملات سلولی.
-
ترکیب فناوریهای مولکولی و نانومواد : استفاده همزمان از پپتیدهای طراحی شده و نانوذرات برای توسعه سیستمهای چند کاره درمانی و تشخیصی.
-
مطالعات بالینی پیشرفته: حرکت به سمت ارزیابی ایمنی و اثربخشی نانوذرات پپتیدی در انسانها.
ترکیب پپتیدها با نانوذرات نه تنها قابلیتهای درمانی و تشخیصی را ارتقاء میدهد، بلکه چشمانداز جدیدی برای توسعه فناوریهای زیستی و پزشکی نوین ایجاد میکند. پیشرفتهای آتی در این حوزه نیازمند همکاری میان رشتهای و رویکردهای نوآورانه خواهد بود تا بتوان از پتانسیل کامل این فناوری بهره برداری کرد.
پروتئینها و بیماریها: اشتباه در تاخوردگی، آمیلوئیدها و بیماریهای انسانی
پروتئینها نقش کلیدی در عملکردهای زیستی سلولها دارند و تاخوردگی صحیح آنها برای حفظ فعالیت بیولوژیکی ضروری است. با این حال، اختلالات در فرایند تاخوردگی میتواند منجر به شکلگیری ساختارهای ناهنجار و بیماریهای متعددی شود.
تاخوردگی پروتئین و اهمیت آن
تاخوردگی (Folding) فرایندی است که پروتئینها از زنجیرههای خطی آمینواسیدی به ساختارهای سهبعدی فعال خود میرسند. این ساختار سهبعدی برای عملکرد صحیح پروتئین حیاتی است و توسط عوامل مولکولی مانند:
-
مولکولهای همیار (Molecular Chaperones) : کمک به پروتئینها در رسیدن به ساختار صحیح.
-
محیط سلولی: شرایط فیزیولوژیکی که بر سرعت و صحت تاخوردگی تأثیر میگذارد.
پروتئینهای دچار اشتباه در تاخوردگی
وقتی پروتئینها نتوانند ساختار صحیح خود را تشکیل دهند، ممکن است:
-
ناپایداری و تخریب: پروتئینها توسط مکانیزمهای سلولی حذف شوند.
-
تجمع پروتئینی: شکلگیری تجمعات سمی که به سلول آسیب میرسانند.
این تجمعات اغلب منجر به بیماریهایی با منشأ پروتئینی میشوند.
آمیلوئیدها و نقش آنها در بیماریها
آمیلوئیدها، ساختارهای غیرطبیعی پروتئینی هستند که در اثر اشتباه در تا خوردگی پروتئینها ایجاد میشوند و به صورت الیاف فیبری تجمع مییابند. این فیبرها:
-
مقاومت بالا در برابر تجزیه دارند.
-
به صورت پلاک یا رسوبات در بافتها انباشته میشوند.
آمیلوئیدها نقش مهمی در بیماریهای مختلفی دارند مانند:
-
آلزایمر : تجمع پلاکهای آمیلوئیدی در مغز که باعث اختلال در عملکرد عصبی میشود.
-
پارکینسون : تجمع α-سینوکلئین به شکل آمیلوئید.
-
دیابت نوع ۲ : تجمع آمیلوئید در پانکراس.
-
بیماریهای دیگر : مانند آمیلوئیدوز سیستمیک و برخی نارساییهای کبدی و کلیوی.
مکانیسمهای سلولی مقابله با پروتئینهای اشتباه تاخورده
سلولها سیستمهای حفاظتی مختلفی برای مدیریت پروتئینهای معیوب دارند، از جمله:
-
پروتئازوم: تخریب پروتئینهای غیرطبیعی.
-
اتو فاژی: حذف تجمعات بزرگ پروتئینی.
-
سیستم استرس سلولی: افزایش بیان مولکولهای همیار در شرایط استرس.
نقش پروتئینها در سایر بیماریهای انسانی
-
سرطان: جهشها در پروتئینهای تنظیم کننده چرخه سلولی.
-
بیماریهای قلبی: اختلال در عملکرد پروتئینهای ساختاری عضله قلب.
-
اختلالات متابولیک: نقص در آنزیمهای پروتئینی موثر در سوخت و ساز.
چشمانداز درمانی و پژوهشی
-
توسعه داروهایی که به اصلاح یا حذف پروتئینهای اشتباه تاخورده کمک میکنند.
-
استفاده از تکنولوژیهای نوین مانند دارورسانی هدفمند و مهندسی پروتئین.
-
بررسی نقش آمیلوئیدها در بیماریهای کمتر شناخته شده.
اختلالات در تاخوردگی پروتئین و تشکیل آمیلوئیدها، بنیان بسیاری از بیماریهای جدی انسانی را تشکیل میدهند. شناخت دقیق این فرآیندها و مکانیسمهای مرتبط، کلید توسعه درمانهای نوین و بهبود کیفیت زندگی بیماران خواهد بود.
جمعبندی و پاسخ به پرسشهای پرتکرار متخصصان
در این مقاله، به بررسی جامع و دقیق پپتیدها و پروتئینها از جنبههای مختلف پرداختیم. تفاوتهای اساسی پپتیدها و پروتئینها در ساختار و عملکرد، نحوه سنتز و تاخوردگی آنها، توابع بیولوژیکی متنوع، و نقش حیاتی آنها در سلامتی و بیماریها مورد بحث قرار گرفت. همچنین کاربردهای درمانی و دارویی، نقش پروتئینها و پپتیدهای فعال زیستی، و برهمکنشهای پیچیده پروتئینی با دیگر مولکولها و نانوذرات بررسی شد.
مهمترین نکات این مرور عبارتند از:
-
تفاوت در اندازه و ساختار : پپتیدها معمولاً کوتاهتر و سادهتر از پروتئینها هستند، اما هر دو نقشهای مهم زیستی دارند.
-
ساختارهای تاخورده و عملکرد: ساختار سهبعدی صحیح کلید عملکرد پروتئینها است، و اختلال در تاخوردگی منجر به بیماری میشود.
-
کاربردهای بالینی: پپتیدها و پروتئینها در درمان بیماریها، بهویژه بهعنوان داروهای هدفمند، نقش مهمی ایفا میکنند.
-
تعاملات مولکولی : برهمکنشهای پروتئین-پروتئین و با نانوذرات، زمینههای نوینی را برای مهندسی زیستی و درمان باز میکند.
-
پروتئینها و بیماری : اختلالات تاخوردگی و تجمع آمیلوئیدها نقش مهمی در بیماریهای عصبی، متابولیک و دیگر بیماریها دارند.
پرسشهای پرتکرار متخصصان
۱. تفاوت اصلی پپتید و پروتئین چیست؟
پپتیدها زنجیرههای کوتاهتر از اسیدهای آمینه هستند (معمولاً زیر ۵۰ آمینواسید) و معمولاً فاقد ساختارهای سهبعدی پیچیدهاند. پروتئینها از چندین زنجیره بلند تشکیل شدهاند و ساختارهای ثانویه، ثالثیه و گاهی چهارم دارند که عملکردهای متنوعی را امکانپذیر میکنند.
۲. چگونه میتوان ثبات پروتئینهای دارویی را حفظ کرد؟
از طریق فرمولاسیونهای خاص، (PEGylation) متصل کردن پلیاتیلن گلیکول، استفاده از افزودنیهای پایدارکننده و نگهداری در شرایط بهینه مانند دما و pH کنترلشده.
۳. چرا تاخوردگی پروتئین مهم است؟
تاخوردگی صحیح برای عملکرد پروتئین حیاتی است و اختلال در این فرایند باعث تولید پروتئینهای غیرکارآمد یا سمی میشود که به بیماری منجر میشود.
۴. چه نقشهایی برای پپتیدهای فعال زیستی تعریف شده است؟
پپتیدهای فعال زیستی میتوانند اثرات ضد میکروبی، ضد التهابی، آنتیاکسیدانی، تنظیمکننده سیستم ایمنی و حتی عملکردهای سیگنالدهی در بدن داشته باشند.
۵. چگونه برهمکنش پروتئین-پروتئین در طراحی داروها استفاده میشود؟
درک این برهمکنشها امکان طراحی داروهایی را میدهد که میتوانند این تعاملات را هدف قرار داده یا اصلاح کنند، به ویژه در بیماریهایی که ناشی از اختلال در این برهمکنشها هستند.
۶. آیا نانوذرات میتوانند به بهبود عملکرد دارویی پپتیدها و پروتئینها کمک کنند؟
بله، نانوذرات میتوانند به عنوان حاملهای هدفمند دارویی عمل کنند که پایداری، جذب سلولی و توزیع دارو را بهبود میبخشند.
۷. آمیلوئیدها چه نقشی در بیماریها دارند؟
آمیلوئیدها تجمعات غیرطبیعی پروتئینی هستند که منجر به آسیب بافتی و بیماریهایی مانند آلزایمر و پارکینسون میشوند.
پیشنهادات و چشمانداز آینده
پیشرفتهای فناوریهای نوین مانند CRISPR، مهندسی پروتئین و نانوتکنولوژی، چشماندازهای جدیدی برای درک بهتر و استفاده هدفمند از پپتیدها و پروتئینها در پزشکی و صنایع زیستی فراهم کردهاند. پژوهشهای متمرکز بر افزایش پایداری، قابلیت هدف گیری و کاهش عوارض جانبی داروهای پروتئینی میتواند منجر به درمانهای موثرتر و ایمنتر شود.