مسیر فسفریلاسیون سوبسترا و اکسیداتیو؛ تفاوت و کاربرد
مقدمهای بر فسفریلاسیون در سلولهای انسانی
فسفریلاسیون یکی از مهمترین و پرکاربردترین مکانیسمهای تنظیمی در سلولهای یوکاریوتی و پروکاریوتی است که نقش کلیدی در تنظیم متابولیسم انرژی، سیگنالینگ سلولی، و فعالیت آنزیمها دارد. این فرآیند به طور ساده عبارت است از افزایش یک گروه فسفات⁻ به یک مولکول خاص، معمولاً یک پروتئین یا متابولیت، که منجر به تغییر در فعالیت، پایداری، یا مکان آن مولکول در سلول میشود.
فسفریلاسیون در سلولهای انسانی به دو شکل عمده تقسیم میشود:
-
فسفریلاسیون سوبسترا که در مسیرهایی چون گلیکولیز و چرخه کربس دیده میشود و بدون نیاز به اکسیژن مستقیماً ATP تولید میکند.
-
فسفریلاسیون اکسیداتیو که وابسته به حضور اکسیژن در میتوکندری است و با بهره گیری از زنجیره انتقال الکترون، مقدار قابل توجهی انرژی در قالب ATP تولید میکند.
در هر دو مسیر، فسفریلاسیون نقش یک محرک بیوشیمیایی کلیدی را ایفا میکند که با افزودن یا حذف یک گروه فسفات، میتواند مسیرهای سلولی را فعال یا غیرفعال کرده و حتی مسیرهای آپوپتوز یا تمایز سلولی را تنظیم نماید.
اهمیت فسفریلاسیون در متابولیسم سلولی
فسفریلاسیون نقش مهمی در تأمین و مصرف انرژی دارد. در مسیرهای متابولیکی مانند گلیکولیز، گروههای فسفات به متابولیتهای واسطهای متصل میشوند تا آنها را فعالتر و واکنشپذیرتر سازند، در حالی که در فسفریلاسیون اکسیداتیو، ATP حاصل از انتقال الکترون در غشای داخلی میتوکندری تولید میشود.
تفاوت در عملکرد این دو مسیر سبب میشود تا بسته به شرایط محیطی مانند میزان اکسیژن، نیاز فوری به انرژی، یا وضعیت تغذیهای بدن، یکی از این مسیرها غالب شود. به عنوان مثال، در هنگام فعالیت شدید عضلانی یا شرایط هیپوکسی، مسیر فسفریلاسیون سوبسترا ترجیح داده میشود؛ در حالی که در شرایط پایدار، فسفریلاسیون اکسیداتیو راندمان بالاتری دارد.
فسفریلاسیون به عنوان تنظیمکننده سیگنالینگ سلولی
بیش از 30 درصد پروتئینهای سلولی تحت تأثیر فسفریلاسیون قرار میگیرند. این فرآیند نه تنها باعث تغییر در ساختار فضایی پروتئینها میشود، بلکه عملکرد آنها در تعامل با سایر مولکولها را نیز تغییر میدهد. فسفریلاسیون میتواند مسیرهایی مانند PI3K/Akt، mTOR، MAPK و AMPK را فعال یا مهار کند که در رشد، تقسیم، بقا، و مرگ سلولی نقش دارند.
همچنین نقش فسفریلاسیون در سیگنالینگ عصبی، تنظیم متابولیسم گلوکز، و پاسخ به استرس اکسیداتیو در بسیاری از بیماریها مانند سرطان، دیابت و اختلالات میتوکندریایی به اثبات رسیده است.
فسفریلاسیون سوبسترا چیست؟
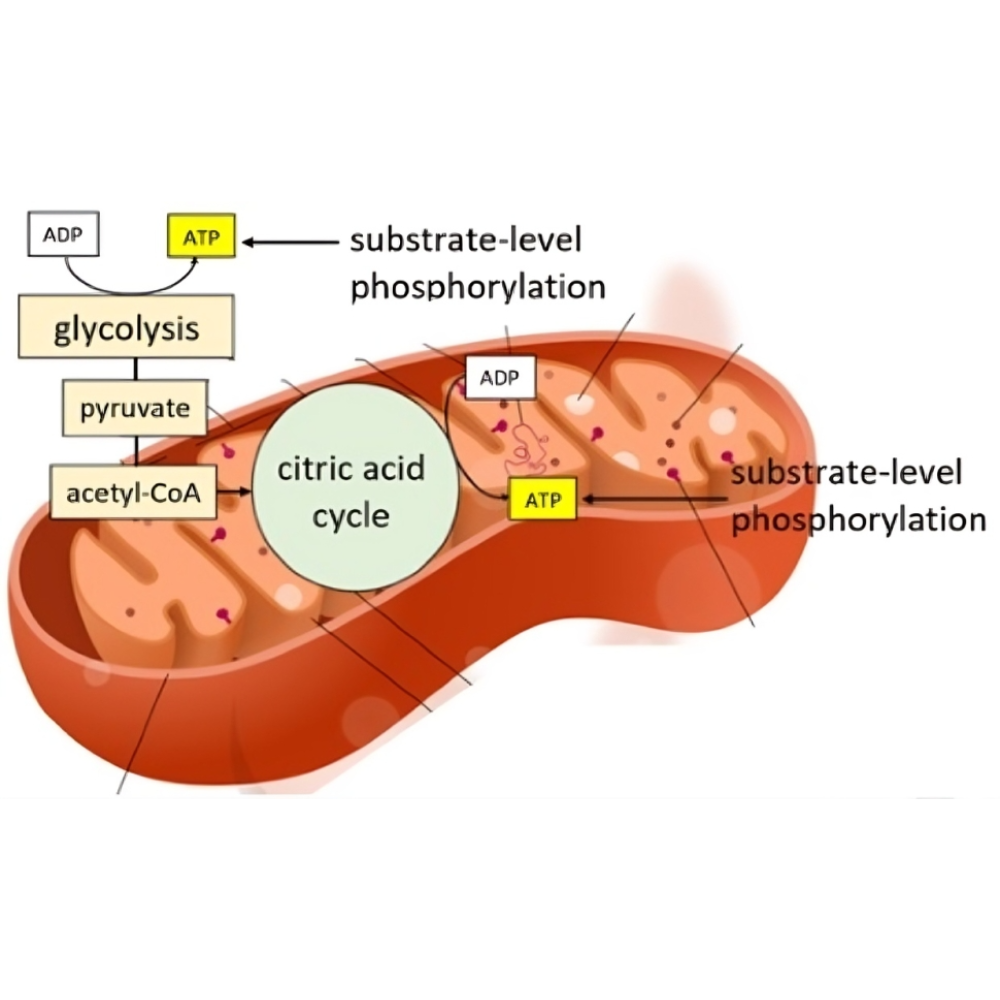
فسفریلاسیون سوبسترا (Substrate-Level Phosphorylation) یکی از دو مکانیزم اصلی برای تولید ATP در سلولهاست که برخلاف فسفریلاسیون اکسیداتیو، نیازمند اکسیژن نیست و بهصورت مستقل در سیتوپلاسم یا ماتریکس میتوکندری رخ میدهد. در این فرآیند، یک گروه فسفات با انرژی بالا مستقیماً از یک سوبسترا به ADP منتقل میشود تا ATP تولید گردد، بدون دخالت زنجیره انتقال الکترون یا گرادیان پروتون.
مکانهای وقوع فسفریلاسیون سوبسترا در بدن
فسفریلاسیون سوبسترا در دو مسیر متابولیکی اصلی دیده میشود:
-
گلیکولیز (Glycolysis): در سیتوپلاسم سلولها رخ میدهد. دو مرحله در این مسیر شامل فسفوگلیسرات کیناز و پیروات کیناز هستند که طی آنها ATP مستقیماً تولید میشود.
-
چرخه کربس (Citric Acid Cycle): در ماتریکس میتوکندری اتفاق میافتد. مرحلهای شامل سوکسینیل کوآ سنتتاز است که GTP یا ATP تولید میکند.
این مسیر بهویژه در شرایط کمبود اکسیژن (هیپوکسی) یا در سلولهایی که فاقد میتوکندری هستند (مانند گلبولهای قرمز)، نقش حیاتی در تأمین انرژی دارد.
ویژگیهای کلیدی فسفریلاسیون سوبسترا
-
مستقل از اکسیژن : برخلاف فسفریلاسیون اکسیداتیو، نیازی به اکسیژن برای انجام این فرآیند وجود ندارد.
-
سرعت بالا: در شرایطی که سلول به انرژی فوری نیاز دارد (مثل فعالیت شدید عضلات)، این مسیر میتواند به سرعت ATP تولید کند.
-
بازده پایین انرژی : تولید ATP در این مسیر بهطور قابل توجهی کمتر از فسفریلاسیون اکسیداتیو است (در گلیکولیز تنها ۲ مولکول ATP برای هر گلوکز حاصل میشود).
-
مناسب برای شرایط بحرانی : در سلولهای سرطانی، محیطهای ایسکمیک و بافتهایی با گردش خون ضعیف، فسفریلاسیون سوبسترا بهعنوان منبع اصلی ATP فعال میشود.
اهمیت بالینی فسفریلاسیون سوبسترا
-
در سلولهای سرطانی، اغلب شاهد افزایش وابستگی به گلیکولیز و فسفریلاسیون سوبسترا هستیم؛ پدیدهای که با نام اثر واربورگ (Warburg Effect) شناخته میشود.
-
در بافتهای ایسکمیک مانند قلب پس از حمله قلبی یا مغز در سکته، این مسیر برای حفظ حداقل عملکرد سلولی حیاتی است.
-
برخی بیماریهای متابولیکی یا میتوکندریایی نیز سبب افزایش فعالیت این مسیر برای جبران اختلال در تولید انرژی از طریق فسفریلاسیون اکسیداتیو میشوند.
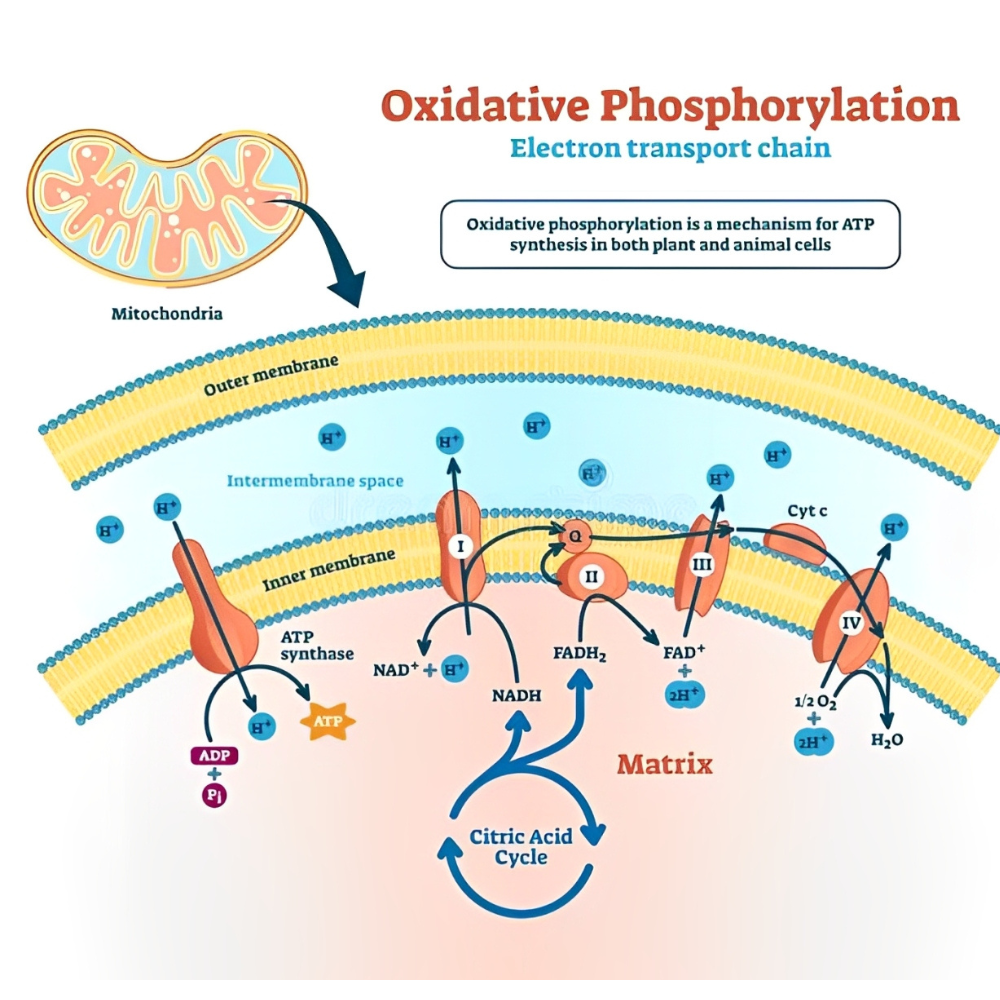
فسفریلاسیون اکسیداتیو؛ ستون فقرات تولید ATP در میتوکندری
فسفریلاسیون اکسیداتیو (Oxidative Phosphorylation) پیچیدهترین و در عین حال کارآمدترین مکانیسم تولید ATP در سلولهای یوکاریوتی است. این فرآیند در غشای داخلی میتوکندری رخ میدهد و نقش آن در تأمین انرژی مورد نیاز بدن، حیاتی و غیرقابل جایگزین است. برخلاف فسفریلاسیون سوبسترا که بهطور مستقیم فسفات را منتقل میکند، در فسفریلاسیون اکسیداتیو از زنجیره انتقال الکترون و گرادیان پروتون برای تولید ATP استفاده میشود.
اجزای کلیدی فسفریلاسیون اکسیداتیو
فسفریلاسیون اکسیداتیو از دو جزء اصلی تشکیل شده است:
-
زنجیره انتقال الکترون (ETC) : مجموعهای از پروتئینهای بزرگ (کمپلکسهای I تا IV ) که در غشای داخلی میتوکندری قرار دارند. این کمپلکسها الکترونها را از NADH و FADH₂ گرفته و به اکسیژن منتقل میکنند، که در نهایت با اکسیژن و پروتون، آب تولید میشود.
-
ATP سنتاز : (Complex V) یک پروتئین آنزیمی بزرگ که از انرژی گرادیان پروتون ایجاد شده توسط ETC استفاده کرده و آن را به انرژی شیمیایی ATP تبدیل میکند.
مراحل عملکرد فسفریلاسیون اکسیداتیو
-
اکسیداسیون کوآنزیمها NADH و FADH₂ : که از مسیرهایی مانند گلیکولیز، چرخه کربس و β-اکسیداسیون اسیدهای چرب بهدست آمدهاند، الکترونهای خود را به زنجیره انتقال الکترون منتقل میکنند.
-
ایجاد گرادیان پروتون: جریان الکترون باعث پمپ شدن پروتونها از ماتریکس به فضای بینغشایی میتوکندری میشود و اختلاف الکتروشیمیایی (پتانسیل پروتون) ایجاد میگردد.
-
سنتز ATP : پروتونها از طریق ATP سنتاز به ماتریکس بازمیگردند و انرژی حاصل از این جریان، برای تبدیل ADP به ATP مورد استفاده قرار میگیرد.
بهره وری انرژی در فسفریلاسیون اکسیداتیو
هر مولکول گلوکز از طریق این مسیر میتواند حدود 34 مولکول ATP تولید کند که در مقایسه با تنها 2 ATP در فسفریلاسیون سوبسترا بسیار بالاتر است. نسبت معروف P/O ( تعداد مولکولهای ATP تولید شده به ازای هر مول الکترون منتقلشده) بسته به مسیر و کوآنزیم درگیر، متفاوت است:
-
برای NADH : تقریباً 2.5 ATP
-
برای FADH₂ : تقریباً 1.5 ATP
نقش اکسیژن در فسفریلاسیون اکسیداتیو
اکسیژن بهعنوان گیرنده نهایی الکترون در انتهای زنجیره انتقال الکترون، نقش حیاتی دارد. در صورت نبود اکسیژن، انتقال الکترون متوقف شده و گرادیان پروتون برقرار نمیشود؛ در نتیجه، تولید ATP از طریق فسفریلاسیون اکسیداتیو قطع خواهد شد. این ویژگی باعث میشود که فسفریلاسیون اکسیداتیو وابسته به اکسیژن و محیط هوازی باشد.
نقش ساختارهای فوق مولکولی در کارایی فسفریلاسیون اکسیداتیو
تحقیقات اخیر نشان دادهاند که سوپراکومپلکسهای میتوکندری (مجموعههایی از چند کمپلکس زنجیره انتقال الکترون) به پایداری و کارایی بیشتر این فرآیند کمک میکنند. این ساختارها علاوه بر افزایش انتقال الکترون، کاهش تولید گونههای فعال اکسیژن (ROS) را نیز سبب میشوند.
اهمیت بالینی فسفریلاسیون اکسیداتیو
-
در بسیاری از بیماریهای ژنتیکی، به ویژه اختلالات میتوکندریایی، عملکرد فسفریلاسیون اکسیداتیو مختل میشود و منجر به کاهش تولید ATP و افزایش استرس اکسیداتیو میگردد.
-
در بیماریهای متابولیک، دیابت، سرطان و پیری سلولی، اختلال در این مسیر یکی از نشانههای اولیه آسیبهای سلولی محسوب میشود.
-
همچنین تحقیقات در زمینهی پیری و طول عمر، نقش فسفریلاسیون اکسیداتیو را در تنظیم سلامت سلولی و مقاومت در برابر استرسهای محیطی برجسته کردهاند.
تفاوتهای کلیدی بین فسفریلاسیون سوبسترا و اکسیداتیو
فسفریلاسیون سوبسترا و فسفریلاسیون اکسیداتیو دو مسیر بنیادین برای تولید ATP در سلولها هستند. هرچند هر دو در خدمت تأمین انرژی مورد نیاز سلول قرار دارند، اما در مکان، مکانیزم، سرعت، وابستگی به اکسیژن و بازده انرژی تفاوتهای اساسی دارند. شناخت دقیق این تفاوتها نه تنها در درک متابولیسم پایه اهمیت دارد، بلکه در درمان بیماریهای متابولیکی و طراحی استراتژیهای ورزشی و تغذیهای نیز نقش کلیدی ایفا میکند.
مقایسه مکان انجام فرآیند
-
فسفریلاسیون سوبسترا در سیتوزول (مانند مرحله گلیکولیز) یا ماتریکس میتوکندری (مانند چرخه کربس) انجام میشود.
-
فسفریلاسیون اکسیداتیو منحصراً در غشای داخلی میتوکندری رخ میدهد.
وابستگی به اکسیژن
-
فسفریلاسیون سوبسترا مستقل از اکسیژن است و در شرایط بیهوازی نیز فعالیت دارد.
-
فسفریلاسیون اکسیداتیو کاملاً وابسته به اکسیژن است؛ چرا که اکسیژن به عنوان گیرنده نهایی الکترون عمل میکند.
مکانیزم تولید ATP
-
در فسفریلاسیون سوبسترا، انتقال مستقیم گروه فسفات از یک مولکول فسفوریله شده به ADP منجر به تولید ATP میشود.
-
در فسفریلاسیون اکسیداتیو، ATP از طریق استفاده از انرژی حاصل از گرادیان پروتون )الکتروموتیو) تولید میشود.
میزان تولید ATP
-
فسفریلاسیون سوبسترا مقدار نسبتاً کمی ATP تولید میکند؛ بهعنوان مثال، در گلیکولیز فقط ۲ ATP تولید میشود.
-
فسفریلاسیون اکسیداتیو بخش عمدهی ATP را تأمین میکند؛ در یک مسیر کامل گلوکز، حدود ۳۲-۳۴ ATP از این طریق حاصل میشود.
سرعت پاسخدهی به نیاز انرژی
-
فسفریلاسیون سوبسترا سریع و فوری بوده و در شرایط حاد مانند فعالیت ورزشی شدید نقش اصلی دارد.
-
فسفریلاسیون اکسیداتیو کندتر اما پایدارتر است و برای تأمین انرژی در شرایط پایدار و بلن دمدت مناسبتر است.
نقش در پاتولوژی و سازگاری سلولی
-
در شرایط بیماری مانند سرطان یا ایسکمی بافتی، سلولها تمایل دارند بیشتر به فسفریلاسیون سوبسترا تکیه کنند تا زنده بمانند.
-
اختلال در فسفریلاسیون اکسیداتیو با افزایش گونههای فعال اکسیژن (ROS) و آسیبهای میتوکندریایی همراه است که در روندهای پیری و بیماریهای نورودژنراتیو دیده میشود.
مقایسه کلی ویژگیها در یک جدول
|
فسفریلاسیون سوبسترا |
فسفریلاسیون اکسیداتیو |
ویژگی |
|
سیتوزول یا ماتریکس میتوکندری |
غشای داخلی میتوکندری |
مکان انجام |
|
ندارد |
دارد |
وابستگی به اکسیژن |
|
انتقال مستقیم فسفات |
استفاده از گرادیان پروتون |
مکانیزم تولید ATP |
|
کم (2 ATP) |
زیاد (حدود 34 ATP) |
میزان تولید ATP )گلوکز) |
|
سریع |
کندتر |
سرعت پاسخ دهی |
|
غالب در سرطان و هیپوکسی |
اختلال آن موجب ROS و پیری |
نقش در بیماریها |
جمعبندی تفاوتها
در یک نگاه کلی، فسفریلاسیون سوبسترا بهعنوان مسیر سریع اما کمبازده و فسفریلاسیون اکسیداتیو بهعنوان مسیر کند اما پربازده در فیزیولوژی سلولی تعریف میشوند. هر دو مسیر مکمل یکدیگر بوده و با توجه به شرایط اکسیژنی، میزان نیاز انرژی، نوع سلول و وضعیت متابولیکی انتخاب یا تنظیم میشوند.
کاربردهای بالینی فسفریلاسیون سوبسترا و اکسیداتیو در طب مدرن
درک عمیق از مسیرهای تولید انرژی در سلول، به ویژه دو مسیر اصلی فسفریلاسیون سوبسترا و فسفریلاسیون اکسیداتیو، نه تنها برای بیوشیمی سلولی اهمیت دارد، بلکه در بسیاری از کاربردهای بالینی مدرن نیز نقش حیاتی ایفا میکند. از بیماریهای متابولیکی گرفته تا درمان سرطان و اختلالات نورودژنراتیو، مسیرهای انرژی زایی بهعنوان هدف درمانی و تشخیصی مورد توجه قرار گرفتهاند.
کاربرد در تشخیص و درمان سرطان
سلولهای سرطانی تمایل دارند برای بقا و رشد سریع خود، به جای فسفریلاسیون اکسیداتیو، بیشتر از فسفریلاسیون سوبسترا استفاده کنند، حتی در حضور اکسیژن. این پدیده که به اثر واربورگ (Warburg effect) معروف است، نشان میدهد که سلولهای سرطانی با استفاده از گلیکولیز هوازی، ATP را سریعتر اما کمتر تولید میکنند.
این ویژگی بهعنوان یک نشانگر متابولیکی برای تشخیص سرطانها از طریق تصویربرداری PET )با استفاده از ردیابهایی مانند( FDG به کار میرود. همچنین، مهار مسیرهای گلیکولیتیک میتواند بهعنوان یک استراتژی درمانی هدفمند در برخی سرطانها مطرح باشد.
درمان بیماریهای میتوکندریایی و نورودژنراتیو
در بیماریهایی مانند پارکینسون، آلزایمر و اختلالات میتوکندریایی مادرزادی، عملکرد فسفریلاسیون اکسیداتیو دچار اختلال میشود. این اختلال منجر به کاهش تولید ATP، افزایش رادیکالهای آزاد و مرگ سلولی میگردد. در این شرایط، افزایش فعالیت فسفریلاسیون سوبسترا از طریق دریافت گلوکز یا کتونها ممکن است بهصورت جبرانی برای حفظ عملکرد سلولهای عصبی مؤثر واقع شود.
درمانهایی مانند کوآنزیم Q10، مهارکنندههای ROS، یا تحریک زیستی میتوکندری (bioenergetic modulation) نیز در حال بررسی بالینی هستند.
کاربرد در کنترل و پایش هیپوکسی و شوک
در شرایطی مانند شوک سپتیک، ایسکمی بافتی یا نارسایی ارگانها، سلولها دچار کاهش اکسیژن رسانی میشوند و ناچار به استفاده از فسفریلاسیون سوبسترا میگردند. افزایش سطح لاکتات خون در این بیماران بهعنوان یک نشانگر بیهوازی شدن متابولیسم شناخته میشود که از نظر بالینی برای تعیین شدت بیماری، پیشآگهی و پاسخ به درمان کاربرد دارد.
بهبود عملکرد میتوکندری در این بیماران با استفاده از داروهای محافظ میتوکندری یا اکسیژنتراپی هدفمند میتواند نتایج بالینی را بهبود دهد.
کاربرد در پزشکی ورزشی و تغذیه درمانی
در پزشکی ورزشی، شناخت تعادل میان فسفریلاسیون سوبسترا و اکسیداتیو برای طراحی برنامههای تمرینی و استراتژی تغذیهای ویژه (مانند کتوژنیک، بارگیری گلیکوژن، مکملسازی کراتین) ضروری است. ورزشکاران استقامتی تمایل دارند به سمت بهینه سازی فسفریلاسیون اکسیداتیو بروند، در حالی که ورزشکاران قدرتی یا انفجاری به فسفریلاسیون سوبسترا متکیترند.
همچنین، استفاده از مکملهایی مانند نیکوتینآمید ریبوزید یا PQQ برای ارتقای عملکرد میتوکندری در حال ورود به دنیای حرفهای ورزش است.
اهداف دارویی نوظهور
بسیاری از پژوهشهای دارویی بر پایه تنظیم این دو مسیر انرژیزا شکل گرفتهاند. بهعنوان مثال:
-
مهار آنزیمهای کلیدی گلیکولیز در سلولهای سرطانی
-
تقویت زنجیره انتقال الکترون در سلولهای عصبی
-
طراحی نانوذرات هدفمند انرژیزا یا تنظیم کننده متابولیسم
جمعبندی کاربردها در طب مدرن
در مجموع، فسفریلاسیون سوبسترا و اکسیداتیو نه تنها دو مسیر بیوشیمیایی هستند بلکه بهعنوان دو ستون تشخیصی، درمانی و مداخلهای در طب مدرن ایفای نقش میکنند. شناخت نحوه تعامل این دو مسیر در شرایط فیزیولوژیک و پاتولوژیک، میتواند افقهای نوینی را در پزشکی فردمحور، درمان سرطان، طب احیا و نورولوژی باز کند.
مکانیسمهای تنظیم فسفریلاسیون توسط پروتئینکینازها و فسفاتازها
فرآیند فسفریلاسیون یکی از مهمترین ابزارهای سلول برای تنظیم فعالیت آنزیمها، انتقال پیام، و هماهنگی عملکردهای بیوشیمیایی است. این فرآیند به وسیلهی دو گروه کلیدی از آنزیمها کنترل میشود: پروتئین کینازها (Protein Kinases) و پروتئین فسفاتازها (Protein Phosphatases). در این بخش، به تشریح عملکرد، تنوع، و سازوکار تنظیمی این دو گروه پرداخته میشود.
پروتئینکینازها؛ فعالسازی با افزودن فسفات
پروتئین کینازها گروهی از آنزیمها هستند که با استفاده از ATP، گروه فسفات را به باقیماندههای خاصی از اسیدهای آمینه (معمولاً سرین، ترئونین یا تیروزین) در ساختار پروتئینها منتقل میکنند. این تغییر باعث تغییر ساختار فضایی و عملکرد پروتئین میشود که ممکن است منجر به فعالسازی، غیرفعالسازی، یا تغییر مکان سلولی آن گردد.
از مهمترین کینازها میتوان به موارد زیر اشاره کرد:
-
AMPK : تنظیم کننده سطح انرژی سلولی
-
PI3K/AKT : تنظیم رشد و بقا در سلولهای انسانی
-
MAPKs : کنترل پاسخ به استرس، التهاب، و تقسیم سلولی
-
PKA، PKC، CaMK : نقش در سیگنالینگ وابسته به پیامبرهای ثانویه مانند cAMP و Ca²⁺
نکته مهم این است که بسیاری از کینازها خود نیز از طریق فسفریلاسیون توسط کینازهای دیگر فعال یا مهار میشوند، که منجر به شکل گیری شبکههای سیگنالینگ پیچیده درون سلول میگردد.
پروتئینفسفاتازها؛ بازگرداندن تعادل با حذف فسفات
در مقابل کینازها، پروتئین فسفاتازها گروههای فسفات را از پروتئینها حذف میکنند و به این ترتیب فعالیت آنها را بازتنظیم یا متوقف میسازند. این آنزیمها نقش مهمی در خاموشکردن سیگنالهای فعال شده و جلوگیری از پاسخ بیشازحد ایفا میکنند.
فسفاتازها نیز انواع مختلفی دارند، از جمله:
-
PP1 و PP2A : نقش در کنترل متابولیسم، چرخه سلولی، و حافظت نورونی
-
PTEN : فسفاتاز مهم در مهار سیگنال رشد (با مهار PI3K/AKT)
-
Calcineurin : فسفاتاز وابسته به کلسیم در سیستم ایمنی و نورونها
تعادل بین فعالیت کینازها و فسفاتازها، یک سوئیچ بیوشیمیایی ظریف و ضروری برای سلامت سلولها است. اختلال در این تعادل میتواند منجر به سرطان، مقاومت انسولینی، بیماریهای خودایمنی و اختلالات عصبی شود.
مکانیسمهای تنظیمی کینازها و فسفاتازها
فعالیت این آنزیمها خود نیز بهطور دقیق تنظیم میشود، از جمله:
-
فسفریلاسیون یا دفسفریلاسیون توسط آنزیمهای دیگر
-
اتصال به زیرواحدهای تنظیمی یا کمپلکسهای چندپروتئینی
-
تغییرات غلظت یونهای ثانویه مانند کلسیم، منیزیم یا AMP
-
محل زیرسلولی یا انتقال بین هسته و سیتوپلاسم
-
بازخورد مثبت یا منفی ناشی از مسیرهای سیگنالینگ متقاطع
برای مثال، AMPK تنها در شرایط کاهش انرژی (نسبت AMP/ATP بالا) فعال میشود و باعث تحریک مسیرهای تولید ATP و مهار مسیرهای مصرف انرژی میگردد.
نقش در بیماری و اهداف درمانی
بسیاری از داروهای مدرن هدف خود را بر اساس مهار یا فعالسازی کینازها یا فسفاتازها قرار دادهاند:
-
مهارکنندههای تیروزینکینازها در درمان سرطانها (مانند Imatinib برای لوسمی)
-
مهارکنندههای mTOR در پیوند عضو و سرطان
-
تنظیمکنندههای فسفاتازهای نورونی برای درمان آلزایمر
همچنین، درک سازوکار دقیق تنظیم فسفریلاسیون برای طراحی واکسنهای جدید، کنترل التهاب و مهار مسیرهای خودایمنی در بیماریهایی مانند لوپوس یا اماس اهمیت دارد.
در نهایت، فسفریلاسیون بهعنوان یک سیستم کلیدی سوئیچینگ سلولی، وابسته به تعادل پویا بین کینازها و فسفاتازهاست. هرگونه اختلال در این مسیرها میتواند عواقب شدید پاتولوژیک داشته باشد. درک دقیق مکانیسمهای تنظیمی این آنزیمها، راه را برای پیشرفتهای جدید در پزشکی فردمحور، درمان سرطان، نورولوژی و ایمونولوژی باز کرده است.
فسفریلاسیون و تنظیم انرژی در سلولهای عضلانی و عصبی
فسفریلاسیون بهعنوان یکی از حیاتیترین فرآیندهای زیستی در تنظیم متابولیسم و تولید انرژی، نقش محوری در عملکرد سلولهای عضلانی و عصبی ایفا میکند. این سلولها به دلیل فعالیت متابولیکی شدید و نیاز مداوم به ATP، وابستگی بالایی به مسیرهای دقیق و زمان بندی شدهی فسفریلاسیون دارند.
فسفریلاسیون در سلولهای عضلانی؛ پاسخ سریع به تقاضای انرژی
سلولهای عضلانی به ویژه در هنگام فعالیت بدنی، بهطور لحظهای به افزایش تولید ATP نیاز دارند. در این شرایط، فسفریلاسیون از دو طریق اصلی به تأمین این انرژی کمک میکند:
-
فسفریلاسیون سوبسترا : در آغاز فعالیت عضلانی، مسیرهایی مانند گلیکولیز بیهوازی با استفاده از آنزیمهایی چون فسفوگلیسرات کیناز و پیروات کیناز، ATP را به سرعت و بدون نیاز به اکسیژن تولید میکنند. این مکانیسم به عضله امکان میدهد انرژی اولیه خود را در شرایط هیپوکسی (کمبود اکسیژن) تأمین کند.
-
فسفریلاسیون اکسیداتیو : در ادامه فعالیت، با افزایش جریان خون و اکسیژن رسانی، میتوکندریهای عضلانی وارد عمل میشوند و از طریق زنجیره انتقال الکترون و آنزیمهایی مانند ATP سنتاز، بخش عمده ATP را تولید میکنند. این مسیر اگرچه کندتر است، اما بسیار کارآمدتر و پایدارتر میباشد.
نکته مهم آن است که تنظیم این دو مسیر عمدتاً از طریق فسفریلاسیون آنزیمهای کلیدی و فعالسازی کینازهایی چون AMPK و CaMK انجام میگیرد که به وضعیت انرژی و سطح کلسیم حساساند.
فسفریلاسیون در سلولهای عصبی؛ پایداری عملکرد سیناپسی و حافظه
سلولهای عصبی یا نورونها برای حفظ پتانسیل غشایی، بازسازی نوروترنسمیترها، و فعالیت سیناپسی به سطح بالایی از انرژی نیاز دارند. از آنجا که نورونها توانایی گلیکولیز بیهوازی مؤثر را ندارند، تقریباً تمام ATP آنها از فسفریلاسیون اکسیداتیو در میتوکندری حاصل میشود.
در نورونها، فسفریلاسیون به ویژه برای موارد زیر حیاتی است:
-
فسفریلاسیون پروتئینهای سیناپسی مانند Synapsin-I که در آزادسازی نوروترنسمیترها نقش دارد.
-
تنظیم فسفریلاسیون Tau؛ اختلال در آن با بیماریهایی چون آلزایمر مرتبط است.
-
فعالسازی مسیرهای سیگنالینگ حافظه از طریق MAPK و CREB که برای تثبیت حافظه بلند مدت ضروری هستند.
علاوه بر این، آنزیمهای حسگر انرژی مانند AMPK در شرایط استرس متابولیک نورونی (مانند گرسنگی یا ایسکمی) فعال شده و با فسفریله کردن مسیرهای کاهنده مصرف انرژی یا افزایش بقای سلولی، به محافظت عصبی کمک میکنند.
تنظیم دوگانه توسط کینازها و فسفاتازها
در هر دو نوع سلول عضلانی و عصبی، تنظیم مسیرهای فسفریلاسیون از طریق شبکههای پیچیدهی آنزیمی صورت میگیرد. برای مثال:
-
در عضله، بیماریهایی چون دیستروفی عضلانی با اختلال در فسفریلاسیون پروتئینهای ساختاری مانند Dystrophin همراهاند.
-
در نورونها، تغییر در تعادل فسفریلاسیون/دفسفریلاسیون Tau توسط کینازهایی مثل GSK-3β و فسفاتازهایی مانند PP2A میتواند به تجمع پروتئینهای پاتولوژیک و تخریب نورونی بینجامد.
سلولهای عضلانی و عصبی بهعنوان دو بافت پرمصرف انرژی، بهطور خاص به تنظیم دقیق فسفریلاسیون برای بقا و عملکرد وابستهاند. درک عمیقتر از این تنظیمات نه تنها به روشنشدن مکانیسم بیماریهای متابولیک و نورولوژیک کمک میکند، بلکه زمینهای برای طراحی درمانهای هدفمند در طب ورزشی، عصب پژوهی، و بازتوانی فراهم میسازد.
اثر پیری و استرس اکسیداتیو بر فسفریلاسیون اکسیداتیو
فرآیند فسفریلاسیون اکسیداتیو بهعنوان مکانیسم اصلی تولید ATP در میتوکندری، در طول حیات سلول تحت تأثیر عوامل متعددی قرار میگیرد. پیری و استرس اکسیداتیو دو فاکتور کلیدی هستند که با تغییرات ساختاری و عملکردی در میتوکندری، اثربخشی این مسیر حیاتی را کاهش میدهند و در بروز بسیاری از بیماریهای وابسته به سن، از جمله اختلالات نورودژنراتیو، بیماریهای متابولیک و قلبیعروقی، نقش دارند.
کاهش کارایی فسفریلاسیون اکسیداتیو با افزایش سن
با افزایش سن، ساختار و عملکرد میتوکندری در بسیاری از سلولهای بدن دچار تغییر میشود. مطالعات نشان دادهاند که در سلولهای پیر:
-
فعالیت کمپلکسهای زنجیره انتقال الکترون (بهویژه کمپلکس I و IV) کاهش مییابد.
-
تولید ATP کاهش و در مقابل تولید گونههای فعال اکسیژن (ROS) افزایش پیدا میکند.
-
کاهش بیوژنز میتوکندریایی و از بین رفتن تعادل در دینامیک میتوکندری (اتصال و شکافت) رخ میدهد.
این تغییرات باعث کاهش توانایی سلول در پاسخ به نیازهای متابولیکی میشوند و زمینه را برای بروز بیماریهای وابسته به افزایش سن فراهم میکنند.
استرس اکسیداتیو؛ عامل تسریعکننده اختلال در فسفریلاسیون اکسیداتیو
استرس اکسیداتیو زمانی ایجاد میشود که تولید ROS از ظرفیت آنتیاکسیدانی سلول فراتر رود. در چنین شرایطی:
-
ROS به ترکیبات زنجیره تنفسی آسیب میزند، به ویژه لیپیدهای غشایی و پروتئینهای کمپلکسها.
-
ATP سنتاز و سایر اجزای سیستم فسفریلاسیون دچار اکسیداسیون شده و فعالیتشان مختل میشود.
-
آسیب به DNA میتوکندری باعث کاهش سنتز پروتئینهای ضروری و در نهایت اختلال در تولید انرژی میگردد.
چرخهای معیوب شکل میگیرد که در آن اختلال در زنجیره انتقال الکترون منجر به افزایش ROS و افزایش ROS منجر به آسیب بیشتر به زنجیره انتقال الکترون میشود.
نقش پیری و استرس اکسیداتیو در بیماریهای مرتبط با میتوکندری
در بسیاری از بیماریهای مرتبط با افزایش سن، از جمله:
-
بیماری آلزایمر و پارکینسون
-
کاردیومیوپاتیها
-
دیابت نوع ۲
شواهدی از کاهش فعالیت فسفریلاسیون اکسیداتیو و افزایش استرس اکسیداتیو وجود دارد. در این بیماریها، بافتها توانایی پاسخ به استرس متابولیک را از دست داده و دچار تحلیل انرژی میشوند.
راهبردهای مقابله با پیری میتوکندریایی و استرس اکسیداتیو
در سالهای اخیر، راهکارهایی برای حفظ عملکرد فسفریلاسیون اکسیداتیو در شرایط پیری و استرس اکسیداتیو پیشنهاد شدهاند:
-
استفاده از آنتیاکسیدانهای هدفمند میتوکندری مانند MitoQ
-
فعالسازی بیوژنز میتوکندری از طریق مسیر PGC-1α
-
مداخلات تغذیهای مانند محدودیت کالری، تمرین ورزشی منظم و مصرف ترکیباتی نظیر رسوراترول یا NAD+ پیشسازها (مثل NMN)
-
استفاده از میتوفاژی القاشده برای حذف میتوکندریهای آسیبدیده
پیری و استرس اکسیداتیو از عوامل اصلی تضعیف عملکرد فسفریلاسیون اکسیداتیو در سلولها هستند. این تضعیف نه تنها باعث افت کارایی متابولیک میشود، بلکه با آغاز زنجیرهای از آسیبهای سلولی، روند پیری و بیماریهای مرتبط را تشدید میکند. درک دقیق مکانیسمهای دخیل در این فرآیند، راه را برای توسعه درمانهای هدفمند ضدپیری و حفظ سلامت میتوکندری هموار میسازد.
جمعبندی و پاسخ به سوالات پرتکرار متخصصان
در این مقاله تلاش شد تا تصویری جامع از دو مسیر کلیدی تولید انرژی در سلولهای انسانی یعنی فسفریلاسیون سوبسترا و فسفریلاسیون اکسیداتیو ارائه شود. این دو مسیر که به ظاهر مکمل هم هستند، در واقع با مکانیزمهای متفاوت، اهداف و کاراییهای متفاوتی عمل میکنند و بسته به شرایط سلولی و بافتی، نقشهای حیاتی ایفا مینمایند. شناخت عمیق این مسیرها، چه در سطح پایه و چه در کاربردهای بالینی، برای پژوهشگران، متخصصان تغذیه، پزشکی و زیست فناوری اهمیت بسیاری دارد.
جمعبندی کلیدی
-
فسفریلاسیون سوبسترا در شرایط کم اکسیژن و در بخشهایی از گلیکولیز و چرخه کربس رخ میدهد و ATP را مستقیماً با انتقال گروه فسفات از یک متابولیت به ADP تولید میکند.
-
فسفریلاسیون اکسیداتیو در میتوکندری و تحت حضور اکسیژن انجام میشود و بیشترین مقدار ATP در بدن انسان را فراهم میآورد.
-
تنظیم این مسیرها از طریق پروتئینکینازها و فسفاتازها، تغییرات محیطی، استرس اکسیداتیو و شرایط متابولیکی انجام میپذیرد.
-
در سلولهای عصبی و عضلانی، انتخاب بین این دو مسیر نقش کلیدی در عملکرد و پایداری انرژی دارد.
-
پیری و استرس اکسیداتیو مستقیماً بر فسفریلاسیون اکسیداتیو اثر گذاشته و آن را دچار اختلال میکنند که این خود در بیماریهای نورودژنراتیو و متابولیک قابل مشاهده است.
پاسخ به سوالات پرتکرار متخصصان
چرا فسفریلاسیون اکسیداتیو بسیار مؤثرتر از فسفریلاسیون سوبسترا است؟
زیرا در فسفریلاسیون اکسیداتیو، هر مولکول گلوکز منجر به تولید حدود 30-32 مول ATP میشود، در حالی که فسفریلاسیون سوبسترا تنها حدود 2 مول ATP در هر مول گلوکز تولید میکند. همچنین زنجیره انتقال الکترون و گرادیان پروتون در میتوکندری باعث افزایش بازدهی انرژی میشود.
در چه شرایطی بدن بیشتر به فسفریلاسیون سوبسترا وابسته میشود؟
در شرایط هیپوکسی (کمبود اکسیژن)، فعالیتهای ورزشی سنگین، یا در سلولهای فاقد میتوکندری مانند گلبولهای قرمز، بدن از فسفریلاسیون سوبسترا برای تولید سریع ATP استفاده میکند. همچنین در بسیاری از تومورها، حتی در حضور اکسیژن، این مسیر فعال است که به عنوان اثر واربورگ شناخته میشود.
آیا میتوان از تقویت فسفریلاسیون اکسیداتیو به عنوان راهی برای افزایش طول عمر استفاده کرد؟
شواهد اولیه از مدلهای حیوانی و مطالعات سلولی حاکی از آن است که افزایش عملکرد میتوکندری، بهویژه از طریق بهبود فسفریلاسیون اکسیداتیو، ممکن است به کاهش استرس اکسیداتیو، بهبود متابولیسم و افزایش طول عمر سلول کمک کند. اما همچنان مطالعات انسانی بیشتری برای تایید این موضوع نیاز است.
چه عواملی میتوانند فسفریلاسیون اکسیداتیو را مختل کنند؟
-
آسیبهای میتوکندریایی به دلیل افزایش ROS
-
کمبود اکسیژن
-
مسمومیتهای دارویی یا محیطی (مثل سیانید که کمپلکس IV را مهار میکند).
-
جهشهای ژنتیکی در DNA میتوکندری
-
التهاب مزمن و بیماریهای متابولیک
چه داروها یا مکملهایی بر تقویت این مسیر مؤثرند؟
-
کوآنزیم Q10 ، رسوراترول، NAD+ پیشسازها )مانند NMN و NR) ، PQQ، و آنتیاکسیدانهای هدفمند میتوکندری مانند MitoQ یا SkQ1
-
داروهای افزاینده بیوژنز میتوکندری مانند فعالکنندههای PGC-1α نیز به طور بالقوه نقش دارند.
نتیجهگیری نهایی
درک تفاوتها و نقشهای مکمل فسفریلاسیون سوبسترا و اکسیداتیو، نه تنها به فهم بهتر متابولیسم انسانی کمک میکند، بلکه در توسعه راهکارهای درمانی جدید برای بیماریهای مزمن و پیری نیز مؤثر خواهد بود. با پیشرفت دانش زیستی و ابزارهای مداخلهای هدفمند، میتوان امیدوار بود که در آینده نزدیک، این مسیرها به صورت دقیقتر تنظیم و بهینه سازی شوند.