چرخه کربس (TCA) به زبان ساده؛ مراحل، آنزیمها و محصولات
چرخه کربس چیست و چرا برای بدن انسان حیاتی است؟
چرخه کربس یا چرخه اسید سیتریک که گاهی به آن چرخه TCA نیز گفته میشود، یکی از بنیادیترین مسیرهای متابولیک در بدن موجودات زنده هوازی است. این چرخه نقش کلیدی در تولید انرژی سلولی ایفا میکند و نقطه تلاقی بسیاری از مسیرهای متابولیکی مهم بدن مانند گلیکولیز، فسفوریلاسیون اکسیداتیو، و مسیرهای مرتبط با متابولیسم چربی و پروتئین محسوب میشود.
اهمیت این چرخه تنها به تولید ATP محدود نمیشود، بلکه واسطههای تولیدشده در این چرخه—از جمله آلفاکتوگلوتارات، سوکسینات، فومارات و سیتریک اسید—دارای نقشهای سیگنالینگ در فرایندهایی مانند تنظیم ایمنی، پیری سلولی، اپیژنتیک، و حتی سرطان هستند.
از آنجا که اختلال در عملکرد چرخه کربس میتواند منجر به بیماریهای مزمن، تومورزایی، و نارساییهای متابولیکی شود، درک ساختار، مراحل و نقشهای گسترده این چرخه برای پژوهشگران و پزشکان بسیار ضروری است.
در این مقاله، مروری جامع، عمیق و مبتنی بر جدیدترین یافتههای علمی بر روی چرخه کربس خواهیم داشت؛ از ساختار و عملکرد آن تا نقشهای پیچیده متابولیتهایش در سلامت و بیماری.
تعریف و تاریخچه چرخه کربس
مروری بر تاریخچه و مفهوم علمی چرخه کربس
چرخه کربس (Krebs Cycle)، که با نامهای دیگری همچون «چرخه اسید سیتریک» یا «چرخه تریکربوکسیلیک اسید (TCA)» نیز شناخته میشود، مسیری بیوشیمیایی در میتوکندری سلولهای یوکاریوتی است که طی آن ترکیبات حاصل از گلوکز، اسیدهای چرب و اسیدهای آمینه به محصولات نهایی متابولیسمی مانند دیاکسید کربن (CO₂)، NADH و FADH₂ تبدیل میشوند. این محصولات در نهایت در مسیر زنجیره انتقال الکترون شرکت کرده و موجب تولید ATP میگردند.
تاریخچه کشف
این چرخه برای نخستین بار توسط دانشمند آلمانی، سر هانس آدولف کربس (Hans Adolf Krebs)، در سال ۱۹۳۷ میلادی توصیف شد. وی توانست با بررسی دقیق واکنشهای شیمیایی در سلولهای کبدی مشخص کند که چگونه اسیدهای آلی با یک الگوی حلقوی متابولیزه میشوند. کشف او، که بعدها جایزه نوبل فیزیولوژی و پزشکی در سال ۱۹۵۳ را به همراه داشت، به عنوان یکی از بزرگترین اکتشافات در زمینه بیوشیمی متابولیک شناخته میشود.
علت نامگذاریهای مختلف
-
چرخه کربس: به احترام کاشف آن، هانس کربس.
-
چرخه اسید سیتریک: چون اولین ترکیب پایدار تشکیلشده در چرخه، اسید سیتریک است.
-
چرخه تریکربوکسیلیک اسید (TCA) : به دلیل حضور ترکیبات دارای سه گروه کربوکسیلیک مانند سیتریک اسید و ایزو-سیتریک اسید.
اهمیت تاریخی چرخه کربس
کشف چرخه کربس نقطه عطفی در درک مکانیزمهای انرژیزایی سلولی بود. این کشف توانست پایهگذار دانش نوین در بیوشیمی، فیزیولوژی سلولی، و متابولیسم شود و تأثیرات گستردهای بر حوزههای پزشکی، داروسازی، و بیوتکنولوژی داشته باشد.
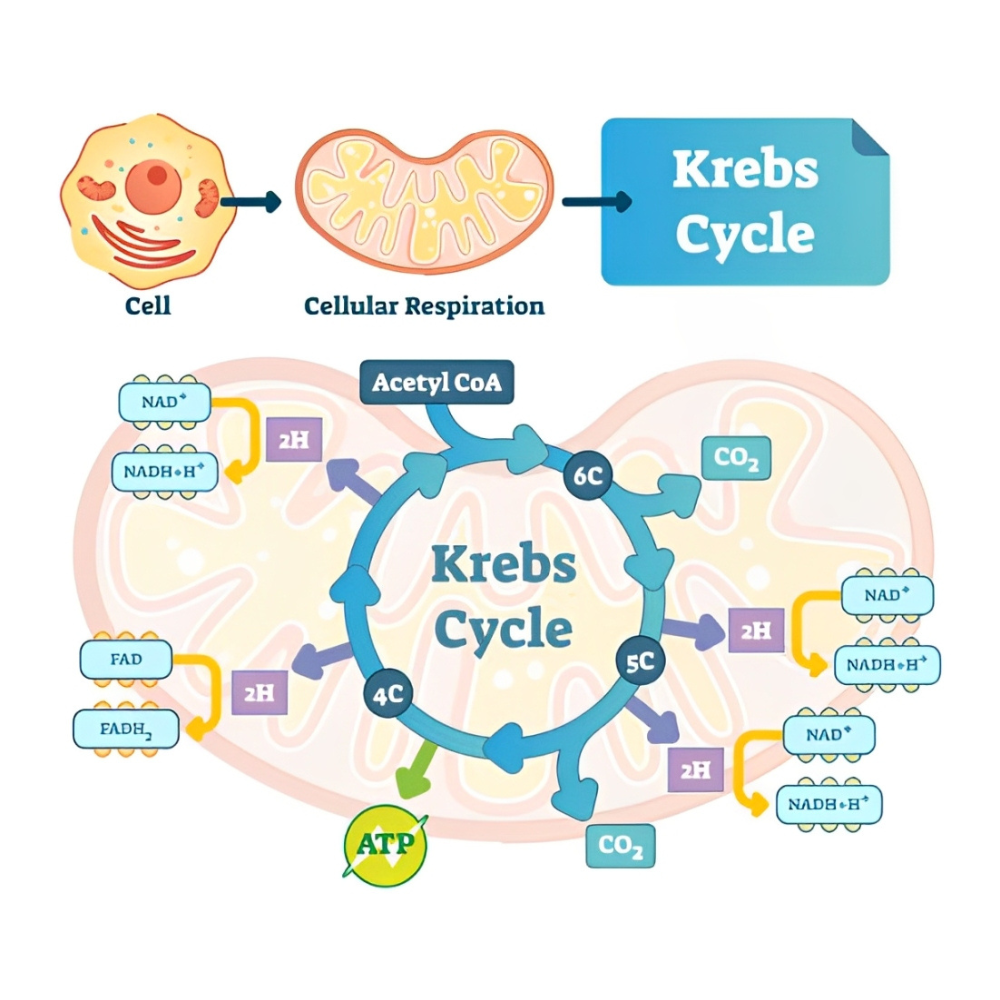
مراحل شیمیایی چرخه کربس – گام به گام با واکنشها
مراحل چرخه کربس: واکنشهای شیمیایی و آنزیمهای کلیدی
چرخه کربس شامل ۸ مرحله آنزیمی است که درون ماتریکس میتوکندری رخ میدهد. این واکنشها با ورود استیلکوآ (Acetyl-CoA) به چرخه آغاز میشوند و در نهایت موجب بازسازی مولکول اولیه (اگزالواستات) میگردند. در ادامه، هر مرحله را به صورت دقیق معرفی میکنیم:
مرحله ۱: ترکیب استیلکوآ با اگزالواستات
-
واکنش: Acetyl-CoA + Oxaloacetate → Citrate
-
آنزیم: سیترات سنتاز (Citrate Synthase)
-
توضیح : ترکیب دو کربنهی استیلکوآ با چهارکربنهی اگزالواستات منجر به تولید ششکربنهی سیترات میشود.
مرحله ۲: ایزومریزاسیون سیترات به ایزو-سیترات
-
واکنش: Citrate → Isocitrate
-
آنزیم: آکونیتاز (Aconitase)
-
توضیح: طی یک واکنش برگشتپذیر، سیترات به ایزو-سیترات تبدیل میشود تا برای واکنشهای اکسیداتیو آماده شود.
مرحله ۳: دکربوکسیلاسیون اکسیداتیو ایزو-سیترات
-
واکنش Isocitrate → α-Ketoglutarate + CO₂ + NAD :
-
آنزیم : ایزو-سیترات دهیدروژناز (Isocitrate Dehydrogenase)
-
توضیح: این مرحله اولین مرحلهای است که طی آن CO₂ و یک مولکول NADH تولید میشود.
مرحله ۴: تبدیل α-Ketoglutarate به سوکسینیلکوآ
-
واکنش : α-Ketoglutarate → Succinyl-CoA + CO₂ + NADH
-
آنزیم: α-Ketoglutarate Dehydrogenase
-
توضیح : دومین دکربوکسیلاسیون رخ میدهد و دومین NADH به همراه یک CO₂ دیگر آزاد میشود.
مرحله ۵: تولید ATP یا GTP از سوکسینیلکوآ
-
واکنش: Succinyl-CoA → Succinate + ATP/ GTP
-
آنزیم: سوکسینیلکوآ سنتتاز (Succinyl-CoA Synthetase)
-
توضیح: این واکنش تنها مرحلهای در چرخه است که ATP (در کبد GTP) مستقیماً تولید میشود.
مرحله ۶: تبدیل سوکسینات به فومارات
-
واکنش : Succinate → Fumarate + FADH₂
-
آنزیم : سوکسینات دهیدروژناز (Succinate Dehydrogenase)
-
توضیح: FAD به عنوان کوآنزیم کاهش مییابد و FADH₂ تولید میشود که وارد زنجیره انتقال الکترون میگردد.
مرحله ۷: هیدراسیون فومارات
-
واکنش : Fumarate → Malate
-
آنزیم : فوماراز (Fumarase)
-
توضیح: آب به فومارات افزوده میشود تا مالات ایجاد شود.
مرحله ۸: اکسیداسیون مالات به اگزالواستات
-
واکنش : Malate → Oxaloacetate + NADH
-
آنزیم : مالات دهیدروژناز (Malate Dehydrogenase)
-
توضیح : این مرحله آخرین NADH را تولید کرده و چرخه را برای شروع مجدد آماده میکند.
جمعبندی: محصول نهایی چرخه کربس برای هر مولکول گلوکز
از آنجا که هر مولکول گلوکز دو مولکول استیلکوآ تولید میکند، در نتیجه:
-
۶ NADH
-
۲ FADH₂
-
۲ ATP/GTP
-
۴ CO₂
تولید میشود.
نقش چرخه کربس در تولید انرژی و ارتباط با فسفوریلاسیون اکسیداتیو
ارتباط چرخه کربس با زنجیره تنفسی و تولید ATP
یکی از اهداف اصلی چرخه کربس، تولید حاملهای الکترونی پرانرژی یعنی NADH و FADH₂ است. این حاملها نقش کلیدی در تأمین انرژی سلول دارند، زیرا وارد زنجیره انتقال الکترون (Electron Transport Chain) در غشای داخلی میتوکندری میشوند و زمینه را برای فسفوریلاسیون اکسیداتیو (Oxidative Phosphorylation) و تولید مولکولهای ATP فراهم میکنند.
تولید NADH و FADH₂ : سوخت زنجیره تنفسی
در هر دور از چرخه کربس (برای یک مولکول استیلکوآ)، موارد زیر تولید میشوند:
-
۳ مولکول NADH در مراحل ۳، ۴ و ۸
-
۱ مولکول FADH₂ در مرحله ۶
-
۱ مولکول GTP یا ATP
این حاملها سپس به زنجیره تنفسی منتقل میشوند تا با اکسید شدن در کمپلکسهای تنفسی، پروتونها (H⁺) را از ماتریکس به فضای بینغشایی پمپ کنند. این گرادیان پروتون مبنای تولید ATP توسط آنزیم ATP سنتتاز است.
واکنشهای زنجیره انتقال الکترون
-
NADH الکترونهای خود را به Complex I (NADH Dehydrogenase) تحویل میدهد.
-
FADH₂ در Complex II (Succinate Dehydrogenase) اکسید میشود.
-
الکترونها از طریق کوآنزیم Q و سیتوکروم c بین کمپلکسها منتقل میشوند.
-
در نهایت، در Complex IV (Cytochrome c Oxidase)، اکسیژن مولکولی بهعنوان گیرنده نهایی الکترونها عمل کرده و آب (H₂O) تولید میشود.
فسفوریلاسیون اکسیداتیوتولید ATP:
در نتیجه گرادیان پروتون ایجاد شده:
-
پروتونها از طریق آنزیم ATP سنتتاز (Complex V) به ماتریکس بازمیگردند.
-
این جریان پروتون منجر به چرخش مکانیکی و در نهایت تولید ATP از ADP و Pi میشود.
✅ به ازای هر NADH : حدود ۲.۵ ATP
✅ به ازای هر FADH₂ : حدود ۱.۵ ATP
جمعبندی انرژی از یک گلوکز (شامل چرخه کربس + زنجیره تنفسی)
با توجه به اینکه هر گلوکز ۲ استیلکوآ تولید میکند، مجموع تولید ATP به شرح زیر است:
|
مرحله |
NADH |
FADH₂ |
GTP/ATP |
معادل ATP |
|
چرخه کربس (۲ دور) |
6 |
2 |
2 |
6×2.5 + 2×1.5 + 2 = 20 ATP |
❗ لازم به ذکر است که این مقدار تنها از چرخه کربس و زنجیره تنفسی بهدست میآید و تولید ATP از گلیکولیز و اکسیداسیون پیرووات جداگانه محاسبه میشود.
اهمیت چرخه کربس در متابولیسم کل بدن
چرخه کربس نهتنها در تولید انرژی مؤثر است بلکه:
-
در تنظیم متابولیسم چربیها و اسیدهای آمینه نقش دارد.
-
با سیگنالدهی سلولی، تنظیم پاسخهای ایمنی و اپیژنتیک در ارتباط است (که در بخشهای بعدی توضیح داده میشود).
نقش چرخه کربس در مسیرهای آنابولیک و سنتز بیومولکولها
نقش چرخه کربس در ساخت مولکولهای ضروری و آنابولیسم سلولی
اگرچه چرخه کربس به طور سنتی به عنوان مسیر کاتابولیک شناخته میشود که در آن مولکولها برای تولید انرژی تجزیه میشوند، اما یکی از جنبههای مهم و کمتر توجهشدهی آن، نقش حیاتی در فرآیندهای آنابولیک (سنتزی) است. چرخه کربس تأمینکنندهی پیشسازهای بسیاری از بیومولکولها است که برای رشد، ترمیم و عملکرد سلولی حیاتیاند.
پیشسازهای بیوسنتزی چرخه کربس
در طول چرخه، تعدادی از متابولیتهای میانی به عنوان مواد خام برای سنتز ترکیبات مهم سلولی استفاده میشوند:
-
-
آلفا-کتوگلوتارات (α-Ketoglutarate)
-
-
نقش: پیشساز اصلی گلوتامات، که خود منبع بسیاری از اسیدهای آمینه ازجمله پرولین، گلوتامین، آرژنین و سایر نوکلئوتیدهاست.
-
اهمیت بالینی: در شرایطی مانند رشد تومورها یا بازسازی بافت، نیاز به گلوتامین و گلوتامات بسیار افزایش مییابد.
-
. سوکسینیلکوآ (Succinyl-CoA)
-
-
نقش: در سنتز پورفیرینها و در نهایت تولید هم (Heme) که جزء حیاتی هموگلوبین، میوگلوبین و آنزیمهای سیتوکروم است.
-
کاربرد در پزشکی: اختلالات در تولید سوکسینیلکوآ میتواند به آنمی و بیماریهای متابولیک مرتبط باشد.
-
اگزالواستات (Oxaloacetate)
-
-
نقش: تبدیل به آسپارتات، که پایهای برای سنتز اسیدهای آمینه، پورینها و پیریمیدینها است.
-
مسیر جانبی: آسپارتات همچنین میتواند وارد مسیر چرخه اوره شود.
-
سیترات (Citrate)
-
-
نقش دوگانه:
-
در میتوکندری: ادامه چرخه کربس
-
در سیتوزول: منبع تولید استیلکوآ برای سنتز اسیدهای چرب، کلسترول و استروئیدها
-
-
سیترات توسط ناقلهای خاص از میتوکندری به سیتوزول منتقل میشود و تحت تأثیر آنزیم ATP-citrate lyase به استیلکوآ و اگزالواستات تجزیه میشود.
مشارکت در مسیرهای آنابولیک اصلی
|
ترکیب میانی |
بیومولکول هدف |
اهمیت زیستی |
|
α-Ketoglutarate |
گلوتامات، نوکلئوتیدها |
رشد و تقسیم سلولی |
|
Succinyl-CoA |
پورفیرین، هم |
تنفس سلولی، خونرسانی |
|
Oxaloacetate |
آسپارتات، نوکلئوتیدها |
پروتئینسازی، چرخه اوره |
|
Citrate |
اسیدهای چرب، کلسترول |
غشای سلولی، هورمونسازی |
عملکرد آمفیبولیک چرخه کربس
به دلیل ایفای نقش همزمان در فرآیندهای کاتابولیک (تجزیه) و آنابولیک (سنتز)، چرخه کربس را یک مسیر آمفیبولیک (Amphibolic) مینامند.
این ویژگی موجب میشود:
-
سلولها بسته به نیاز متابولیک، بتوانند مسیر چرخه را به سمت تولید انرژی یا سنتز بیومولکولها هدایت کنند.
-
تنظیمات ظریفی از طریق آنزیمها و سیگنالهای متابولیکی انجام شود تا تعادل بین ساخت و تجزیه حفظ گردد.
آناپلروتیک (Anaplerotic) و کاتاپلروتیک (Cataplerotic)
برای حفظ عملکرد بهینه چرخه:
-
مسیرهای آناپلروتیک، متابولیتهایی را برای جایگزینی ترکیبات خروجی فراهم میکنند (مثلاً تبدیل پیرووات به اگزالواستات توسط پیرووات کربوکسیلاز).
-
مسیرهای کاتاپلروتیک، ترکیبات را از چرخه خارج کرده و وارد مسیرهای بیوسنتزی میکنند.
تنظیم چرخه کربس در بدن – از سلامت تا بیماری
چگونه چرخه کربس تنظیم میشود؟ نقش آنزیمها، متابولیتها و بیماریها
یکی از مهمترین ویژگیهای چرخه کربس، توانایی آن در تنظیم انعطافپذیر عملکرد خود بر اساس شرایط متابولیکی سلول است. این تنظیمات دقیق به سلول اجازه میدهند تا بین نیاز به انرژی، تولید پیشسازهای بیوسنتزی و پاسخ به استرسها تعادل ایجاد کند.
تنظیم آنزیمی چرخه کربس
سه آنزیم اصلی در چرخه کربس به عنوان نقاط کلیدی تنظیم شناخته میشوند:
-
-
سیترات سنتاز (Citrate Synthase)
-
-
نقطه شروع چرخه: ترکیب استیلکوآ با اگزالواستات
-
تنظیم: با غلظت سیترات و سطوح NADH مهار میشود
-
ایزوسیترات دهیدروژناز (Isocitrate Dehydrogenase)
-
-
نقش کلیدی در تولید NADH و CO₂
-
تنظیم مثبت : ADP، کلسیم
-
تنظیم منفی : ATP، NADH
-
آلفا-کتوگلوتارات دهیدروژناز
-
-
تولید NADH و CO₂ از آلفا-کتوگلوتارات
-
تنظیم منفی: NADH، سوکسینیلکوآ
-
تنظیم مثبت : کلسیم
✅ کلسیم در عضلات فعال، نقش تحریککننده بر چرخه کربس دارد که باعث افزایش تولید ATP همزمان با انقباض عضلانی میشود.
بازخورد از متابولیتها و انرژی
چرخه کربس تحت تأثیر میزان انرژی سلول قرار دارد:
|
وضعیت انرژی |
پیامد |
اثر بر چرخه کربس |
|
ATP بالا |
انرژی کافی |
مهار آنزیمها (کاهش فعالیت چرخه) |
|
ADP/AMP بالا |
نیاز به انرژی |
فعالسازی آنزیمها (افزایش فعالیت چرخه) |
|
NADH بالا |
انرژی زیاد تولید شده |
مهار دهیدروژنازها |
|
NAD⁺ بالا |
نیاز به اکسیداسیون |
تحریک چرخه |
نقش سیگنالهای هورمونی
در بافتهای خاص، هورمونها تنظیمکنندهی غیرمستقیم چرخه هستند:
-
انسولین: با افزایش سنتز گلوکز و تحریک گلیکولیز، استیلکوآ بیشتری تولید میکند که وارد چرخه میشود.
-
گلوکاگون و اپینفرین: با فعالسازی β-اکسیداسیون و افزایش NADH، چرخه را مهار میکنند تا مصرف انرژی محدود شود.
تنظیم در شرایط پاتولوژیک
-
سرطان
سلولهای سرطانی با تغییر در متابولیسم خود، چرخه کربس را بازبرنامهریزی میکنند:
-
وابستگی به گلوتامینولیز و ورود α-KG به چرخه
-
تغییر عملکرد ایزوسیترات دهیدروژناز (IDH) و تولید متابولیتهای جهشیافته مانند 2-هیدروکسیگلوتارات (2-HG)
-
دیابت و مقاومت به انسولین
-
اختلال در ورود گلوکز به چرخه باعث کاهش مصرف استیلکوآ و افزایش اسیدهای چرب آزاد میشود که متابولیسم را به سمت بتا اکسیداسیون سوق میدهد.
-
بیماریهای میتوکندریایی
-
اختلالات ژنتیکی آنزیمهای چرخه کربس (مانند سندرم لی و سندرم MELAS) منجر به تجمع متابولیتها و کاهش تولید ATP میشود.
آنزیمهای جهشیافته و سرطان
تحقیقات جدید نشان دادهاند که جهش در ژنهای IDH1/2 در برخی سرطانها (از جمله گلیوما و لوسمی) باعث تولید متابولیت آنومال 2 -HG میشود که:
-
باعث مهار دیاکسیژنازهای وابسته به آلفا-کتوگلوتارات میشود.
-
منجر به تغییرات اپیژنتیکی، توقف تمایز سلولی و افزایش تومورزایی میشود.
نقش چرخه کربس در تنظیم پاسخ ایمنی و التهاب
چرخه کربس و تأثیر آن بر سیستم ایمنی و فرآیندهای التهابی
چرخه کربس نه تنها یک مسیر متابولیکی برای تولید انرژی و پیشسازهای بیوسنتزی است، بلکه به طور مستقیم در تنظیم پاسخهای ایمنی و التهابی نقش دارد. این نقش اخیراً در تحقیقات متابولیسم ایمنی (Immunometabolism) بسیار برجسته شده است.
متابولیتهای چرخه کربس به عنوان سیگنالدهندههای ایمنی
برخی از متابولیتهای میانی چرخه کربس، نقش مولکولهای پیامرسان (سیگنالدهنده) در پاسخهای ایمنی دارند:
-
-
سوکسینات (Succinate)
-
-
تجمع سوکسینات در ماکروفاژهای فعال شده، باعث فعال شدن مسیر HIF-1α و افزایش تولید IL-1β (یک سایتوکاین التهابی مهم) میشود.
-
سوکسینات میتواند به گیرنده سطحی GPR91 متصل شده و مسیرهای التهابی و متابولیکی را تقویت کند.
-
ایتاکونات (Itaconate)
-
-
یک متابولیت خاص که از ایزوسیترات ساخته میشود و اثرات ضدالتهابی دارد.
-
ایتاکونات با مهار آنزیمهای کلیدی متابولیکی و تولید گونههای واکنشگر اکسیژن (ROS) میتواند پاسخ التهابی را تعدیل کند.
-
سیترات
-
-
به عنوان پیشساز اسیدهای چرب و NO (نیتریک اکسید) که نقشهای مهمی در سیستم ایمنی ایفا میکنند.
تغییرات متابولیکی در سلولهای ایمنی فعال
-
ماکروفاژهای نوع M1 (پاسخ التهابی): افزایش گلیکولیز و انباشت سوکسینات
-
ماکروفاژهای نوع M2 (پاسخ ضدالتهابی): مصرف بیشتر چرخه کربس و فسفوریلاسیون اکسیداتیو
این تغییرات متابولیکی، نه فقط نتایج بلکه محرکهای تغییر در عملکرد ایمنی هستند.
ارتباط چرخه کربس و بیماریهای التهابی مزمن
-
اختلالات در متابولیسم چرخه کربس با بیماریهای التهابی مانند آرتریت روماتوئید، بیماری التهابی روده و بیماریهای قلبی-عروقی مرتبط است.
-
متابولیتهای چرخه میتوانند به عنوان اهداف درمانی جدید جهت کنترل التهاب مورد استفاده قرار گیرند.
تحقیقات جدید و کاربردهای درمانی
-
استفاده از تحریک یا مهار سوکسینات و ایتاکونات برای تعدیل پاسخهای ایمنی.
-
توسعه داروهای هدفمند بر اساس تغییرات متابولیکی چرخه کربس.
تاثیر متابولیتهای چرخه کربس بر اپیژنتیک و پیری
چرخه کربس، اپیژنتیک و نقش آن در فرآیند پیری
چرخه کربس علاوه بر نقش حیاتی در تولید انرژی و متابولیسم سلولی، به طور مستقیم در تنظیم فرآیندهای اپیژنتیک و در نتیجه پیری و بیماریهای مرتبط با سن نقش ایفا میکند.
متابولیتهای چرخه کربس به عنوان کوفاکتورهای اپیژنتیک
برخی از متابولیتهای مهم چرخه کربس به عنوان کوفاکتور یا تنظیمکننده آنزیمهای اپیژنتیک عمل میکنند:
-
α-کتوگلوتارات (α-KG) : کوفاکتور برای آنزیمهای دیمتلاز DNA و هیستون دیمتلاز است که باعث کاهش متیلاسیون و تنظیم بیان ژن میشوند.
-
سوکسینات و فومارات : با مهار آنزیمهای وابسته به α-KG مانند TET DNA دیمتلازها و هیستون دیمتلازها، میتوانند باعث افزایش متیلاسیون و خاموشی ژنها شوند.
تأثیر این تغییرات اپیژنتیک بر پیری
-
تغییرات اپیژنتیکی در طول زمان میتوانند باعث تغییرات در بیان ژنهای مرتبط با پاسخ به استرس، ترمیم DNA و فرآیندهای سلولی مهم شوند.
-
اختلال در تعادل متابولیتهای چرخه کربس ممکن است به تجمع آسیبهای سلولی، التهاب مزمن و تسریع فرآیند پیری کمک کند.
ارتباط متابولیتهای چرخه کربس با بیماریهای مرتبط با پیری
-
بیماریهای مزمن مثل سرطان، دیابت، بیماریهای عصبی و قلبی-عروقی با تغییرات متابولیکی و اپیژنتیکی چرخه کربس مرتبط هستند.
-
مطالعات جدید نشان میدهند که تنظیم دقیق سطح این متابولیتها میتواند فرآیندهای پیری و بیماریهای وابسته را کند یا حتی معکوس کند.
کاربردهای درمانی
-
توسعه داروهایی که متابولیتهای چرخه کربس را تنظیم کرده و بدین وسیله فرآیندهای اپیژنتیک را اصلاح میکنند.
-
تحقیقات روی متابولیتهای چرخه کربس به عنوان اهداف جدید درمانی در زمینههای مختلف از جمله پیری سالم و سرطان.
مهندسی متابولیک چرخه کربس برای تولید مواد شیمیایی و کاربردهای صنعتی
مهندسی متابولیک چرخه کربس؛ از سلول تا صنعت
چرخه کربس علاوه بر نقش زیستی حیاتی، به دلیل متابولیتهای میانی متنوع و پرکاربرد خود، یکی از اهداف مهم در مهندسی متابولیک برای تولید مواد شیمیایی، دارویی و سوختهای زیستی است.
فرصتها در مهندسی چرخه کربس
-
متابولیتهای چرخه کربس مانند سیترات، سوکسینات، فومارات و مالئات، پیشسازهای مهمی برای سنتز اسیدهای آلی، پلیمرها و سایر ترکیبات ارزشمند صنعتی هستند.
-
با مهندسی ژنتیکی میتوان مسیرهای تولید این متابولیتها را در میکروارگانیسمها افزایش داده و راندمان تولید را بهبود بخشید.
استراتژیهای متداول مهندسی متابولیک
-
افزایش جریان کربن به چرخه کربس : اصلاح آنزیمها برای افزایش کارایی و ظرفیت چرخه کربس.
-
مسیرهای انشعابی : استفاده از مسیرهای فرعی برای تولید متابولیتهای خاص با ارزش افزوده بالا.
-
حذف مسیرهای جانبی: کاهش تولید محصولات جانبی ناخواسته برای افزایش خلوص و بازده.
کاربردهای صنعتی
-
تولید اسید سیتریک در صنایع غذایی و دارویی.
-
سنتز سوکسینات برای تولید پلیمرهای زیستتخریبپذیر.
-
تولید اسیدهای آلی دیگر که در ساخت داروها و مواد شیمیایی کاربرد دارند.
چالشها و آینده پژوهشی
-
کنترل دقیق مسیرهای متابولیکی پیچیده در میکروارگانیسمها.
-
مقابله با مسمومیت متابولیتها و افزایش پایداری سلولی.
-
استفاده از فناوریهای پیشرفته مانند CRISPR و سیستمهای کشت بیهوازی برای بهینهسازی تولید.
چرخه کربس و نقش آن در درمان سرطان و بیماریهای متابولیک
چرخه کربس؛ هدفی نوین در درمان سرطان و بیماریهای متابولی»
چرخه کربس، به عنوان قلب متابولیسم سلولی، نقش مهمی در سلامت و بیماریهای مختلف از جمله سرطان و اختلالات متابولیک ایفا میکند. تغییرات در این چرخه میتوانند زمینهساز توسعه بیماریها شوند، اما در عین حال فرصتهای درمانی جدیدی نیز فراهم میآورند.
نقش چرخه کربس در سرطان
-
بازبرنامهریزی متابولیک : سلولهای سرطانی معمولاً متابولیسم خود را بازتنظیم میکنند تا نیازهای بالای انرژی و بیوسنتز را تامین کنند. این شامل تغییر در چرخه کربس و افزایش متابولیتهای خاص است.
-
متابولیتهای سیگنالدهنده : برخی متابولیتهای چرخه کربس مثل سوکسینات و فومارات به عنوان سیگنالدهنده عمل کرده و مسیرهای رشد سلولی و ژنهای مرتبط با سرطان را فعال میکنند.
-
هدفگیری آنزیمها و مسیرهای متابولیک : مهار یا تعدیل آنزیمهای کلیدی چرخه کربس به عنوان استراتژیهای درمانی در حال توسعه است.
چرخه کربس در بیماریهای متابولیک و عصبی
-
اختلالات در چرخه کربس میتواند باعث بروز بیماریهایی مانند دیابت، بیماریهای قلبی و اختلالات عصبی شود.
-
متابولیتهای چرخه کربس میتوانند باعث استرس اکسیداتیو، التهاب و آسیب سلولی شوند که زمینهساز این بیماریها هستند.
-
اصلاح عملکرد چرخه کربس، بهبود متابولیسم سلولی و کاهش آسیبهای اکسیداتیو از راهکارهای درمانی پیشنهادی است.
رویکردهای نوین درمانی
-
درمان هدفمند : استفاده از داروهایی که آنزیمهای کلیدی چرخه کربس را تنظیم یا مهار میکنند.
-
ترکیب درمانی : ترکیب مهارکنندههای مسیرهای متابولیکی با درمانهای سنتی سرطان.
-
فناوریهای نوین : استفاده از فناوریهای ژنتیکی و نانو برای هدفگیری دقیقتر سلولهای بیمار.
چشمانداز آینده
مطالعات گستردهتر بر روی چرخه کربس میتواند به توسعه داروهای موثرتر و درمانهای شخصیسازی شده کمک کند. درک عمیقتر این چرخه، کلید بازکردن رازهای بسیاری از بیماریها و ارتقاء سلامت انسان خواهد بود.




