پروتئومیکس چیست ؟
بخش ۱: مقدمهای بر پروتئومیکس
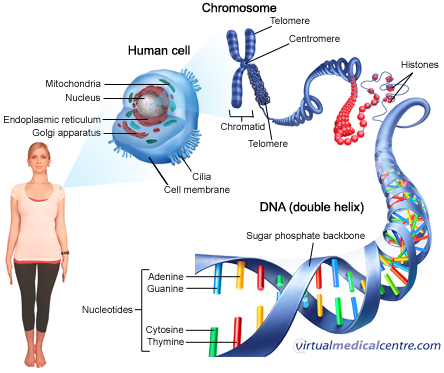
پروتئومیکس به مطالعه در مقیاس وسیع پروتئینها گفته میشود، بهویژه بررسی ساختارها، عملکردها، برهمکنشها و تغییرات آنها تحت شرایط مختلف زیستی. پروتئوم به عنوان مجموعهی پروتئینهای بیانشده توسط ژنوم، سلول، بافت یا یک ارگانیسم در یک زمان مشخص و تحت شرایط خاص، شناخته میشود. در حالی که ژنومیک (مطالعه ژنها) نقشهی ژنتیکی حیات را از طریق توالی DNA ارائه میدهد، پروتئومیکس به ما نشان میدهد چگونه این نقشهی ژنتیکی در فرآیندهای پویا و زنده پیادهسازی میشود. از آنجا که پروتئینها مولکولهای عملکردی اصلی درون سلولها هستند و تقریباً تمام فرآیندهای فیزیولوژیکی را برعهده دارند، درک پروتئوم برای فهم نحوه عملکرد موجودات زنده در شرایط سلامت و بیماری حیاتی است.
اصطلاح «پروتئوم» برای اولین بار در اواسط دهه ۱۹۹۰ توسط مارک ویلکینز (Marc Wilkins) ابداع شد تا به تمام پروتئینهای تولیدشده توسط یک ارگانیسم اشاره کند؛ مشابه اصطلاح «ژنوم» که به مجموعهی کامل ژنها اطلاق میشود. بنابراین، پروتئومیکس به عنوان رشتهای مکمل برای ژنومیک به وجود آمد و رشد آن تحت تأثیر پیشرفتهایی در طیفسنجی جرمی (mass spectrometry)، روشهای جداسازی پروتئینها، و زیستاطلاعرسانی (bioinformatics) بوده است. برخلاف ژنوم که نسبتاً ایستا است، پروتئوم بسیار پویا و تغییرپذیر است و نسبت به طیف وسیعی از تحریکات درونی و بیرونی واکنش نشان میدهد. پروتئینها پس از ترجمه (ترجمهی RNA به پروتئین) دستخوش تعدیلاتی مانند فسفریلاسیون، گلیکوزیلاسیون، یوبیکوئیتیناسیون و متیلاسیون میشوند که هر یک میتوانند بر عملکرد، موقعیت مکانی، پایداری و تعاملات پروتئین اثر بگذارند.
هدف پروتئومیکس فقط فهرست کردن پروتئینهای موجود در یک نمونه زیستی نیست، بلکه تعیین مقدار پروتئینها، انواع ایزوفورمها (اشکال مختلف یک پروتئین)، تغییرات پس از ترجمه (PTMs)، الگوهای بیان در زمان و مکان، و تعاملات با سایر مولکولهای زیستی نیز از جمله اهداف اصلی آن هستند. این اهداف باعث شدهاند که پروتئومیکس در قلب زیستشناسی سامانهای (systems biology) قرار گیرد و بینشهای مهمی درباره مکانیسمهای سلولی، مسیرهای سیگنالدهی و پاتولوژی بیماریها فراهم آورد. این رشته امروزه در زمینههای مختلفی مانند زیستشناسی مولکولی، بیوشیمی، داروشناسی و پزشکی بالینی کاربرد گستردهای دارد.
پیشرفت پروتئومیکس تا حد زیادی تحت تأثیر نوآوریهای فناورانه بوده است. الکتروفورز دو بعدی (2D-GE) و طیفسنجی جرمی (MS) ابزارهای بنیادینی بودهاند که به پژوهشگران امکان دادهاند هزاران پروتئین را از مخلوطهای پیچیده جداسازی، شناسایی و کمّیسازی کنند. اخیراً نیز روشهایی مانند کمّیسازی بدون برچسب (label-free quantification)، برچسبگذاری با ایزوتوپ پایدار و روشهای دریافت مستقل از داده (DIA) باعث شدهاند که حساسیت، سرعت و تکرارپذیری تحلیلهای پروتئومیکی به طور چشمگیری افزایش یابد. علاوه بر این، پیشرفت در ابزارها و پایگاههای داده محاسباتی به پژوهشگران کمک کرده تا حجم عظیم دادههای تولید شده را پردازش و تفسیر کنند، که این امر در تولید فرضیه و کشف نشانگرهای زیستی (biomarkers) نقش مهمی دارد.
پروتئومیکس اغلب بر اساس اهداف خاص یا روشهای بهکاررفته، به زیرشاخههای مختلفی تقسیم میشود. پروتئومیکس ساختاری به بررسی ساختار سهبعدی پروتئینها و کمپلکسهای پروتئینی میپردازد، پروتئومیکس عملکردی به دنبال درک فعالیت و شبکههای برهمکنشی پروتئینها است، و پروتئومیکس بالینی با هدف شناسایی نشانگرهای زیستی بیماری و اهداف درمانی از فناوریهای پروتئومیکی استفاده میکند. همچنین، ادغام دادههای پروتئومیکی با اطلاعات ژنومی، ترانسکریپتومی و متابولومی — که به آن چند-اُمیکس (multiomics) میگویند — به راهبردی اساسی برای درک جامع سیستمهای زیستی تبدیل شده است.
یکی از چالشهای منحصر بهفرد در پروتئومیکس، تنوع بسیار بالای پروتئوم است که از پیامبرشهای جایگزین (alternative splicing)، ویرایش RNA، و انواع تغییرات پساترجمهای (PTMs) ناشی میشود. یک ژن میتواند چندین ایزوفورم از یک پروتئین تولید کند که کارکردهای متفاوتی دارند؛ این موضوع باعث میشود تحلیل پروتئومی بسیار پیچیدهتر از توالییابی ژنومی باشد. همچنین، مقدار پروتئینها میتواند در چندین مرتبه بزرگی متفاوت باشد، و بسیاری از پروتئینهای زیستی مهم مانند فاکتورهای رونویسی و مولکولهای سیگنالدهنده در سطوح بسیار پایین بیان میشوند. بنابراین، شناسایی و اندازهگیری این پروتئینهای کمیاب نیاز به تکنیکهای تحلیلی بسیار حساس و طراحی دقیق آزمایشها دارد.
اهمیت پروتئومیکس فراتر از پژوهشهای آکادمیک است. در صنعت داروسازی، از رویکردهای پروتئومیکی در کشف دارو، بررسی مکانیسم اثر، و شناسایی اثرات جانبی ناخواسته داروها استفاده میشود. در حوزه بالینی، نشانگرهای زیستی پروتئومیکی در حال توسعه برای تشخیص زودهنگام، شناسایی و پیشبینی بیماریهایی نظیر سرطان، بیماریهای قلبی-عروقی و اختلالات عصبی-تحلیلبرنده هستند. پزشکی شخصی، که تلاش میکند درمان را متناسب با ویژگیهای فردی هر بیمار تنظیم کند، به طور فزایندهای بر دادههای پروتئومیکی برای انتخاب درمان و پایش آن تکیه دارد.
در پایان، پروتئومیکس به عنوان یکی از زمینههای محوری در پژوهشهای زیستی مدرن شناخته میشود که ابزارها و دانش بینظیری برای درک حیات در سطح مولکولی فراهم میکند. این علم پل میان ژنوتیپ و فنوتیپ را برقرار میسازد و مکانیسمهایی را آشکار میسازد که اطلاعات ژنتیکی را به قابلیتهای عملکردی متنوع موجودات زنده تبدیل میکنند. با تداوم پیشرفت فناوریهای پروتئومیکی، کاربردهای آن نیز روزبهروز گستردهتر خواهد شد و فرصتهای جدیدی برای پیشرفت درک علمی و بهبود سلامت انسان به همراه خواهد آورد. سفر به دنیای پروتئوم سفری پیچیده اما ارزشمند است که نوید کشفهایی تحولآفرین را در سالهای آینده میدهد.
۲. تاریخچه و تحول پروتئومیکس
ظهور پروتئومیکس بهعنوان یک رشته علمی مستقل، نشاندهندهی گذار عمیق از پژوهشهای سنتی و تقلیلگرایانهی پروتئینها به رویکردی جامع و سامانهمحور برای درک عملکردهای زیستی است. در حالی که زیستشناسی مولکولی اوایل قرن بیستم عمدتاً بر پروتئینهای منفرد و نقشهای خاص آنها تمرکز داشت، پایههای علمی پروتئومیکس در دهه ۱۹۷۰ میلادی با توسعهی الکتروفورز دوبعدی ژل پلیآکریلآمید (2D‑PAGE) شکل گرفت. این روش که بهطور مستقل توسط پژوهشگرانی مانند پاتریک اوفارل (Patrick O’Farrell) و یواخیم کلوزه (Joachim Klose) ابداع شد، به دانشمندان اجازه داد تا ترکیبهای پیچیدهای از پروتئینها را بر اساس دو ویژگی کلیدی — نقطه ایزوالکتریک و وزن مولکولی — از یکدیگر جدا کنند. این نوآوری، پیشرفتی مهم در تحلیل پروتئینها بود که امکان مشاهدهی همزمان صدها تا هزاران پروتئین را فراهم ساخت.
با وجود این پیشرفتها، در ابتدا پژوهشگران با محدودیتهای بزرگی در شناسایی مستقیم پروتئینها از روی ژلها مواجه بودند. روشهای سنتی مانند توالییابی اسیدآمینهای از طریق تخریب ادمن (Edman degradation) بسیار زمانبر بودند و برای تحلیلهای با توان بالا مناسب نبودند. نقطه عطف در اواخر دهه ۱۹۸۰ و اوایل دهه ۱۹۹۰ با معرفی انقلابی تکنیکهای طیفسنجی جرمی (MS) رقم خورد؛ بهویژه با معرفی یونیزاسیون پاششی الکتریکی (ESI) و یونیزاسیون با جذب لیزری به کمک ماتریکس (MALDI). این نوآوریها باعث شد بتوان مولکولهای بزرگ زیستی مانند پروتئینها را با حساسیت و دقت بالا، بدون تجزیه شدید، تحلیل کرد. این پیشرفتها بهگونهای تأثیرگذار بودند که پروتئومیکس را متحول ساختند و مورد استفاده گسترده قرار گرفتند؛ حتی در پژوهشهایی که برنده جایزه نوبل شدند، نقش داشتند.
در همین زمان، ابزارهای محاسباتی جدیدی مانند اثر انگشت جرمی پپتیدها (Peptide Mass Fingerprinting/PMF) و طیفسنجی جرمی دوبخشی (MS/MS) نیز ظهور کردند. ترکیب این روشها با الگوریتمهای جستجو در پایگاههای داده مانند SEQUEST و MASCOT به دانشمندان اجازه داد تا طیفهای قطعهبندیشدهی پپتیدها را با توالیهای پروتئینی شناختهشده تطبیق دهند و در نتیجه، پروتئینهای موجود در ترکیبهای پیچیده را با دقت بالا شناسایی کنند. این ترکیب تحلیلهای مبتنی بر MS و زیستاطلاعرسانی، پایهگذار شناسایی پروتئینها در مقیاس وسیع و با توان بالا شد که امروز شاخصهی اصلی پروتئومیکس مدرن است.
در سال ۱۹۹۴، اصطلاح «پروتئوم» برای نخستین بار توسط مارک ویلکینز (Marc Wilkins)، دانشجوی دکترای دانشگاه مککواری استرالیا، ابداع شد. این واژه، معادل «ژنوم»، برای اشاره به مجموعهی کامل پروتئینهایی که توسط ژنوم رمزگذاری و در یک سلول، بافت یا ارگانیسم در یک زمان مشخص بیان میشوند، طراحی شد. این جهش مفهومی باعث شد تمرکز از مطالعه پروتئینهای منفرد به سمت منظر پویا و درهمتنیدهی پروتئینهای موجود در سیستمهای زنده تغییر یابد، و بدین ترتیب پایهگذار نگرش امروزی به پروتئومیکس شد.
در اواسط تا اواخر دهه ۱۹۹۰، پیشرفتهای فناورانه در هر دو زمینهی روشهای جداسازی پروتئین و سکوهای طیفسنجی جرمی به پژوهشگران این امکان را داد که نقشهی پروتئومها را در مقیاس وسیع ترسیم کنند. ترکیب سیستمهای MS با وضوح بالا، بهبود روشهای کروماتوگرافی، و الگوریتمهای زیستاطلاعرسانی به دانشمندان این توانایی را داد تا هزاران پروتئین را از یک نمونه زیستی منفرد شناسایی کنند. در همین دوره، پروژههای بزرگی برای ترسیم پروتئوم ارگانیسمهای مدل مانند مخمر و مگس سرکه آغاز شد که بعداً راه را برای مطالعات پیچیدهتری مانند پروتئوم بافتهای انسانی هموار کرد.
در اوایل دهه ۲۰۰۰ میلادی، پروتئومیکس بهعنوان ابزاری کلیدی در ژنومیک عملکردی و زیستشناسی سامانهای به بلوغ رسید. کنفرانسها و همکاریهای جهانی باعث شدند فناوریها با سرعت بیشتری گسترش یابند. پیشرفت در ابزارآلات — مانند QTOF (طیفسنجی زمانپرواز چهارقطبی)، اوربیتترپ (Orbitrap) و سیستمهای ترکیبی MS — به طرز چشمگیری وضوح، سرعت و قابلیتهای کمّیسازی را بهبود بخشید. همچنین، تکنیکهای جدید قطعهبندی پپتید مانند جذب الکترونی (ECD) و انتقال الکترونی (ETD) معرفی شدند که امکان تحلیل دقیق تغییرات پس از ترجمه (PTMs) را فراهم کردند بدون از دست دادن اطلاعات ساختاری پروتئینها.
یکی از نقاط عطف مهم در سال ۲۰۱۴ رخ داد، زمانیکه پژوهشگران نقشههای پیشنویس از پروتئوم انسانی را منتشر کردند که در آن پروتئینهای رمزگذاریشده توسط بیش از ۱۷۰۰۰ ژن انسانی شناسایی شده بودند. این تحلیل جامع، بینش بیسابقهای در مورد بیان پروتئینها در بافتها و مراحل مختلف رشد و تکامل ارائه داد. اهمیت این مطالعات در آن بود که نشان داد پروتئومیکس میتواند دادههای ژنومی را تکمیل کند و ناحیههای جدید رمزگذار پروتئین، اشکال پیوند غیرمعمول، و ایزوفورمهای خاص بافتی یا وضعیتی را شناسایی کند. این رویکرد ادغامی اکنون به نام پروتئوژنومیکس (Proteogenomics) شناخته میشود که دادههای ژنومیک، ترانسکریپتومیک و پروتئومیک را ترکیب میکند تا درک کاملتری از عملکرد سلولی حاصل شود.
در دهه گذشته، پروتئومیکس به عرصههای جدیدی همچون تشخیصهای بالینی، کشف نشانگرهای زیستی، پزشکی دقیق و توسعه دارو گسترش یافته است. پروژههای بزرگ از استراتژیهایی مانند برچسبگذاری ایزوباریک و روشهای بدون برچسب برای تحلیل تغییرات بیان پروتئین در شرایط سلامت و بیماری استفاده کردهاند. رشد پروتئومیکس هدفمند، مانند پایش واکنشهای انتخابشده (SRM) و پایش واکنشهای موازی (PRM)، امکان کمّیسازی دقیق پروتئینهای خاص در نمونههای بالینی با حساسیت بالا را فراهم کرده است.
نوآوریهای اخیر نظیر پروتئومیکس تکسلولی، تکنیکهای برداشت داده بسیار سریع و تحلیل دادهها با کمک هوش مصنوعی در حال گسترش مرزهای تواناییهای پروتئومیکس هستند. امروزه، پروتئومیکس دیگر تنها یک تمرین برای فهرستبرداری از پروتئینها نیست، بلکه بخشی حیاتی از درک سیگنالدهی سلولی، پیشرفت بیماریها، پاسخ به درمان و زیستشناسی در سطح سامانهای به شمار میآید.
۳. فناوریها و روشهای پروتئومیکی
پروتئومیکس به مجموعهای از فناوریهای پیشرفته و رویکردهای روششناختی متکی است که در کنار هم، این امکان را به دانشمندان میدهند تا چشمانداز گستردهی پروتئینها در یک سامانهی زیستی را شناسایی، کمّیسازی و تفسیر کنند. این ابزارها بهدقت توسعه یافته و بهبود یافتهاند تا بتوانند با چالشهای منحصربهفرد پروتئینها، از جمله تنوع زیاد، ساختارهای پیچیده و الگوهای بیانی پویا در زمانها و شرایط مختلف، مقابله کنند. روشهایی که در پروتئومیکس استفاده میشوند در چند دستهی کلی قرار میگیرند که هر یک نقش حیاتی در جریان کار (workflow) پروتئومیکی دارند.
اولین گام مهم در هر جریان پروتئومیکی، آمادهسازی نمونه (Sample Preparation) است، که پایهی دستیابی به نتایج دقیق و قابل تکرار بهشمار میرود. نمونههای زیستی—از سلولها و بافتها گرفته تا مایعات زیستی مانند پلاسما یا مایع مغزی-نخاعی—باید بهگونهای پردازش شوند که ساختار پروتئینها حفظ شده و از تجزیه یا از دست رفتن آنها جلوگیری شود. این مرحله معمولاً شامل شکستن سلولها (لیز شدن) با استفاده از روشهای مکانیکی یا شویندههای شیمیایی و سپس حذف اسیدهای نوکلئیک و چربیها است که ممکن است در تحلیلهای بعدی اختلال ایجاد کنند. پس از آن، پروتئینها کاهش، آلکیله و بهصورت آنزیمی (معمولاً با تریپسین) تجزیه میشوند تا به پپتیدهایی تبدیل شوند که برای جداسازی و تحلیل طیفسنجی جرمی مناسبتر هستند.
پس از هضم، ترکیبهای پپتیدی به تکنیکهای جداسازی (Separation Techniques) سپرده میشوند که هدف آنها کاهش پیچیدگی نمونه و افزایش وضوح تحلیلهای بعدی است. کروماتوگرافی مایع با کارایی بالا (HPLC)، و بهویژه کروماتوگرافی مایع نانویی (nano-LC)، به روش استاندارد در پروتئومیکس تبدیل شدهاند؛ چرا که توانایی جداسازی هزاران پپتید را با دقت بالا دارند. این مرحله جداسازی، برای شناسایی و کمّیسازی ضروری است، چرا که باعث میشود پپتیدها در زمانهای متفاوتی خروج پیدا کنند و تداخل آنها کاهش یابد. روشهای جایگزین مانند الکتروفورز مویرگی (CE) و تقسیمبندی چندبعدی (multidimensional fractionation) نیز میتوانند برای پوشش بیشتر مورد استفاده قرار گیرند.
در مرحلهی بعد، پپتیدهای جداشده وارد یک طیفسنج جرمی (Mass Spectrometer) میشوند، جایی که یونیزه شده و بر اساس نسبت جرم به بار (m/z) تحلیل میگردند. دو روش یونیزاسیون اصلی یعنی یونیزاسیون پاششی الکتریکی (ESI) و یونیزاسیون با جذب لیزری به کمک ماتریکس (MALDI) بهطور گسترده مورد استفاده قرار میگیرند. ESI برای اتصال به کروماتوگرافی مایع بسیار مناسب است و جریان پیوستهای از یونها را به دستگاه طیفسنج وارد میکند، در حالی که MALDI بیشتر در کاربردهای تصویربرداری استفاده میشود و امکان نقشهبرداری فضایی از پروتئینها در مقاطع بافتی را فراهم میسازد.
طیفسنجی جرمی (MS) پایهی اصلی تحلیلهای پروتئومیکی است و بسته به هدف آزمایش، انواع مختلفی از آنالایزرهای جرمی استفاده میشوند، از جمله:
-
Time-of-Flight (TOF)
-
Quadrupole (چهارقطبی)
-
Ion Trap (تلهی یونی)
-
Orbitrap
-
Fourier Transform Ion Cyclotron Resonance (FT-ICR)
هرکدام از این آنالایزرها مزایای خاصی در زمینه وضوح، حساسیت و سرعت برداشت داده دارند. طیفسنجی جرمی دوبخشی (MS/MS)، که شامل چند مرحله تحلیل جرم است، امکان شکستن پپتیدها و تعیین توالی آنها را فراهم میکند و در نتیجه دقت شناسایی پروتئینها را افزایش میدهد.
برای تبدیل دادههای خام طیفسنجی به اطلاعات زیستی قابل استفاده، ابزارهای زیستاطلاعرسانی و نرمافزارها ضروری هستند. موتورهای جستجو در پایگاههای داده مانند Mascot، SEQUEST، و Andromeda با مقایسه الگوهای شکست پپتیدی مشاهدهشده با طیفهای تئوریک موجود در بانکهای اطلاعاتی، پروتئینها را با اطمینان شناسایی میکنند. ابزارهای آماری اعتبارسنجی نیز برای بررسی صحت این تطبیقها و کنترل نرخ کشفهای کاذب بهکار میروند. در حوزه کمّیسازی، روشهایی مانند:
-
کمّیسازی بدون برچسب (Label-Free)
-
برچسبگذاری با ایزوتوپ پایدار (مانند SILAC)
-
برچسبهای ایزوباریک (مانند TMT و iTRAQ)
امکان سنجش دقیق مقدار پروتئینها در شرایط یا زمانهای مختلف را فراهم میسازند.
یکی از حوزههای مهم دیگر در پروتئومیکس، تحلیل تغییرات پساترجمهای (Post-Translational Modifications/PTMs) است—تغییرات شیمیایی که پس از سنتز بر روی پروتئینها اعمال میشوند و نقش حیاتی در تنظیم عملکرد، مکاننمایی، و تعاملات پروتئینها دارند. تغییرات رایج شامل فسفریلاسیون، گلیکوزیلاسیون، یوبیکوئیتیناسیون، و استیلاسیون هستند. برای تحلیل این تغییرات، معمولاً از روشهای غنیسازی مانند کروماتوگرافی با میل ترکیبی یا ایمونوسیدهسازی (ایمنیرسوبدهی) استفاده میشود تا پپتیدهای تغییر یافته جدا شده و بهدقت توسط MS تحلیل شوند. این روشها امکان نقشهبرداری دقیق از محل PTMها و بررسی شبکههای سیگنالدهی پویا را فراهم میکنند.
در سالهای اخیر، ظهور پروتئومیکس هدفمند (Targeted Proteomics) به پژوهشگران این امکان را داده تا پروتئینها یا مسیرهای خاصی را با حساسیت و دقت بالا بررسی کنند. روشهایی مانند:
-
پایش واکنشهای انتخابی (SRM)
-
پایش واکنشهای موازی (PRM)
از تحولات پپتیدی از پیش تعیینشده برای کمّیسازی پروتئینهای شناختهشده استفاده میکنند و به همین دلیل، ابزارهایی بسیار ارزشمند در اعتبارسنجی نشانگرهای زیستی و پژوهشهای بالینی بهشمار میروند. در کنار آنها، رویکردهای دریافت مستقل از داده (DIA) مانند SWATH-MS نیز توسعه یافتهاند که ترکیبی از جامعیت روشهای اکتشافی و تکرارپذیری روشهای هدفمند را ارائه میدهند.
علاوه بر این، فناوریهایی مانند ریزآرایههای پروتئینی (Protein Microarrays) و طیفسنجی جرمی تصویری (Imaging Mass Spectrometry) اطلاعات فضایی و عملکردی ارزشمندی دربارهی پروتئینها فراهم میکنند و امکان بررسی بیان و تعامل پروتئینها در محل واقعی بافتها (in situ) را فراهم میسازند. این تکنیکها بهویژه در تحقیقات ترجمهای (Translational Research) مفید هستند، جایی که دانستن موقعیت فضایی پروتئینها در بافت میتواند درک ما از مکانیسمهای بیماری و پاسخ به درمان را بهبود بخشد.
در مجموع، این فناوریها و روشها، سکویی یکپارچه برای پیشبرد پروتئومیکس مدرن تشکیل دادهاند. آنها با امکان شناسایی جامع و پرتوان پروتئینها در سیستمهای زیستی متنوع، ابزارهای لازم را برای کشف پیچیدگیهای حیات سلولی و ترجمهی دادههای پروتئومیکی به درک زیستی و بالینی ارزشمند در اختیار پژوهشگران قرار میدهند.
کاربردهای پروتئومیکس در علم و پزشکی
پروتئومیکس، بهعنوان مطالعهای در مقیاس وسیع بر روی پروتئینها—ساختار، عملکرد، تعاملات و تغییرات آنها—بهیکی از اجزای غیرقابلجایگزین در زیستشناسی مولکولی، زیستشناسی سامانهای و پژوهشهای پزشکی تبدیل شده است. این حوزه با فراهمکردن تصویری جامع از پروتئوم، به دانشمندان این امکان را میدهد تا فرآیندهای سلولی را در سطح پروتئینی بررسی کنند؛ سطحی که بسیار پویاتر و از نظر عملکردی مرتبطتر از دادههای ژنومی است.
کاربردهای پروتئومیکس بسیار گسترده و در حال گسترش هستند؛ از تحقیقات پایهای زیستی گرفته تا تشخیص، پیشآگهی و درمان بیماریهای انسانی. در این بخش، به مهمترین زمینههایی که پروتئومیکس در آنها در حال متحولکردن علم و پزشکی است، پرداخته میشود.
1. پروتئومیکس در کشف بیومارکرهای بیماری
یکی از تأثیرگذارترین کاربردهای پروتئومیکس، شناسایی بیومارکرهای خاص بیماری است. بیومارکرها، شاخصهای زیستی قابلاندازهگیری هستند که برای تشخیص بیماریها یا پیشبینی روند آنها مورد استفاده قرار میگیرند. برخلاف ژنومیکس که اطلاعاتی نسبتاً ایستا ارائه میدهد، پروتئومیکس میتواند تغییرات دینامیک در بیان پروتئینها و تغییرات پساترجمهای (PTMs) را که نشاندهنده وضعیت بیماری هستند، آشکار کند.
برای مثال، در تحقیقات سرطان، تحلیل پروتئومیکِ مقایسهای بین بافتهای توموری و بافتهای سالم، منجر به شناسایی پروتئینهایی شده که در تومورها افزایش یا کاهش بیان دارند. این پروتئینها میتوانند به عنوان نشانگرهای تشخیصی، شاخصهای پیشآگهی یا اهداف درمانی به کار روند.
در بیماریهای تحلیلبرنده عصبی مانند آلزایمر و پارکینسون، مطالعات پروتئومیکی بر روی مایع مغزینخاعی منجر به شناسایی پروتئینهای تغییر یافتهای چون تائو (Tau)، بتاآمیلوئید و آلفا-سینوکلئین شدهاند که میتوانند برای تشخیص زودهنگام یا پایش پیشرفت بیماری بهکار گرفته شوند.
2. کشف دارو و فارماکوپروتئومیکس
پروتئومیکس نقش مهمی در کشف داروهای نوین ایفا میکند، زیرا بینشهای عمیقی از مکانیسمهای مولکولی بیماری و نحوه اثر داروها فراهم میسازد. با استفاده از تحلیلهای پروتئومیکی مقایسهای، میتوان تأثیر داروهای کاندید را بر بیان پروتئینها و مسیرهای سیگنالی بررسی کرد.
همچنین، پروتئومیکس به شناسایی اثرات ناخواسته دارو و واکنشهای جانبی بالقوه در مراحل اولیه توسعه دارو کمک میکند. شاخهای از پروتئومیکس با نام فارماکوپروتئومیکس، بر تغییرات فردی در بیان پروتئینها که ممکن است بر پاسخ به دارو تأثیر بگذارند تمرکز دارد. این رویکرد، هماهنگ با اهداف پزشکی شخصیسازیشده است، زیرا میتواند زیرگروههایی از بیماران را مشخص کند که احتمال دارد به دارویی خاص پاسخ مثبت یا منفی بدهند.
3. پروتئومیکس در پزشکی شخصی و دقیق
با گسترش دیدگاه پزشکی دقیق، توانایی سفارشیسازی درمانها براساس تفاوتهای ژنتیکی، پروتئینی و محیطی فردی اهمیت فزایندهای یافته است. پروتئومیکس ابزاری قدرتمند برای پرکردن فاصله بین ژنوتیپ و فنوتیپ است، زیرا تفاوتهای پروتئینی مستقیماً عملکرد سلولی را منعکس میکنند.
پروفایلهای پروتئومیکی شخصی میتوانند نشان دهند که بیماران از نظر مکانیسمهای بیماری، متابولیسم دارو یا پاسخ ایمنی چگونه با یکدیگر تفاوت دارند. در حوزه سرطانشناسی، پروفایلبرداری پروتئومیکی از تومورها منجر به زیرگروهبندی دقیقتر سرطانها شده است و به پزشکان امکان میدهد درمانهای هدفمند متناسب با ویژگیهای مولکولی تومور هر بیمار را تجویز کنند. این روش هم موجب افزایش اثربخشی درمان میشود و هم از عوارض جانبی و درمانهای غیرضروری میکاهد.
4. پروتئومیکس در پژوهش بیماریهای عفونی
مطالعهی برهمکنشهای میزبان-پاتوژن یکی دیگر از حوزههایی است که پروتئومیکس در آن بسیار ارزشمند بوده است. با بررسی پروتئوم سلولهای میزبان و پاتوژنها، پژوهشگران درمییابند که عوامل بیماریزا چگونه ماشینهای سلولی میزبان را به خدمت میگیرند تا عفونت را گسترش داده و از پاسخهای ایمنی فرار کنند.
برای مثال، مطالعات پروتئومیکی در عفونتهای ویروسی مانند HIV یا کووید-۱۹ نشان دادهاند که ویروسها چگونه از پروتئینهای میزبان استفاده میکنند یا مسیرهای ایمنی را تغییر میدهند. این یافتهها به توسعهی درمانهای ضدویروسی کمک میکند که میتوانند این تعاملات را مختل کرده یا دفاع ایمنی بدن را تقویت کنند.
همچنین، پروتئومیکس در مطالعهی پاسخهای واکسیناسیون و پایش ایمنی ناشی از واکسن نیز کاربرد دارد که میتواند به طراحی و بهینهسازی واکسنها کمک کند.
5. کاربردهای کشاورزی و زیستمحیطی
پروتئومیکس به حوزه سلامت انسان محدود نمیشود و در کشاورزی و علوم محیطی نیز کاربردهای چشمگیری دارد. در زیستشناسی گیاهی، پروتئومیکس به درک نحوهی واکنش گیاهان به تنشهایی مانند خشکی، شوری، آفات و عوامل بیماریزا کمک میکند. این دانش میتواند در توسعه گیاهان اصلاحشده ژنتیکی با مقاومت بالا یا بهرهوری بیشتر مورد استفاده قرار گیرد.
در حوزه ایمنی غذایی، تکنیکهای پروتئومیکی میتوانند برای تشخیص آلایندهها، آلرژنها یا میکروارگانیسمهای بیماریزا در مواد غذایی با حساسیت و دقت بالا بهکار روند.
پروتئومیکس زیستمحیطی یا متاپروتئومیکس، پروتئومهای جمعی جوامع میکروبی در اکوسیستمهای مختلف را بررسی میکند. این رویکرد به درک تنوع زیستی، عملکرد اکوسیستم و اثرات آلودگیها یا تغییرات اقلیمی بر حیات میکروبی کمک میکند.
6. پروتئومیکس در سلولهای بنیادی و پزشکی ترمیمی
درک چشمانداز پروتئومیکی سلولهای بنیادی و سلولهای تمایز یافته از آنها، برای پیشرفت پزشکی ترمیمی حیاتی است. پروتئومیکس میتواند نشانگرهای پروتئینی را که سلولهای بنیادی پرتوان را از سلولهای تمایزیافته متمایز میسازند شناسایی کند.
همچنین، این فناوری مسیرهای سیگنالی و شبکههای پروتئینی مؤثر در حفظ، تکثیر و تمایز سلولهای بنیادی را آشکار میسازد. این اطلاعات میتواند ایمنی و اثربخشی درمانهای مبتنی بر سلولهای بنیادی را بهبود ببخشد، از جمله اطمینان از تمایز صحیح سلولها و کاهش خطر تومورزایی.
علاوهبراین، پروفایلبرداری پروتئومیکی میتواند برای پایش عملکرد و ادغام سلولهای پیوندی در بدن استفاده شود تا بتوان نتایج درمانی را بهطور دقیق ارزیابی کرد.
7. پروتئومیکس عملکردی و ساختاری در زیستشناسی سامانهای
پروتئومیکس عملکردی به درک عملکرد، تعاملات و پویایی پروتئینها در زمینهی سلولی میپردازد، در حالی که پروتئومیکس ساختاری هدفش تعیین ساختار سهبعدی پروتئینها و مجموعههای پروتئینی است. این دو رویکرد مکمل، در کنار هم به زیستشناسی سامانهای کمک میکنند تا شبکههای سیگنالی سلولی و تعاملات بین هزاران پروتئین بازسازی شوند.
از طریق مطالعات تعاملات پروتئینی مبتنی بر طیفسنجی جرمی (mass spectrometry)، پژوهشگران میتوانند نقشههای تعامل پروتئینی ترسیم کنند که گرههای کلیدی در مسیرهای زیستی را نشان میدهد. این تحلیلهای تلفیقی، تنظیمکنندههای اصلی فرآیندهای سلولی را شناسایی میکند و نقاط مداخله درمانی بالقوه را آشکار میسازد.
پروتئومیکس بالینی: پل میان کشف علمی و مراقبت از بیمار
پروتئومیکس بالینی نقطهای کلیدی بین تحقیقات پروتئومیکی و کاربردهای پزشکی است که در آن، بینشهای مولکولی به ابزارهای عملی برای تشخیص، پیشآگهی، شناسایی بیماری و درمان تبدیل میشوند. برخلاف پروتئومیکس کشفی (Discovery Proteomics) که با رویکردی باز به بررسی جامع تمام پروتئینهای یک نمونه زیستی میپردازد، پروتئومیکس بالینی بیشتر تمرکز بر اعتبارسنجی بیومارکرها و توسعه آزمونهایی دارد که قابل استفاده در محیطهای واقعی درمانی باشند.
۱. شناسایی بیومارکرها برای تشخیص و پیشآگهی
یکی از اهداف اصلی در پروتئومیکس بالینی، شناسایی بیومارکرهایی است که بتوانند میان شرایط سلامت و بیماری تمایز قائل شوند، پیشرفت بیماری را پیشبینی کنند یا پاسخ به درمان را ارزیابی نمایند. این کار بهطور خاص توسط پروتئینها که بازتابی مستقیم از وضعیت فیزیولوژیکی و شبکههای سیگنالدهی دینامیک هستند، امکانپذیر میشود.
به عنوان مثال، کشف آنتیژن خاص پروستات (PSA) به عنوان یک پروتئین گردشکننده که سطح آن در سرطان پروستات بالا میرود، نمونهای از تبدیل یک نشانگر پروتئینی به ابزار بالینی استاندارد است. امروزه، پنلهای چندگانه پروتئینی در حال توسعه هستند که شامل چندین نشانگر برای تشخیص زودهنگام بیماریهایی مانند سرطان تخمدان، پانکراس و ریه میباشند—که در این موارد، تشخیص زودهنگام تأثیر زیادی در بهبود نتایج درمانی دارد.
۲. پروتئومیکس بالینی در تعیین پیشآگهی بیماری
پروتئومیکس بالینی نقش مهمی در لایهبندی پیشآگهی (Prognostic Stratification) ایفا میکند. این روش به پزشکان کمک میکند شدت بیماری و مسیرهای بالینی محتمل را تخمین بزنند. به عنوان مثال، در سرطان پستان، پروفایلهای پروتئینی میتوانند زیردستههایی نظیر HER2-مثبت، گیرنده هورمونی-مثبت یا تریپل نگاتیو را از یکدیگر متمایز کنند، و این اطلاعات به انکولوژیستها کمک میکند تا درمانهای هدفمند و مؤثر را بر اساس ویژگیهای مولکولی دقیقتر تجویز کنند، نه صرفاً بر اساس مشاهدات بافتشناسی.
در بیماریهای قلبی-عروقی نیز، ترکیبی از پروتئینها که درگیر التهاب، متابولیسم چربی و استرس میوکارد هستند، به عنوان پیشبینیکنندههای چندمنظوره برای نارسایی قلبی یا حوادث قلبی مورد مطالعه قرار میگیرند.
۳. درمان-تشخیص (Theranostics): ترکیب درمان و تشخیص
یکی از تحولات برجسته در پروتئومیکس بالینی، مفهوم تِرانُستیکس (Theranostics) است—ترکیبی از درمان و تشخیص بر اساس نشانگرهای هدفمند. در سرطان کلیه، مطالعات پروتئومیکی نشان دادهاند که پروتئینهای سطح سلولی خاصی میتوانند هم برای پیشبینی پیشآگهی و هم به عنوان هدف درمانی با آنتیبادیهای مونوکلونال مورد استفاده قرار گیرند.
این دوگانگی کاربرد نشان میدهد که پروتئومیکس بالینی چگونه در حال شکل دادن به آینده پزشکی دقیق است—نه تنها در شناسایی درمانهای مؤثر، بلکه در اطمینان از تعامل مستقیم درمان با اهداف مولکولی خاص.
۴. پروتوژنومیکس: همافزایی پروتئومیکس و ژنومیکس
در صنعت داروسازی، شاخهای به نام پروتوژنومیکس (Proteogenomics) به طور فزایندهای به کار میرود که در آن، ترکیب دادههای پروتئومی با اطلاعات ژنومی و ترنسکریپتومی امکان شناسایی نواحی کدکننده ناشناخته یا فرمهای جایگزین پروتئینها را فراهم میسازد. این اطلاعات میتواند اهداف جدیدی برای درمانهای اختصاصی یا ایمنیدرمانی در اختیار محققان قرار دهد، بهویژه در درمان سرطان که با ناهمگونی تومور و تکامل کلونال روبهروست.
۵. توسعه آزمونها و استانداردسازی
برای ترجمه یافتههای تحقیقاتی به ابزارهای تشخیصی، لازم است که آزمونهای پروتئومیکی هدفمند مانند SRM یا PRM توسعه داده شوند. این آزمونها با استفاده از استانداردهای داخلی نشاندار ایزوتوپی، پروتئینهای خاص را در نمونههای بالینی شناسایی میکنند. آزمونها باید از نظر حساسیت، ویژگی، خطی بودن، تکرارپذیری و عدم تداخل اعتبارسنجی شوند تا الزامات قانونی و استانداردهای بالینی را برآورده کنند.
۶. نقش بیوبانکها و بیوپسیهای مایع در پیشرفت پروتئومیکس بالینی
پروژههای بزرگ که شامل بیوبانکها و مطالعات طولی هستند، فرصتهای گستردهای برای کاربردهای پروتئومیکس فراهم کردهاند. پروفایلبرداری پروتئینی همراه با اطلاعات پزشکی ثبتشده در پروندههای الکترونیکی بیماران، به محققان امکان میدهد روند پیشرفت بیماری را از ابتدا دنبال کرده و پیشبینیهایی درباره آغاز یا عود بیماریها انجام دهند.
ظهور بیوپسیهای مایع (Liquid Biopsies)—شامل شناسایی پروتئینهای توموری، وزیکولهای خارجسلولی یا پپتیدهای اصلاحشده در خون یا ادرار—افقهای جدیدی برای تشخیص غیرتهاجمی، پایش درمان و کشف عود زودهنگام بیماری باز کردهاند.
۷. چالشها و همکاریهای چندجانبه
پروتئومیکس بالینی با چالشهایی مواجه است، از جمله نیاز به تکرارپذیری بالا میان آزمایشگاهها، هزینه-اثربخشی بالا برای بهرهبرداری بالینی و هماهنگی با استانداردهای قانونی. همکاری میان دانشگاهها، آزمایشگاههای بالینی، صنعت و سازمانهای نظارتی در حال شکلدادن به چارچوبهای کنترل کیفیت و دستورالعملهای استاندارد هستند تا اطمینان حاصل شود که بیومارکرهای پروتئومیکی میتوانند بهطور ایمن و مؤثر از آزمایشگاه به بالین منتقل شوند.
تحلیل دادههای پروتئومیکی و ابزارهای بیوانفورماتیکی
آزمایشهای پروتئومیکی، دادههایی بسیار گسترده و پیچیده تولید میکنند که برای استخراج بینشهای زیستیِ معنادار از آنها، به تحلیل محاسباتی دقیق و سیستماتیک نیاز است. این تحلیلها شامل تفسیر طیفهای جرمی، شناسایی پپتیدها و پروتئینها، اندازهگیری سطوح بیان، شناسایی و نقشهبرداری از تغییرات پساترجمهای (PTMs)، و تلفیق نتایج با اطلاعات زیستی موجود است. در این میان، ابزارهای بیوانفورماتیکی پیشرفته و چارچوبهای آماری دقیق، نقش مرکزی در تضمین دقت و قابلیت بازتولید یافتههای پروتئومیکی دارند.
۱. موتورهای جستجوی پایگاهداده برای شناسایی پروتئینها
یکی از ارکان اساسی در پردازش دادههای پروتئومیکی، استفاده از موتورهای جستجوی پایگاهدادهای است که طیفهای جرمی پپتیدهای مشاهدهشده را با طیفهای تئوریکی استخراجشده از پایگاههای توالی پروتئینی مقایسه میکنند. ابزارهایی مانند Mascot، SEQUEST، Andromeda و MS-GF+ از سیستمهای امتیازدهی الگوریتمی برای ارزیابی کیفیت تطبیق استفاده میکنند، که به محققان امکان میدهد با اطمینان بالا هویت پروتئینها را استنتاج کنند.
مراحل کلیدی در این فرآیند شامل:
-
تشخیص پیکها (Peak Detection)
-
تفکیک طیفهای پیچیده یا چندگانه (Deconvolution)
-
نسبت دادن یونهای شکستگی (Fragment Ions) به توالی پپتیدی
برای کنترل خطاهایی که ذاتاً در شناساییهای در مقیاس بزرگ وجود دارند، از روشهایی مانند تخمین نرخ کشف کاذب (FDR) از طریق جستجوی پایگاهدادههای تصادفی یا معکوس (Decoy Databases) استفاده میشود. بهطور معمول، آستانه قابل قبول FDR برابر با ۱٪ در نظر گرفته میشود تا اطمینان از اعتبار نتایج حاصل شود.
۲. استنباط پروتئینها از پپتیدها
پس از شناسایی پپتیدها، چالش بعدی، استنباط دقیق از اینکه کدام پروتئینها واقعاً در نمونه وجود دارند، میباشد. زیرا برخی پپتیدها ممکن است در بین چند پروتئین مشترک باشند (به علت شباهت توالی یا ایزوفرمها). پایگاهدادههای پروتئینی ممکن است حاوی توالیهای همولوگ یا واریانتهای حاصل از اسپلایسینگ باشند که این امر کار را پیچیده میکند.
برای حل این مسئله، الگوریتمهای پیشرفته، پروتئینها را بهصورت گروهی (Protein Groups) یا مجموعههای مینیمال (Parsimonious Sets) گروهبندی میکنند تا تفسیر نتایج آسانتر و دقیقتر شود.
۳. تحلیل کمی در پروتئومیکس
برای پروتئومیکس کمی (Quantitative Proteomics)، ابزارهای بیوانفورماتیکی باید ویژگیهای طیفی را به مقادیر قابل اطمینان از میزان بیان پپتید یا پروتئین تبدیل کنند. بسته به روش مورد استفاده، فرآیند پردازش نیز متفاوت است:
-
در روشهای بدون برچسب (Label-Free): زمانهای نگهداری و شدت یونها در میان نمونهها تراز و نرمالسازی میشوند. الگوریتمهایی مانند MaxLFQ برای شناسایی ویژگیها و مقایسه نمونهها استفاده میشوند.
-
در روشهای با برچسب ایزوتوپی مانند SILAC: نسبت بین پپتیدهای برچسبخورده با ایزوتوپ سنگین و سبک، میزان بیان نسبی را نشان میدهد.
-
در روشهایی مانند TMT یا iTRAQ (برچسبهای ایزوباریک): شدت یونهای گزارشگر (Reporter Ions) که در طیفنگاری مرحله دوم (MS/MS) مشاهده میشوند، برای کمیسازی پروتئینها در نمونههای چندگانه به کار میرود. همچنین، نرمالسازی آماری و تصحیح تداخلها برای افزایش دقت ضروری است.
۴. شناسایی و تحلیل تغییرات پساترجمهای (PTMs)
نقشهبرداری از تغییرات پساترجمهای (مانند فسفریلاسیون یا گلیکوزیلاسیون) به تحلیلهای پیچیدهتری نیاز دارد. دادههایی که بهطور خاص برای PTMها غنیسازی شدهاند (مثلاً دادههای فسفوپروتئومیکس)، باید با الگوریتمهایی تحلیل شوند که بتوانند محل دقیق این تغییرات را با اطمینان بالا تعیین کنند.
ابزارهایی مانند PTMProphet و Ascore با استفاده از مدلهای امتیازدهی مبتنی بر یونهای شکستگی و احتمالهای جایگاهمحور، به افزایش دقت و ارزش بیولوژیکی نتایج کمک میکنند—ویژه در مطالعات تنظیمات سلولی و سیگنالینگ.
۵. یکپارچهسازی نتایج با منابع زیستی و مدلسازی شبکهای
پس از شناسایی و کمیسازی، نتایج پروتئومیکی به کمک منابعی مانند:
-
واژگان ژن (Gene Ontology)
-
پایگاههای مسیر زیستی (مانند KEGG، Reactome)
-
شبکههای تعاملات پروتئینی (مانند STRING و BioGRID)
تجزیه و تحلیل میشوند. تحلیلهای غنیسازی (Enrichment Analysis) و مدلسازی شبکهای کمک میکنند تا مسیرهای زیستی، تعاملات مولکولی، و ماژولهای تنظیمی که در شرایط آزمایشی خاص دچار تغییر شدهاند، بهصورت سیستماتیک درک شوند.
۶. ابزارهای تصویری برای درک بهتر دادهها
بصریسازی دادهها نقش مهمی در درک، تفسیر و ایجاد فرضیه دارد. ابزارهایی مانند:
-
نقشههای حرارتی (Heatmaps)
-
نمودارهای آتشفشانی (Volcano Plots)
-
تحلیل مؤلفههای اصلی (PCA)
-
گرافهای شبکهای تعاملی
به درک بهتر روابط میان پروتئینها کمک میکنند. نرمافزارهایی مانند Perseus، Skyline و Cytoscape رابطهای کاربری قدرتمند و قابل استفادهای برای تحلیل آماری و مصورسازی نتایج ارائه میدهند.
۷. اشتراکگذاری داده و استانداردسازی
اشتراکگذاری داده و تعریف استانداردها، ارکان کلیدی در پروتئومیکس مدرن هستند. دستورالعملهای جامعهمحور مانند MIAPE (حداقل اطلاعات مورد نیاز درباره یک آزمایش پروتئومیکی) و پایگاههایی مانند:
-
PRIDE
-
PeptideAtlas
-
MassIVE
اطمینان حاصل میکنند که داده خام، فراداده و فرآیندهای تحلیلی بهصورت شفاف، قابل دسترسی و قابل استفاده مجدد برای سایر محققان باشند. این منابع به شفافیت، بازتحلیلهای ثانویه و قابلیت بازتولید یافتهها کمک میکنند—که از ویژگیهای حیاتی تحقیقات علمی دقیق هستند.
کاربردهای پروتئومیکس در تحقیقات زیستپزشکی
علم پروتئومیکس، انقلابی در تحقیقات زیستپزشکی ایجاد کرده است، زیرا به دانشمندان امکان میدهد ابعاد پویا و عملکردی پروتئوم را در شرایط سلامت و بیماری مطالعه کنند. برخلاف ژنومیکس که تنها نقشهای ایستا از فعالیتهای بالقوه سلولی ارائه میدهد، پروتئومیکس تصویری واقعی و زنده از وضعیت سلول در زمان واقعی ارائه میدهد—اینکه کدام پروتئینها حاضرند، چه مقدار از آنها وجود دارد، کجا قرار دارند، دچار چه تغییرات پساترجمهای شدهاند و با چه پروتئینهایی تعامل دارند.
این سطح از درک برای شناسایی مکانیسمهای بیماری، یافتن نشانگرهای تشخیصی، و کشف اهداف درمانی جدید حیاتی است.
۱. کشف نشانگرهای زیستی (Biomarkers)
یکی از مهمترین نقشهای پروتئومیکس، کمک به کشف نشانگرهای زیستی بیماریها است، بهویژه در بیماریهای پیچیده و چندعاملی مانند سرطان، بیماریهای قلبی-عروقی، و اختلالات عصبی-تخریبی.
با مقایسه الگوهای بیان پروتئینها در بافتهای سالم و بیمار، محققان میتوانند پروتئینهایی را شناسایی کنند که حضور یا تغییر سطح آنها با وضعیت بیماری مرتبط است. برای مثال:
-
کشف آنتیژن اختصاصی پروستات (PSA) برای سرطان پروستات
-
شناسایی پروتئین HER2 برای سرطان پستان
-
یافتن سیتوکینها و کموکینها بهعنوان شاخصهایی برای التهاب و پاسخهای ایمنی
این نشانگرها نهتنها امکان تشخیص زودهنگام را فراهم میکنند، بلکه اطلاعات پیشآگهی و پایش اثربخشی درمان را نیز ارائه میدهند.
۲. پزشکی شخصی (Personalized Medicine)
در حوزه پزشکی فردمحور یا شخصیسازیشده، پروتئومیکس نقش کلیدی در انتخاب درمان متناسب با مشخصات مولکولی هر بیمار دارد.
با مشخص کردن پروفایل پروتئینی تومور یا بافت بیمار، پزشکان میتوانند درمانهایی را انتخاب کنند که هدفشان مسیرهای مولکولی خاصی است. برای نمونه:
-
اگر گیرندههای تیروزینکیناز یا مولکولهای سیگنالدهی خاصی بیشازحد بیان شده باشند، میتوان از داروهای مهارکننده یا آنتیبادیهای مونوکلونال متناسب استفاده کرد.
این رویکرد، اثربخشی درمان را افزایش داده و عوارض جانبی را کاهش میدهد، و مراقبتی دقیقتر و هدفمندتر برای بیمار فراهم میسازد.
۳. بیماریهای عفونی (Infectious Diseases)
در تحقیقات بیماریهای عفونی نیز، پروتئومیکس پیشرفتهای چشمگیری رقم زده است. با این فناوری میتوان:
-
پروتئینهای باکتریایی یا ویروسی که در طی عفونت بیان میشوند را شناسایی کرد
-
مکانیسمهای فرار پاتوژن از سیستم ایمنی را آشکار ساخت
-
پروتئینهای میزبان که در پاسخ به عفونت تغییر میکنند را تحلیل کرد
این اطلاعات برای توسعه واکسن، شناخت بیماریزایی پاتوژن، و یافتن اهداف دارویی جدید بسیار مهم هستند.
در مواقع شیوع بیماریهای عفونی نوظهور، تحلیلهای سریع پروتئومیکی میتوانند توسعه ابزارهای تشخیصی و درمانی را تسریع بخشند.
۴. علوم اعصاب (Neuroscience)
در حوزهی علوم اعصاب، پروتئومیکس دیدگاههای نوینی درباره شبکههای پروتئینی پیچیده در مغز ارائه کرده است—از جمله:
-
رشد مغز
-
پلاستیسیته سیناپسی (قابلیت تغییر اتصالهای عصبی)
-
مکانیسمهای تخریب عصبی
از آنجا که ساختار سلولی و مولکولی مغز بسیار تخصصی و پویاست، دادههای ترنسکریپتومی به تنهایی برای درک کامل کافی نیستند. پروتئومیکس:
-
به شناسایی تجمعات پروتئینی مانند آمیلوئید-بتا و تائو در آلزایمر کمک کرده
-
مسیرهای سیگنالدهی مختلشده در پارکینسون، اماس، و اسکیزوفرنی را شناسایی کرده است
این یافتهها مسیرهایی جدید برای درمان هدفمند و پایش پیشرفت بیماریهای عصبی باز میکنند.
۵. کشاورزی، زیستشناسی گیاهی و محیطزیست
فراتر از سلامت انسان، پروتئومیکس در زیستشناسی گیاهی، کشاورزی، و علوم محیطی نیز کاربرد دارد:
-
در کشاورزی، برای شناسایی پروتئینهای مربوط به پاسخ به تنش، رشد، و مقاومت در برابر عوامل بیماریزا استفاده میشود که در برنامههای اصلاح نژاد و مهندسی ژنتیک کاربرد دارند.
-
در مطالعات محیطی، پروتئومیکس به پایش اثرات آلودگی بر حیات وحش، بررسی سلامت اکوسیستمها، و شناخت تنوع میکروبی و فعالیتهای متابولیکی در اکوسیستمهای طبیعی و مهندسیشده کمک میکند.
۶. توسعه دارو (Drug Development)
در حوزه داروسازی، پروتئومیکس به شرکتهای دارویی کمک میکند تا:
-
مکانیسم اثر داروها را درک کنند
-
اثرات ناخواسته داروها (off-target effects) را شناسایی کنند
-
مسیرهای مقاومت دارویی را کشف کنند
همچنین، در مطالعات فارماکوکینتیک و فارماکودینامیک برای پایش اینکه داروها چگونه بر بیان پروتئینها در طول زمان اثر میگذارند، استفاده میشود. این موضوع برای:
-
تنظیم دوز مصرفی بهینه
-
کاهش سمیت و عوارض جانبی
اهمیت دارد.
در پروتئومیکس بالینی نیز، دادهها برای تقسیمبندی بیماران در کارآزماییهای بالینی (Patient Stratification) استفاده میشوند، بهطوریکه داروها بر روی افرادی آزمایش شوند که بیشترین احتمال بهرهمندی را دارند.
پروتئومیکس کمی و اصلاحات پساترجمهای (PTMs)
در حوزهی پروتئومیکس، توانایی نهتنها در شناسایی پروتئینها بلکه در اندازهگیری دقیق مقدار آنها در شرایط زیستی مختلف، بسیار حیاتی است. پروتئومیکس کمی به پژوهشگران اجازه میدهد تغییرات سطح بیان پروتئینها را در نمونههای مختلف اندازهگیری کنند؛ برای مثال:
-
بافت سالم در مقابل بافت بیمار
-
سلولهای تیمار شده در برابر تیمار نشده
-
آزمایشهای زمانی برای بررسی فرآیندهای زیستی پویا
این رویکرد پایهای برای درک مکانیسمهای بیماری، شناسایی اهداف درمانی، و تفسیر پاسخ سلولی به داروها یا عوامل محیطی است.
روشهای پروتئومیکس کمی
تاکنون تکنیکهای قدرتمندی برای پروتئومیکس کمی توسعه یافتهاند که به دو دسته اصلی تقسیم میشوند:
🔹 روشهای بدون برچسب (Label-Free)
در این روشها، شدت سیگنالهای طیفسنجی جرمی یا شمارش طیفها در چندین نوبت اندازهگیری و مقایسه میشود.
-
مزیت اصلی این روش، سادگی و قابلیت مقیاسپذیری آن است، و برای نمونههای زیاد بسیار مناسب است.
-
اما این روشها میتوانند در معرض نوسانات فنی قرار بگیرند و معمولاً نیاز به تحلیل آماری قوی و راهکارهای نرمالسازی دارند تا مقایسهها دقیق و قابل اعتماد باشند.
🔹 روشهای برچسبدار (Label-Based)
در این روشها، ایزوتوپهای پایدار به پروتئینها یا پپتیدها اضافه میشود تا نمونهها با هم ترکیب و بهطور همزمان تحلیل شوند.
از معروفترین تکنیکهای برچسبدار میتوان به موارد زیر اشاره کرد:
-
SILAC (برچسبگذاری ایزوتوپی در کشت سلولی)
-
iTRAQ (برچسبهای ایزوبار برای سنجش نسبی و مطلق)
-
TMT (برچسبگذاری تاندِم برای سنجش کمی)
این تکنیکها:
-
قابلیت سنجش چندنمونهای (Multiplexing) با بازتولیدپذیری بالا دارند
-
برای طرحهای پیچیده آزمایشی مانند مطالعات زمانی یا مقایسههای بزرگمقیاس بسیار ایدهآل هستند
-
تفاوتهای ظریف ولی مهم در سطح پروتئینها را آشکار میسازند
در نتیجه، درک دقیقتری از عملکرد یا اختلال عملکرد سلولی فراهم میشود.
اصلاحات پساترجمهای (PTMs)
در کنار اندازهگیری کمی پروتئینها، بررسی تغییرات شیمیاییای که پس از ترجمه بر روی پروتئینها اعمال میشوند نیز اهمیت فراوانی دارد. این اصلاحات شامل:
-
فسفریلاسیون (Phosphorylation)
-
استیلاسیون (Acetylation)
-
یوبیکویتیناسیون (Ubiquitination)
-
گلیکوزیلاسیون (Glycosylation)
-
متیلاسیون (Methylation)
-
SUMOylation
PTMها مانند کلیدهای مولکولی عمل میکنند که عملکرد، مکان، پایداری و تعاملات پروتئینها را کنترل میکنند.
فسفروپروتئومیکس (Phosphoproteomics)
این شاخه از پروتئومیکس به مطالعه فسفریلاسیون پروتئینها میپردازد که نقش کلیدی در انتقال سیگنال درونسلولی دارد.
-
با استفاده از طیفسنجی جرمی، نقشهبرداری از مکانهای فسفریلاسیون در کل پروتئوم امکانپذیر است.
-
این اطلاعات تغییرات فعالیت کینازها در پاسخ به محرکها یا داروها را آشکار میسازد.
در تحقیقات سرطان، این دادهها برای بررسی اختلال در مسیرهای سیگنالدهی کینازی که مشخصه بسیاری از سرطانها هستند، بسیار ارزشمند است.
گلیکوپروتئومیکس (Glycoproteomics)
این زمینه به مطالعه پروتئینهای گلیکوزیلهشده میپردازد که نقش مهمی در موارد زیر دارند:
-
شناسایی ایمنی
-
چسبندگی سلولی
-
پاتوفیزیولوژی بیماریها مانند متاستاز سرطان و اختلالات خودایمنی
روشهای غنیسازی PTMها
از آنجا که پپتیدهای اصلاحشده معمولاً غلظت کمی دارند و ممکن است در حضور پپتیدهای اصلاحنشده گم شوند، استفاده از روشهای غنیسازی تخصصی ضروری است:
-
ایمونوافینیتی (استفاده از آنتیبادیهای خاص مانند فسفوآنتیبادیها)
-
کروماتوگرافی با فلزات اکسیدی مانند TiO₂ یا Fe³⁺-IMAC (برای فسفوپپتیدها)
-
افینیتی مبتنی بر لکتیـن (برای گلیکوپپتیدها)
پس از غنیسازی و تحلیل، ابزارهای بیوانفورماتیکی برای محلیابی دقیق نقاط اصلاحشده و تفسیر اهمیت بیولوژیکی آنها استفاده میشوند. این تفسیر اغلب از طریق پایگاههای داده مسیرهای زیستی و مدلهای ساختاری انجام میپذیرد.
اهمیت تحلیل کمی PTMها
تحلیل کمی اصلاحات پساترجمهای، بینشهایی در مورد:
-
حالتهای فعالیت پروتئینها
-
نحوه تنظیم آنها در زمانها و مکانهای مختلف درون سلول
ارائه میدهد.
برای مثال، مقایسه فسفوریلاسیون پروتئینها در اندامکهای مختلف یا در زمانهای متفاوت پس از دریافت محرک میتواند شبکههای تنظیمی پیچیدهای را آشکار کند که در ترنسکریپتومیکس یا حتی پروتئومیکس پایه پنهان میمانند.
این دینامیکهای PTM سرنخهای کلیدی دربارهی نحوهی پاسخ سلولها به استرس، داروها یا تغییر وضعیتهایی مثل رشد، تمایز یا آپوپتوز فراهم میکنند.
ترکیب دادههای PTM با سایر تحلیلها
در سالهای اخیر، ترکیب دادههای مربوط به PTMها با دادههای کمی کلی پروتئینها و تعاملات پروتئینی (interactome)، به ساخت نقشههای مولکولی دقیق از رفتار سلولها منجر شده است.
این نقشهها:
-
گرههای تنظیمی کلیدی و حلقههای بازخوردی را مشخص میکنند
-
فرصتهای جدیدی برای مداخله درمانی فراهم میسازند، بهویژه در بیماریهای پیچیده مانند سرطان، دیابت و اختلالات عصبیتخریبی
پروتئومیکس بالینی و کاربردهای انتقالی
پروتئومیکس، که زمانی ابزاری صرفاً تحقیقاتی محسوب میشد، به سرعت به یکی از ابزارهای قدرتمند در پزشکی بالینی و انتقالی تبدیل شده است. در مرکز توجه پروتئومیکس بالینی، پل زدن میان پژوهشهای مولکولی و مراقبت از بیمار قرار دارد؛ با هدف شناسایی، توصیف و اندازهگیری کمی پروتئینهایی که به عنوان نشانگرهای زیستی (Biomarkers) یا اهداف درمانی در بیماریهای انسانی مطرح هستند.
تمرکز اصلی این حوزه، درک مکانیسمهای بیماری در سطح پروتئینی و تبدیل این دانش به کاربردهای تشخیصی، پیشآگهیدهنده و درمانی قابل استفاده در محیطهای بالینی است.
🔹 نقش کلیدی در کشف نشانگرهای زیستی بیماری
یکی از مهمترین دستاوردهای پروتئومیکس بالینی، کشف نشانگرهای زیستی بیماری است. اینها پروتئینهایی هستند که وجود، نبود، یا تغییر سطح بیانشان با یک وضعیت پاتولوژیک خاص در ارتباط است.
-
برخلاف نشانگرهای ژنومی که تمایل یا آمادگی ژنتیکی برای ابتلا به بیماری را نشان میدهند،
نشانگرهای پروتئینی میتوانند دیدی آنی از فعالیت، پیشرفت یا پاسخ به درمان بیماری ارائه دهند.
به عنوان مثال:
-
افزایش سطح خاصی از پروتئینها در خون، ادرار یا بافتها میتواند نشانهای زودهنگام از سرطان، بیماریهای قلبیعروقی، اختلالات عصبی یا بیماریهای خودایمنی باشد و در نتیجه، تشخیص زودهنگام و مداخله مؤثرتر را ممکن میسازد.
🔹 فرایند کشف نشانگرهای زیستی
فرایند شناسایی نشانگرهای زیستی معمولاً شامل مراحل زیر است:
-
تحلیلهای مقایسهای پروتئومیک بین نمونههای سالم و بیمار (بافت یا مایعات زیستی)،
با استفاده از طیفسنجی جرمی با وضوح بالا -
انجام تحلیلهای آماری برای شناسایی پروتئینهایی که به طور معنیداری بیانشان تغییر کرده
-
اعتبارسنجی این پروتئینها با استفاده از روشهای دقیق و هدفمند مانند:
-
MRM (Multiple Reaction Monitoring)
-
PRM (Parallel Reaction Monitoring)
این تکنیکها حساسیت و اختصاصیت بالایی دارند
-
-
توسعه نشانگرهای تأییدشده به آزمونهای تشخیصی مانند:
-
ELISA
-
ایمونوهیستوشیمی (IHC)
-
یا پلتفرمهای طیفسنجی قابل استفاده در آزمایشگاههای بالینی
-
🔹 نقش محوری در سرطانشناسی (Oncology)
در سرطان، پروتئومیکس بالینی تأثیرگذار و بسیار مهم بوده است؛ چرا که:
-
سرطانها در سطح مولکولی بسیار متنوع و پویا هستند
-
پروتئومیکس این امکان را فراهم میکند تا بیماران سرطانی بر اساس امضای مولکولی طبقهبندی شوند
از دستاوردهای مهم این رویکرد:
-
شناسایی افزایش بیان HER2 در برخی سرطانهای پستان، که اکنون به صورت روتین برای تعیین امکان درمان با trastuzumab (Herceptin) بررسی میشود
-
شناسایی مکانیسمهای مقاومت دارویی، که به پزشکان کمک میکند درمانها را تنظیم یا داروهای نسل بعد را طراحی کنند
🔹 کاربردها در سایر شاخههای پزشکی
فراتر از سرطان، پروتئومیکس در شاخههای دیگر نیز تحولی اساسی ایجاد کرده است:
🧠 در علوم اعصاب (Neurology):
-
در بیماریهای عصبیتخریبی مانند آلزایمر و پارکینسون، پروتئومیکس برای کشف:
-
تجمع غیرعادی پروتئینها
-
تاخوردگی اشتباه پروتئینها
-
و نقص در مسیرهای پاکسازی پروتئینها استفاده میشود
-
-
بررسی پروتئینهای تغییر یافته در مایع مغزی نخاعی یا بافت مغز، به شناسایی نشانگرهای پیشبینیکننده و اهداف درمانی مداخلهگر زودهنگام کمک میکند
🦠 در بیماریهای عفونی (Infectious Diseases):
-
مطالعه تعاملات میزبان و پاتوژن در سطح مولکولی
-
کمک به درک بهتر:
-
فرار ایمنی
-
پاتوجنز
-
طراحی واکسن
-
-
در بیماریهایی مانند COVID-19، پروتئومیکس برای:
-
پروفایلبرداری از سرم بیماران
-
شناسایی نشانگرهای شدت بیماری و پاسخ ایمنی بسیار مؤثر بوده است
-
این اطلاعات به رتبهبندی ریسک بیماران و طراحی درمانهای هدفمند برای گروههای خاص کمک میکند
-
🔹 پایش درمان و پزشکی دقیق (Precision Medicine)
یکی دیگر از کاربردهای حیاتی پروتئومیکس بالینی، در حوزه:
-
پایش دارویی درمان (Therapeutic Drug Monitoring)
-
و پزشکی دقیق است
پروتئومیکس نشان میدهد:
-
چگونه بیماران دارو را متابولیزه میکنند
-
آیا پروتئین هدف به دارو پاسخ میدهد
-
و آیا مکانیسمهای جبرانی فعال میشوند که میتوانند به مقاومت دارویی یا مسمومیت منجر شوند
این اطلاعات برای:
-
شخصیسازی طرحهای درمانی
-
تنظیم دوز داروها
-
و افزایش اثربخشی درمان حیاتی است
همچنین پروتئومیکس میتواند اثرات ناخواسته دارو (Off-target effects) را آشکار کند که منجر به ایمنی بالاتر داروها و طراحی ترکیبات انتخابیتر میشود.
🔹 چالشها و ملاحظات مهم
با وجود پتانسیل عظیم، پروتئومیکس بالینی با چالشهایی نیز مواجه است:
-
استانداردسازی و تکرارپذیری نتایج باید در سطحی بالا باشد تا برای استفاده بالینی قابل قبول باشند
-
نمونههای زیستی انسانی (مثل پلاسمای خون یا نمونههای بافتی) بسیار پیچیدهاند و نیاز به:
-
ابزارهای بسیار حساس
-
و پروتکلهای دقیق آمادهسازی نمونه دارند
-
-
ملاحظات قانونی، اخلاقی (بهویژه درباره دادههای بیمار)
-
و نیاز به همکاری بینرشتهای بین پزشکان، زیستشناسان و متخصصان بیوانفورماتیک از ارکان موفقیت در پیادهسازی بالینی این علم هستند
پروتئوژنومیکس: پلی میان ژنها و پروتئینها
پروتئوژنومیکس یک حوزه نوین و میانرشتهای است که پروتئومیکس، ژنومیکس و ترانسکریپتومیکس را با هم ادغام میکند تا درکی جامعتر از سامانههای زیستی به دست دهد.
-
در حالی که ژنومیکس نقشه زندگی را بهصورت توالی DNA آشکار میکند،
-
و ترانسکریپتومیکس الگوهای بیان ژن را از طریق تجزیه و تحلیل mRNA بررسی میکند،
-
هیچیک از این دو به تنهایی نمیتوانند پیچیدگی ساختار، عملکرد و پویایی پروتئینها را بهطور کامل توصیف کنند.
اینجاست که پروتئوژنومیکس وارد عمل میشود و با ترکیب اطلاعات سطح پروتئینی با دادههای ژنومی، شکاف میان ژن و پروتئین را پر میکند.
این ادغام چندلایه به پژوهشگران امکان میدهد تا:
-
نواحی جدید کدکننده پروتئین را شناسایی کنند
-
جهشهای ژنتیکیای را که بر پروتئوم اثر میگذارند کشف کنند
-
و درک کنند که تغییرات در سطح DNA چگونه به تغییرات در منظره پروتئینی سلول تبدیل میشوند
🔬 کاربرد کلیدی در پژوهشهای سرطان
یکی از اصلیترین کاربردهای پروتئوژنومیکس در تحقیقات سرطان است، جایی که این حوزه:
-
برای شناسایی ناهمگونی تومورها (Tumor Heterogeneity)
-
و کشف اهداف درمانی جدید بسیار ارزشمند بوده است.
تومورها معمولاً حاوی:
-
جهشهای سوماتیک
-
گونههای متفاوت از رونویسی (Splice Variants)
-
و بازآراییهای کروموزومی هستند
که منجر به تولید پروتئینهای غیرطبیعی میشود که در بافتهای سالم وجود ندارند.
این پروتئینها که به نام نئوآنتیژنها (Neoantigens) شناخته میشوند:
-
میتوانند پاسخ ایمنی بدن را تحریک کنند
-
و اهداف امیدوارکنندهای برای ایمونوتراپی سرطان محسوب میشوند.
پروتئوژنومیکس امکان شناسایی و مشخصسازی این نئوآنتیژنها را فراهم میکند، از طریق:
-
تحلیل با طیفسنجی جرمی از نمونههای توموری
-
همراه با توالییابی کل ژنوم یا اگزوم
این رویکرد یکپارچه، امضاهای مولکولی خاص سرطان را آشکار میکند که ممکن است تنها با روشهای ژنومی یا ترانسکریپتومیکی قابل شناسایی نباشند. در نتیجه، تصویری دقیقتر از ساختار مولکولی تومور ارائه میدهد.
🧬 کاربرد در بیماریهای نادر ژنتیکی
فراتر از سرطان، پروتئوژنومیکس در مطالعه بیماریهای ژنتیکی نادر نیز ابزار ارزشمندی است.
زیرا در این بیماریها:
-
روشهای تشخیصی معمول ممکن است ناکارآمد باشند
-
و رابطه ژن-فنوتیپ (Genotype-Phenotype) به خوبی درک نشده باشد
با ترکیب دادههای توالییابی ژنوم با پروفایلهای پروتئومیک از بافت یا سلول بیماران، پژوهشگران میتوانند:
-
عواقب عملکردی جهشها را شناسایی کنند، مانند:
-
اختلال در سنتز پروتئین
-
تخریب نابجای پروتئین
-
یا اصلاحات پساترجمهای
-
این رویکرد به:
-
اعتبارسنجی واریانتهای مظنون به بیماریزایی کمک میکند
-
و دقت تشخیص را افزایش میدهد
در برخی موارد، دادههای پروتئوژنومیکی حتی میتوانند به توسعه درمانهای هدفمند بر اساس پروفایل مولکولی خاص هر بیمار کمک کنند، که نمونهای از پزشکی دقیق (Precision Medicine) است.
🛠️ زیرساخت فنی پروتئوژنومیکس
از لحاظ فنی، اجرای پروتئوژنومیکس نیازمند موارد زیر است:
-
ساخت پایگاههای داده سفارشی از پروتئینها بر اساس توالیهای ژنومی یا ترانسکریپتومی
-
استفاده از این پایگاهها همراه با طیفسنجی جرمی با وضوح بالا برای شناسایی پپتیدهای متعلق به:
-
ایزوفرمهای استاندارد پروتئین
-
و ایزوفرمهای جدید کشفشده
-
برای مدیریت حجم عظیم دادهها و شناسایی دقیق پپتیدها، ابزارهای محاسباتی پیشرفته مورد نیاز هستند، از جمله:
-
الگوریتمهای یادگیری ماشین
-
و نرمافزارهای تطبیق طیفی (Spectral Matching)
با کاهش هزینههای توالییابی و بهبود ابزارهای پردازش داده، انتظار میرود که پروتئوژنومیکس به بخش استاندارد زیستشناسی سامانهای و تشخیصهای بالینی تبدیل شود.
🧩 کشف پپتیدهای حاصل از نواحی غیرکدکننده ژنوم
پروتئوژنومیکس همچنین در شناخت نواحی غیرکدکننده ژنوم نقش مهمی ایفا میکند.
در گذشته، این نواحی بهعنوان "DNA زائد (Junk DNA)" شناخته میشدند،
اما اکنون مشخص شده که بسیاری از آنها پپتیدهای کوچکی تولید میکنند که از نظر عملکردی مهم هستند.
این پپتیدها که تحت عنوان:
-
میکروپروتئینها (Microproteins)
-
یا پپتیدهای حاصل از چارچوبهای باز خوانشی کوچک (sORFs) شناخته میشوند،
در فرایندهایی مانند: -
سیگنالدهی سلولی
-
سوختوساز (متابولیسم)
-
و تنظیم سیستم ایمنی نقش دارند
تحلیلهای پروتئوژنومیکی کشف سیستماتیک این پپتیدها را ممکن میسازد
و آنها را در مدلهای جامعتری از تنظیم ژن و شبکههای تعامل پروتئین وارد میکند.
⚠️ چالشهای موجود در پروتئوژنومیکس
با وجود پتانسیل عظیم، پروتئوژنومیکس با چالشهای فنی و اجرایی روبهروست:
-
محدوده دینامیکی وسیع بیان پروتئینها
-
فراوانی بسیار پایین برخی پپتیدها
-
و وجود اصلاحات پساترجمهای، شناسایی و اندازهگیری دقیق پپتیدها را دشوار میکند
همچنین:
-
ادغام دادههای چند-اُمیکس (Multi-Omics) نیازمند توجه به:
-
کیفیت نمونهها
-
روشهای نرمالسازی
-
و مدلسازی آماری دقیق است
تا اعتبار زیستی (Biological Relevance) و تکرارپذیری نتایج تضمین شود
-
زیستشناسی سامانهای و پروتئومیک شبکهای
زیستشناسی سامانهای نمایانگر یک تغییر بنیادین در علوم زیستی است؛ تغییری که بهجای تمرکز بر روشهای تقلیلگرایانه که اجزای زیستی را بهصورت مجزا بررسی میکنند، به سمت چارچوبهای جامعنگر حرکت میکند که سامانههای زیستی پیچیده را بهعنوان شبکههایی یکپارچه و پویا تحلیل مینمایند. در این چارچوب، پروتئومیک شبکهای نقش محوری دارد؛ زیرا تعاملات و روابط عملکردی بین پروتئینها را درون محیطهای سلولی نقشهبرداری میکند. برخلاف دیدگاه سنتی که پروتئینها را بهصورت منفرد بررسی میکرد، پروتئومیک شبکهای تأکید دارد که پروتئینها در قالب کمپلکسهای چندپروتئینی، مسیرهای پیامرسانی و مدارهای تنظیمی فعالیت میکنند که بهطور مشترک عملکرد زیستی را پیش میبرند.
پایه و اساس پروتئومیک شبکهای بر این اصل استوار است که عملکردهای زیستی حاصل تعامل چندین پروتئین با یکدیگر است، نه صرفاً سطح بیان یک پروتئین خاص. برای مثال، فعالیت یا تأثیر یک پروتئین بر رفتار سلول اغلب به پروتئینهایی که با آن تعامل دارند، زمینه و شرایط آن تعاملات، و زمانبندی تشکیل یا انحلال آن کمپلکسها بستگی دارد. بنابراین، شناسایی شبکههای تعامل پروتئین-پروتئین (PPI)، آبشارهای سیگنالدهی، و ماژولهای پروتئینی همتنظیمشده برای درک فرایندهای فیزیولوژیکی و پاتولوژیکی ضروری است.
برای بررسی این شبکهها، محققان از مجموعهای از روشهای تجربی و محاسباتی استفاده میکنند. تخلیص بههمراه طیفسنجی جرمی (AP-MS) و آزمایش مخمر دو-هیبریدی (Y2H) از جمله روشهای رایج برای شناسایی تعاملات فیزیکی بین پروتئینها هستند. در سالهای اخیر، روشهای برچسبگذاری مجاورتی مانند BioID و APEX محبوب شدهاند؛ زیرا قابلیت شناسایی تعاملات گذرا یا ضعیف را در شرایط واقعی سلولی دارند. دادههای حاصل از این روشها اغلب با ابزارهای مدلسازی شبکهای محاسباتی ترکیب میشوند که میتوانند شبکههای تعاملی را تجسم، شبیهسازی و پیشبینی کنند و بینشی عمیق درباره اصول سازماندهی سیستمهای پروتئومیکی ارائه دهند.
یکی از مؤثرترین کاربردهای پروتئومیک شبکهای در زمینه زیستشناسی بیماریها است. برای مثال، در سرطان، بیماریهای نورودژنراتیو یا اختلالات خودایمنی، اختلال در شبکههای تعامل پروتئینی اغلب عامل بروز فنوتیپهای پاتولوژیک است. با مقایسه شبکههای استخراجشده از بافتهای سالم و بیمار، محققان میتوانند زیرشبکههای اختصاصی بیماری، پروتئینهای کلیدی (هابها) یا مسیرهای سیگنالدهی مختلشده را شناسایی کنند. این یافتهها نهتنها موجب درک دقیقتر از مکانیزم بیماری میشوند، بلکه نشانگرهای زیستی و اهداف دارویی بالقوهای را آشکار میسازند که ممکن است در آنالیزهای سنتی تکژنی یا تکپروتئینی نادیده گرفته شوند.
علاوه بر این، پروتئومیک شبکهای امکان ادغام دادههای چند اُمیکی (multi-omics) را فراهم میکند؛ بهگونهای که دادههای پروتئومیکی با لایههایی همچون ترنسکریپتومیک، متابولومیک و اپیژنومیک ترکیب میشوند تا مدلهای سامانهای از رفتار سلول بازسازی گردد. این مدلها میتوانند پیشبینی کنند که سلولها چگونه به محرکهای خارجی، استرس یا عوامل دارویی واکنش نشان میدهند—که این قابلیت در پزشکی دقیق بسیار باارزش است. برای نمونه، درک اینکه یک جهش ژنی چگونه از طریق شبکههای پروتئینی اثر میگذارد، میتواند ما را در شناسایی مسیرهای جبرانی یاری کند که بهعنوان اهداف درمانی استفاده شوند.
با وجود این مزایا، پروتئومیک شبکهای با چالشهایی نیز مواجه است؛ از جمله وجود نویز در دادهها، ناقص بودن نقشه تعاملات پروتئینی (interactome)، و ماهیت پویای تعاملات پروتئینی وابسته به شرایط و بافت زمانی-مکانی. همه تعاملات کشفشده لزوماً از نظر عملکردی اهمیت ندارند و بسیاری از آنها در شرایط خاصی فعال هستند. همچنین، شناسایی تعاملات در زمانها یا بخشهای مختلف سلول (داینامیک فضایی و زمانی) همچنان یکی از چالشهای فنی مهم است. با این حال، پیشرفتهایی مانند پروتئومیک تکسلولی، پروتئومیک فضایی و نقشهبرداری تعاملی زمانمند در حال رفع این محدودیتها هستند و دقت بیسابقهای در درک ساختار شبکهای پروتئوم ارائه میدهند.
بهطور خلاصه، پروتئومیک شبکهای یکی از ارکان زیستشناسی سامانهای است که چارچوبی قدرتمند برای درک نحوه همکاری پروتئینها در انجام برنامههای پیچیده زیستی فراهم میآورد. با ادغام دادههای تعاملی در مقیاس وسیع با مدلسازیهای سامانهای، این شاخه از علم میتواند ساختار شبکههای سلولی را رمزگشایی کند، مکانیزمهای بیماری را روشن سازد، و فرآیند کشف درمانهای جدید را تسریع بخشد. با ادامه پیشرفتهای تحلیلی و محاسباتی، پروتئومیک مبتنی بر شبکه نقش فزایندهای در زیستشناسی پایه و تحقیقات ترجمهای خواهد داشت.