کتونسازی (Ketogenesis): دلیل و مسیر تولید کتونها
چرا بدن وارد فاز کتونسازی میشود؟ بررسی شرایط فیزیولوژیک و پاتولوژیک
بدن انسان در شرایط مختلف فیزیولوژیک و پاتولوژیک به منظور حفظ هموستاز انرژی و عملکرد مطلوب، وارد فاز کتونسازی میشود. این فرآیند که به عنوان یک مکانیسم تطبیقی در پاسخ به تغییرات در دسترسی به منابع غذایی و نیازهای انرژی بدن شناخته میشود، نقش حیاتی در تامین انرژی جایگزین دارد و میتواند در برخی شرایط، نشانه یا عامل بیماری نیز باشد.
شرایط فیزیولوژیک تحریککننده کتونسازی
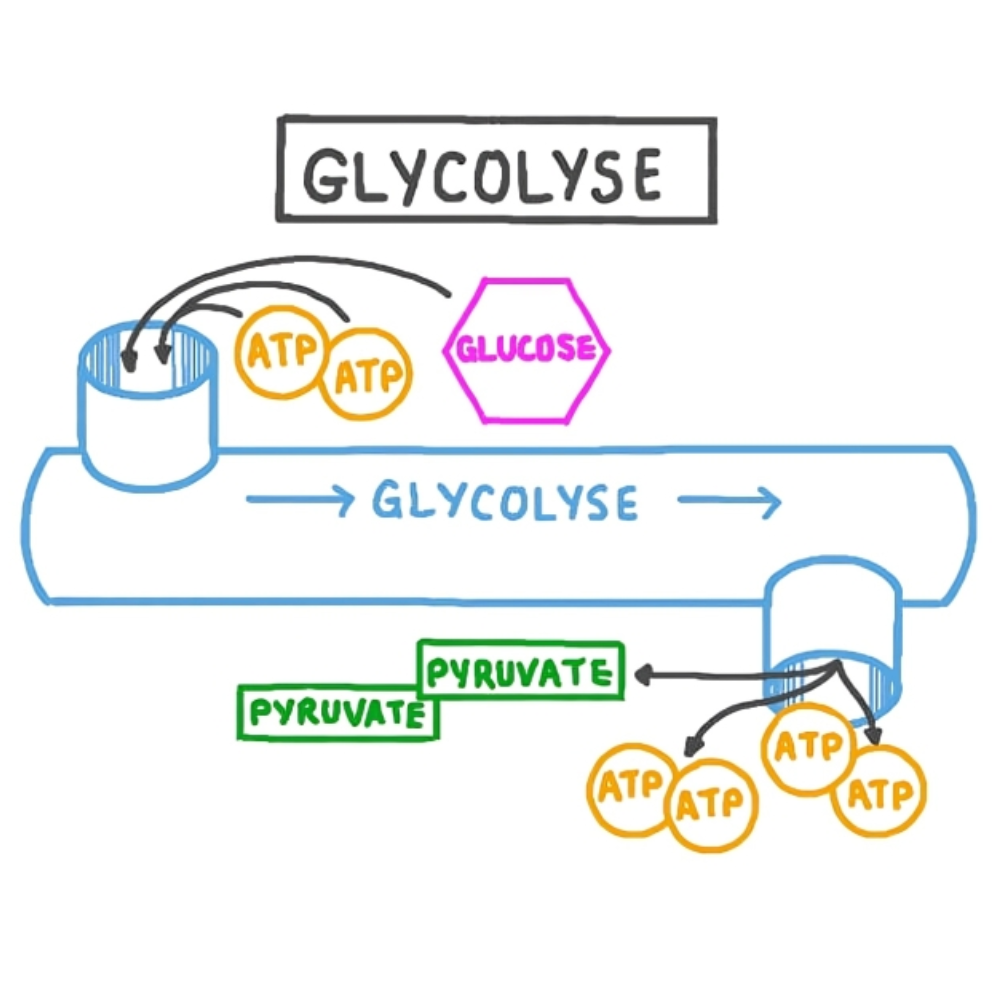
در حالت عادی، گلوکز به عنوان منبع اصلی انرژی برای سلولها مورد استفاده قرار میگیرد. اما در شرایطی که مصرف یا دسترسی به گلوکز محدود شود، بدن به سمت اکسیداسیون اسیدهای چرب و تولید کتونها روی میآورد. برخی از این شرایط عبارتند از:
-
روزهداری و گرسنگی طولانیمدت : کاهش شدید ذخایر گلیکوژن کبدی پس از 12 تا 24 ساعت گرسنگی، باعث فعال شدن مسیرهای متابولیکی جایگزین از جمله کتونسازی میشود. در این حالت، کتونها بهعنوان سوخت اصلی مغز و دیگر اندامهای حیاتی عمل میکنند و از تحلیل عضلانی جلوگیری میکنند.
-
رژیمهای کمکربوهیدرات یا کتوژنیک: رژیمهایی که مصرف کربوهیدرات را به حداقل میرسانند، سطح انسولین را کاهش و میزان لیپولیز چربیها را افزایش میدهند. این شرایط منجر به افزایش اسیدهای چرب آزاد در خون و فعال شدن کتونسازی در کبد میگردد.
-
فعالیت بدنی شدید و طولانی: ورزشهای استقامتی طولانیمدت میتوانند باعث کاهش ذخایر گلیکوژن و افزایش نیاز به سوختهای جایگزین شوند که کتونها یکی از این منابع مهم به شمار میآیند.
-
نوزادی و رشد: در نوزادان، بهخصوص در هفتههای ابتدایی پس از تولد، کتونسازی به دلیل نیاز بالای مغز به سوخت و همچنین کمبود ذخایر گلیکوژن در کبد اهمیت دارد. این مسئله نشاندهنده نقش حیاتی کتونها در متابولیسم رشد است.
شرایط پاتولوژیک مرتبط با کتونسازی
در برخی بیماریها، کتونسازی میتواند بهعنوان یک فرآیند محافظتی یا در مواردی نشانه اختلال متابولیکی عمل کند:
-
دیابت نوع ۱ و کتواسیدوز دیابتی : در دیابت نوع ۱، به دلیل فقدان انسولین یا کاهش شدید آن، کنترل لیپولیز مختل شده و میزان اسیدهای چرب آزاد خون افزایش مییابد. کبد با افزایش کتونسازی سعی در تامین انرژی میکند اما تولید بیش از حد کتونها میتواند باعث اسیدی شدن خون (کتواسیدوز) و بروز عوارض شدید شود.
-
بیماری کبد چرب و اختلالات متابولیک : در بیماریهای کبدی مزمن مانند استئاتوهپاتیت غیرالکلی، اختلال در متابولیسم چربیها و کتونها نقش مهمی دارد. کاهش توانایی کبد در استفاده از کتونها یا تولید بیش از حد آنها میتواند به تشدید بیماری کمک کند.
-
اختلالات ژنتیکی متابولیسم چربی : برخی بیماریهای ارثی که آنزیمهای مربوط به اکسیداسیون اسیدهای چرب یا مسیرهای کتونسازی را تحت تأثیر قرار میدهند، منجر به ناتوانی در تولید یا مصرف کتونها شده و مشکلات جدی متابولیکی ایجاد میکنند.
-
بیماریهای عصبی و مغزی : در برخی بیماریهای عصبی، مانند صرع مقاوم به دارو، رژیمهای کتوژنیک با افزایش کتونسازی میتوانند به بهبود علائم کمک کنند. این موضوع نشاندهنده نقش ویژه کتونها در تنظیم فعالیت عصبی و حفظ سلامت مغز است.
مکانیسمهای تنظیمکننده ورود به فاز کتونسازی
فعال شدن کتونسازی تحت کنترل چندین فاکتور هورمونی و آنزیمی است که در پاسخ به وضعیت تغذیهای و انرژی بدن تغییر میکنند. کاهش سطح انسولین و افزایش هورمونهای کاتابولیک مانند گلکاگون و اپینفرین، از جمله محرکهای اصلی افزایش لیپولیز و ورود اسیدهای چرب به کبد هستند. در مقابل، آنزیم کلیدی کتونسازی، هیدروکسی متیل گلوتاریل کوآنزیم A سنتاز 2 (HMGCS2)، در کبد بهعنوان نقطه کنترل اصلی عمل میکند و فعالیت آن تحت تأثیر تغییرات هورمونی و تنظیم ژنی قرار دارد.
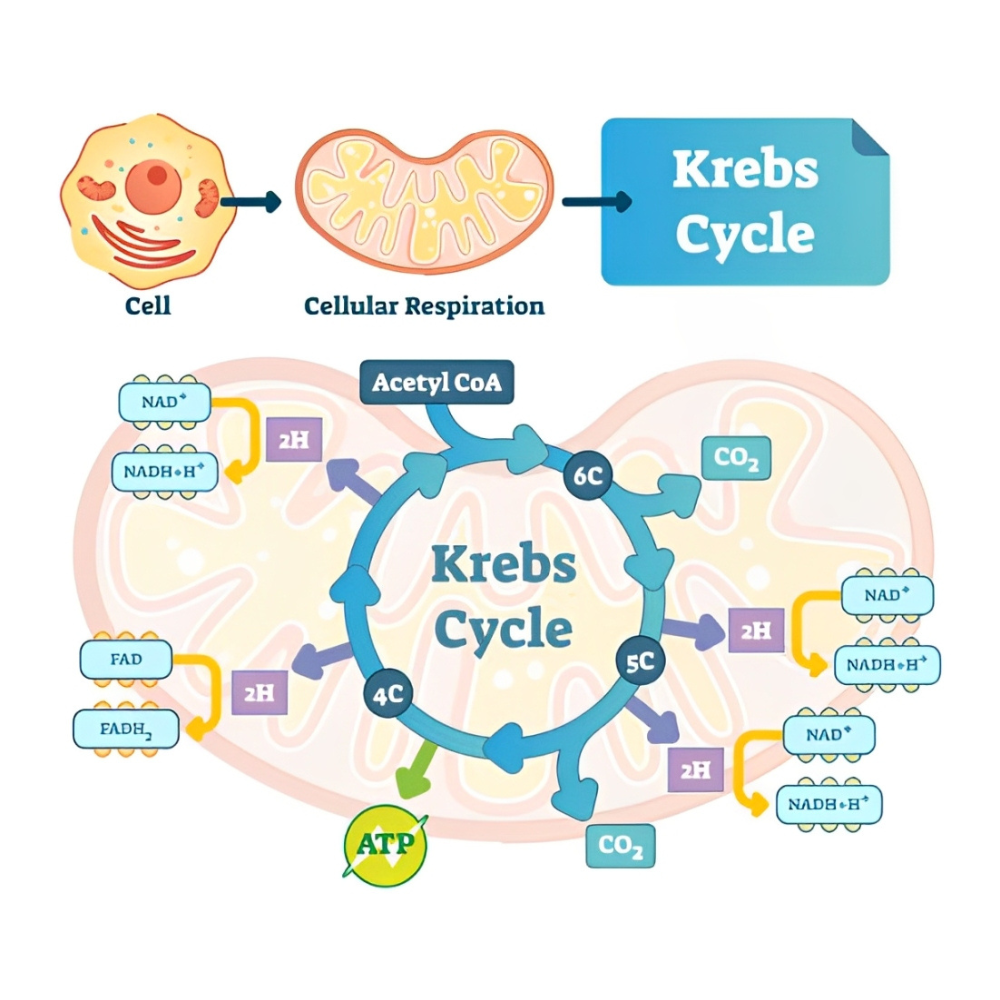
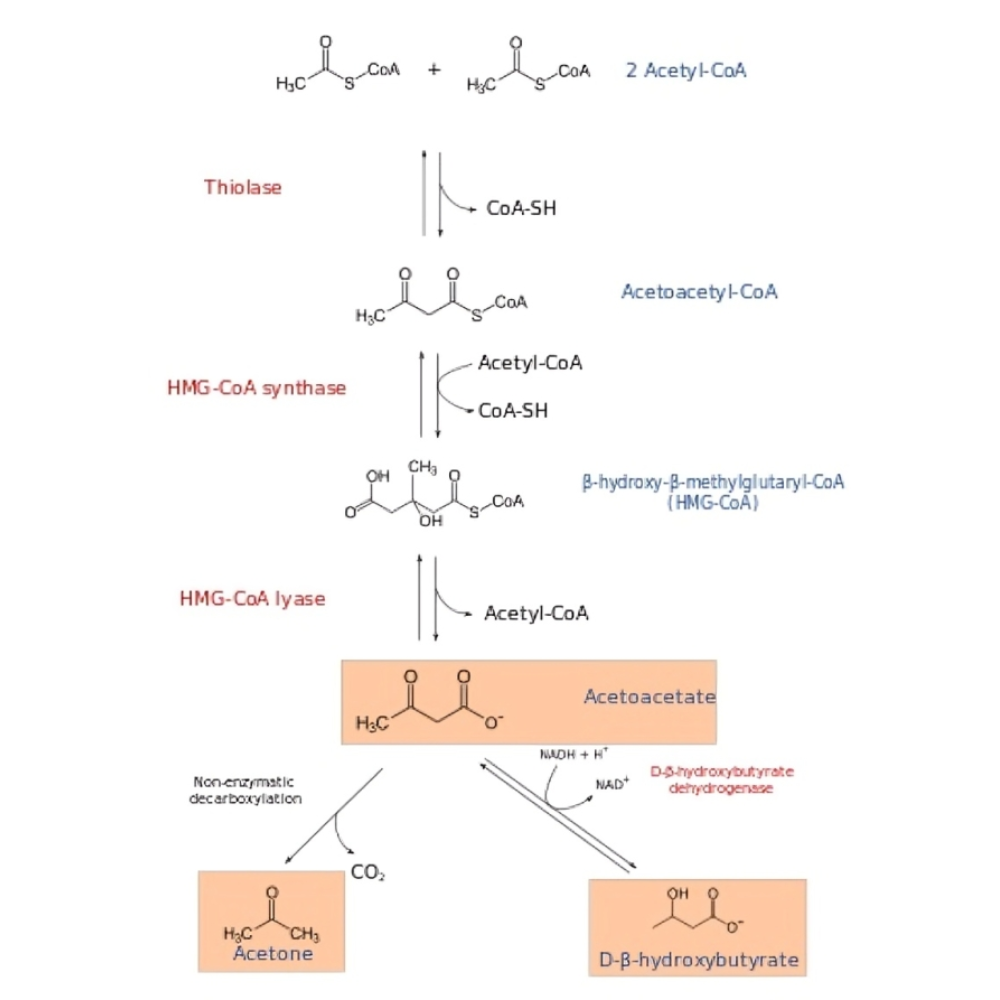
مسیر بیوشیمیایی کتونسازی: از اسیدهای چرب تا تولید کتون
کتونسازی فرآیندی متابولیکی است که عمدتاً در میتوکندریهای سلولهای کبدی انجام میشود و طی آن اسیدهای چرب به کتونها تبدیل میشوند تا به عنوان منبع انرژی جایگزین در شرایط کمبود گلوکز مورد استفاده قرار گیرند. در این بخش به طور مفصل مسیر بیوشیمیایی کتونسازی و مراحل کلیدی آن، آنزیمهای موثر و نقش مولکولهای واسطه پرداخته خواهد شد.
اکسیداسیون اسیدهای چرب و تولید استیل-کوآنزیم A
فرآیند کتونسازی با آزادسازی اسیدهای چرب آزاد از ذخایر چربی (تریگلیسیریدها) در بافتهای چربی آغاز میشود. این اسیدهای چرب پس از انتقال به کبد، وارد میتوکندریها میشوند و از طریق بتا-اکسیداسیون به مولکولهای استیل-کوآنزیم A (استیل-CoA) تجزیه میشوند. این مرحله کلیدی انرژی آزاد شده از اسیدهای چرب را به فرم قابل استفاده برای سنتز کتونها تبدیل میکند.
سنتز هیدروکسی متیل گلوتاریل کوآنزیم A (HMG-CoA)
استیل-CoA تولید شده در میتوکندری کبد، با یکدیگر ترکیب میشوند تا مولکولهای آکeto استیل-CoA و سپس HMG-CoA ساخته شوند. این واکنش توسط آنزیم کلیدی هیدروکسی متیل گلوتاریل کوآنزیم A سنتاز 2 (HMGCS2) انجام میشود که نقطه کنترل اصلی مسیر کتونسازی محسوب میشود.
تجزیه HMG-CoA به استواستات و استیل-CoA
HMG-CoA سپس توسط آنزیم HMG-CoA لیاز به استواستات (Acetoacetate) و استیل-CoA تجزیه میشود. استواستات نخستین کتون بادی آزاد شده در این مسیر است و میتواند به دو مسیر متفاوت هدایت شود:
-
تبدیل به بتا-هیدروکسی بوتیرات (BHB) توسط آنزیم بتا-هیدروکسی بوتیرات دهیدروژناز، که یک کتون بادی پایدار و عمده برای سوخترسانی به مغز و بافتهای دیگر محسوب میشود.
-
یا آزاد شدن مستقیم استواستات به خون، جایی که میتواند بهعنوان منبع انرژی مصرف شود یا به طور طبیعی به استون )یک کتون بادی تبخیری و غیرقابل استفاده) تجزیه گردد.
خروج کتونها به گردش خون و مصرف توسط بافتها
کتون بادیهای تولید شده، عمدتاً بتا-هیدروکسی بوتیرات و استواستات، از کبد به جریان خون ترشح میشوند. این مولکولها توسط بافتهای مختلف از جمله مغز، قلب، عضلات اسکلتی و کلیهها جذب و اکسید میشوند تا به ATP، واحد انرژی سلولی، تبدیل گردند. جالب است که برخلاف گلوکز، کتونها میتوانند در شرایط گرسنگی یا محدودیت کربوهیدرات، سوخت اصلی مغز باشند و به حفظ عملکرد شناختی کمک کنند.
تنظیم مسیر کتونسازی
فعالیت آنزیمهای کلیدی این مسیر تحت کنترل هورمونهایی مانند انسولین و گلکاگون است. انسولین، با کاهش لیپولیز و مهار آنزیم HMGCS2 ، تولید کتونها را کاهش میدهد، در حالی که گلکاگون با افزایش لیپولیز و تحریک آنزیمهای مسیر، کتونسازی را تشدید میکند. علاوه بر این، فاکتورهای محیطی مانند سطح اسیدهای چرب آزاد، نیاز انرژی سلولی و وضعیت تغذیهای بدن نیز بر این مسیر اثرگذارند.
نقش کبد در کتونسازی و تنظیم آن از طریق PPARα و SIRT1
کبد به عنوان مرکز اصلی متابولیسم کتونها در بدن، نقش محوری در تولید، تنظیم و توزیع این منابع انرژی ایفا میکند. فرآیند کتونسازی عمدتاً در میتوکندریهای سلولهای کبدی انجام میشود و تنظیم دقیق این مسیر برای حفظ تعادل انرژی و سلامت متابولیک ضروری است. دو تنظیمکننده مهم این فرآیند، گیرنده فعال شده توسط پروتئین پرولیفراتور آلفا (PPARα) و سرتوئین 1 (SIRT1) هستند که با تنظیم بیان ژنها و فعالیت آنزیمی، میزان کتونسازی را کنترل میکنند.
اهمیت کبد در کتونسازی
کبد تنها عضو بدن است که میتواند کتونها را به صورت عمده تولید کند. این عضو از طریق بتا-اکسیداسیون اسیدهای چرب، استیل-CoA تولید کرده و سپس با مسیرهای بیوشیمیایی که پیشتر شرح داده شد، کتون بادیها را سنتز میکند. در شرایطی مانند گرسنگی طولانیمدت، ورزش شدید، یا رژیمهای کم کربوهیدرات، کبد فعالیت کتونسازی را افزایش میدهد تا انرژی مورد نیاز سایر بافتها به ویژه مغز تأمین شود.
نقش PPARα در تنظیم کتونسازی
PPARα یک فاکتور رونویسی هستهای است که به عنوان سوئیچ اصلی تنظیم متابولیسم چربیها در کبد شناخته میشود. این گیرنده در پاسخ به افزایش اسیدهای چرب آزاد فعال میشود و به تنظیم ژنهای مرتبط با بتا-اکسیداسیون و کتونسازی کمک میکند.
-
فعالسازی ژنهای بتا-اکسیداسیون : PPARα بیان آنزیمهای کلیدی در مسیر اکسیداسیون اسیدهای چرب مانند کاتالاز، کارنیتین پالمیتویل ترانسفراز 1 (CPT1)، و آنزیمهای میتوکندریایی را افزایش میدهد و این روند منجر به تأمین بیشتر استیل-CoA برای کتونسازی میشود.
-
افزایش بیان HMGCS2 PPARα : به طور مستقیم بیان آنزیم محدودکننده مسیر کتونسازی یعنی HMGCS2 را افزایش میدهد و این به افزایش تولید کتونها کمک میکند.
-
تنظیم انرژی متابولیک کلی: علاوه بر تنظیم مستقیم کتونسازی، PPARα نقش مهمی در حفظ تعادل بین سنتز و اکسیداسیون اسیدهای چرب دارد و به این ترتیب تعادل انرژی سلولی حفظ میشود.
نقش SIRT1 در تنظیم کتونسازی
SIRT1 یک دیاستیلاز وابسته به NAD+ است که فعالیت آن به وضعیت انرژی سلول وابسته است و به عنوان حسگر متابولیک عمل میکند. این پروتئین نقش کلیدی در تنظیم متابولیسم انرژی، استرس اکسیداتیو و پیری ایفا میکند.
-
فعالسازی PGC-1α SIRT1 : با دیاستیلاسیون و فعالسازی PGC-1α (کوآکتوراتور گیرنده هستهای)، رونویسی ژنهای مربوط به متابولیسم میتوکندری و بتا-اکسیداسیون را افزایش میدهد که نهایتاً باعث افزایش تولید استیل-CoA و در نتیجه کتونسازی میشود.
-
تنظیم مسیرهای استرس سلولی و انرژی: در شرایط کمبود انرژی، SIRT1 فعال شده و با افزایش ظرفیت تولید انرژی از طریق کتونسازی، سلولها را در مواجهه با استرس حفظ میکند.
-
همکاری با PPARα SIRT1 : میتواند با دیاستیلاسیون PPARα فعالیت آن را تنظیم کند و این تعامل به دقت بالاتری در کنترل مسیر کتونسازی منجر میشود.
ارتباط نقش PPARα و SIRT1 در شرایط مختلف
فعالیت همافزای PPARα و SIRT1 در تنظیم کتونسازی به ویژه در شرایطی مانند گرسنگی، رژیم کتوژنیک و برخی بیماریهای متابولیک حیاتی است. این تنظیم دوگانه تضمین میکند که کبد در پاسخ به نیازهای انرژی بدن، به طور بهینه کتونها را تولید کند.
اهمیت این تنظیمات در بیماریها و کاربردهای درمانی
اختلال در عملکرد PPARα و SIRT1 میتواند منجر به اختلال در کتونسازی و متابولیسم چربیها شود که در بیماریهایی مانند بیماری کبد چرب غیرالکلی، دیابت نوع 2، و سندرم متابولیک مشاهده میشود. از طرفی، هدف گیری این مسیرها در درمان این بیماریها و حتی در کنترل وزن و بهبود عملکرد مغز از طریق رژیمهای کتوژنیک اهمیت یافته است.
تنظیم کتونسازی توسط مالونییل-CoA، انسولین و گلوکاگون
تنظیم مسیر کتونسازی در کبد پیچیده و چندلایه است و به تغییرات مختلف هورمونی و متابولیکی پاسخ میدهد. در این میان، مالونییل-CoA، انسولین و گلوکاگون به عنوان عوامل کلیدی در کنترل ورود اسیدهای چرب به میتوکندری و شروع فرآیند کتون سازی نقش حیاتی دارند. این تنظیمات باعث میشود که در شرایط مختلف فیزیولوژیک و پاتولوژیک، بدن بتواند میزان تولید کتونها را به دقت کنترل کند.
نقش مالونییل-CoA در تنظیم کتونسازی
مالونییل-CoA یک مولکول واسطه کلیدی در متابولیسم اسیدهای چرب است که به دو صورت اصلی در تنظیم کتونسازی عمل میکند:
-
مهار وارد شدن اسیدهای چرب به میتوکندری: مالونییل -CoA به عنوان مهارکنندهی آنزیم کارنیتین پالمیتویل ترانسفراز 1 (CPT1) شناخته میشود. این آنزیم مسئول انتقال اسیدهای چرب بلند زنجیر به داخل میتوکندری است تا بتا-اکسید شوند و در نهایت کتون تولید شود. افزایش سطح مالونییل-CoA باعث کاهش ورود اسیدهای چرب به میتوکندری و در نتیجه کاهش کتون سازی میشود.
-
تنظیم متابولیسم کربوهیدرات و چربی: سطح مالونییل -CoA با وضعیت تغذیهای بدن تغییر میکند. پس از وعده غذایی و در شرایط وجود انسولین بالا، سنتز مالونییل-CoA افزایش یافته و مسیر استفاده از کربوهیدرات به عنوان منبع اصلی انرژی تقویت میشود. در مقابل، در شرایط گرسنگی و کمبود گلوکز، سطح مالونییل-CoA کاهش مییابد که اجازه میدهد اسیدهای چرب وارد میتوکندری شوند و کتونسازی آغاز شود.
تأثیر انسولین در مهار کتون سازی
انسولین یکی از هورمونهای اصلی تنظیمکننده متابولیسم انرژی است که نقش مهمی در کنترل سنتز و استفاده از مواد مغذی ایفا میکند.
-
کاهش بتا-اکسیداسیون اسیدهای چرب: انسولین با تحریک سنتز مالونییل-CoA و افزایش فعالیت آنزیم Acetyl-CoA Carboxylase (ACC) باعث مهار CPT1 میشود و در نتیجه ورود اسیدهای چرب به میتوکندری کاهش یافته و کتونسازی مهار میشود.
-
افزایش ذخیره چربی و مصرف گلوکز: انسولین با تحریک سنتز اسیدهای چرب و گلیکوژن باعث میشود بدن بیشتر از کربوهیدراتها استفاده کند و کمتر به کتونها نیاز داشته باشد.
-
تنظیم در شرایط فیزیولوژیک : پس از وعده غذایی و در حضور انسولین، کبد کتونسازی را کاهش میدهد چون انرژی کافی از طریق گلوکز تأمین میشود.
نقش گلوکاگون در تحریک کتونسازی
گلوکاگون هورمونی است که برعکس انسولین عمل میکند و در شرایط کمبود انرژی و کاهش سطح گلوکز خون فعال میشود.
-
کاهش سطح مالونییل-CoA : گلوکاگون با فعالسازی مسیرهای فسفوریلاسیون و مهار آنزیم Acetyl-CoA Carboxylase باعث کاهش تولید مالونییل-CoA میشود. این کاهش منجر به رفع مهار CPT1 شده و ورود اسیدهای چرب به میتوکندری افزایش مییابد.
-
افزایش بتا-اکسیداسیون و کتونسازی: با تحریک اکسیداسیون اسیدهای چرب، گلوکاگون فرآیند کتونسازی را تقویت میکند تا کبد بتواند انرژی لازم را برای سایر بافتها تأمین کند.
-
تنظیم در شرایط گرسنگی و استرس متابولیک: گلوکاگون در شرایطی مانند گرسنگی، ورزش شدید یا دیابت نوع 1 افزایش یافته و با فعالسازی کتونسازی، تأمین انرژی جایگزین را برای بافتهای وابسته به کتون مانند مغز و عضلات فراهم میکند.
تعامل و توازن بین انسولین و گلوکاگون
تنظیم کتونسازی بیشتر بر اساس نسبت انسولین به گلوکاگون در خون صورت میگیرد. این نسبت به عنوان شاخصی برای وضعیت تغذیهای و انرژی بدن عمل میکند:
-
نسبت انسولین به گلوکاگون پایین (مثلاً در گرسنگی یا ورزش طولانی) موجب افزایش کتونسازی میشود.
-
نسبت انسولین به گلوکاگون بالا )پس از وعده غذایی یا در شرایط انسولین درمانی) باعث مهار کتونسازی میشود.
این تعادل باعث میشود که کبد بتواند به سرعت واکنش نشان داده و متناسب با نیاز انرژی بدن، میزان تولید کتونها را تنظیم کند.
انواع اجسام کتونی و کاربردهای متابولیک آنها در مغز، قلب و عضلات
در فرآیند کتونسازی، سه نوع اصلی جسم کتونی تولید میشود که هر کدام نقشهای متابولیکی متفاوت و مهمی در بدن ایفا میکنند. این اجسام کتونی شامل استواستات (Acetoacetate)، بتاهیدروکسیبوتیرات (β-Hydroxybutyrate) و استون (Acetone) هستند. هر یک از این اجسام کتونی به طرق مختلف در بافتهای مختلف مانند مغز، قلب و عضلات به عنوان منابع انرژی به کار گرفته میشوند.
استواستات (Acetoacetate)
استواستات اولین جسم کتونی است که در کبد سنتز میشود و از اسیدهای چرب حاصل میآید. این مولکول به راحتی در جریان خون منتشر شده و به بافتهای مختلف منتقل میشود.
-
منبع انرژی قابل قبول : استواستات پس از ورود به سلولهای بافتهای مختلف به دو مولکول استیل-CoA تبدیل شده و وارد چرخه کربس (TCA) میشود تا انرژی تولید کند.
-
نقش در مغز : استواستات یکی از منابع انرژی جایگزین برای مغز است، به ویژه در شرایطی که گلوکز محدود است، مانند گرسنگی یا رژیمهای کم کربوهیدرات.
بتاهیدروکسیبوتیرات (β-Hydroxybutyrate)
بتاهیدروکسی بوتیرات رایجترین و اصلیترین جسم کتونی قابل استفاده در بدن است که حدود 70٪ از اجسام کتونی خون را تشکیل میدهد.
-
سادهترین منبع انرژی برای مغز : این جسم کتونی به دلیل حلالیت بالا و توانایی عبور آسان از سد خونی-مغزی، منبع انرژی مهمی برای مغز در شرایط کاهش گلوکز است.
-
ضد التهاب و محافظت عصبی : مطالعات نشان دادهاند که بتاهیدروکسیبوتیرات میتواند با کاهش استرس اکسیداتیو و التهاب، نقش محافظتی در نورونها ایفا کند و حتی در برخی بیماریهای عصبی مزمن مانند بیماری آلزایمر و پارکینسون مفید باشد.
-
در قلب و عضلات: این جسم کتونی همچنین به عنوان سوخت مؤثر برای عضلات و قلب عمل میکند و مصرف آن در میتوکندری سلولهای قلب باعث افزایش بازده انرژی میشود، به ویژه در شرایط استرس متابولیک یا کاهش تامین گلوکز.
استون (Acetone)
استون یکی از اجسام کتونی است که به میزان کمتری تولید میشود و نسبت به دو جسم کتونی دیگر کمتر در متابولیسم سلولی مصرف میشود.
-
حذف از طریق تنفس و ادرار: استون نسبتاً ناپایدار است و عمدتاً از طریق ریهها به صورت تنفس و کمی از طریق ادرار دفع میشود. به همین دلیل استون معمولاً به عنوان شاخصی در تشخیص کتواسیدوز و میزان کتون در خون به کار میرود.
-
کاربرد محدود: برخلاف استواستات و بتاهیدروکسیبوتیرات، استون نقش متابولیکی قابل توجهی ندارد و بیشتر به عنوان یک محصول فرعی محسوب میشود.
کاربردهای متابولیکی اجسام کتونی در بافتهای مختلف
مغز
-
مغز در شرایط نرمال بیشتر از گلوکز برای تأمین انرژی استفاده میکند، اما در هنگام گرسنگی، روزه داری یا رژیمهای کم کربوهیدرات، بتاهیدروکسیبوتیرات و استواستات به عنوان منابع انرژی جایگزین به سرعت جایگزین گلوکز میشوند.
-
این توانایی به مغز اجازه میدهد که در شرایط محدودیت گلوکز به فعالیت خود ادامه دهد و از آسیب ناشی از کمبود انرژی جلوگیری کند.
قلب
-
قلب یکی از بافتهایی است که بیشترین انعطاف پذیری متابولیکی را دارد و میتواند به راحتی بین چربیها، گلوکز و اجسام کتونی سوئیچ کند.
-
در شرایطی مانند گرسنگی یا بیماریهای قلبی، استفاده از اجسام کتونی به عنوان منبع انرژی ترجیح داده میشود، زیرا کتونها مصرف اکسیژن کمتری نسبت به اسیدهای چرب نیاز دارند و بازده انرژی بهتری دارند.
عضلات اسکلتی
-
عضلات نیز در شرایط استرس متابولیکی و ورزش شدید از اجسام کتونی استفاده میکنند.
-
مصرف کتونها توسط عضلات باعث حفظ ذخایر گلیکوژن میشود و میتواند به بهبود عملکرد ورزشی کمک کند.
-
همچنین، اجسام کتونی به عنوان منبع انرژی کارآمد برای عضلات، به کاهش خستگی و بهبود ریکاوری پس از ورزش کمک میکنند.
تفاوت کتوز تغذیهای و کتوز ناشی از گرسنگی یا بیماری
کتوز به حالتی گفته میشود که در آن سطح اجسام کتونی در خون افزایش مییابد. این وضعیت میتواند به دلایل مختلفی ایجاد شود که در نهایت به دو دسته اصلی کتوز تغذیهای و کتوز ناشی از گرسنگی یا بیماری تقسیم میشود. شناخت تفاوتهای این دو حالت از نظر مکانیسم ایجاد، پیامدهای فیزیولوژیک و خطرات بالینی اهمیت زیادی دارد.
کتوز تغذیهای: حاصل رژیمهای کم کربوهیدرات و کتوژنیک
کتوز تغذیهای یا کتوز رژیمی معمولاً به دلیل کاهش چشمگیر مصرف کربوهیدراتها و افزایش مصرف چربیها ایجاد میشود. رژیمهای کتوژنیک، که در آن مصرف کربوهیدراتها به کمتر از 50 گرم در روز محدود میشود، منجر به افزایش تولید اجسام کتونی میگردد.
-
مکانیسم: کاهش سطح گلوکز و انسولین در خون باعث میشود که بدن چربیها را بیشتر به عنوان منبع انرژی مصرف کند و کبد روند کتونسازی را فعالتر کند.
-
سطح کتونها: معمولاً در این حالت سطح اجسام کتونی خون به اندازهای افزایش مییابد که انرژی کافی برای مغز و سایر اندامها تأمین شود، اما سطح کتونها آنقدر بالا نمیرود که باعث اسیدیته خون شود.
-
اثرات فیزیولوژیک : کتوز تغذیهای برای بسیاری از افراد سالم ایمن است و حتی در درمان برخی بیماریها مانند صرع مقاوم به دارو یا چاقی مفید شناخته شده است.
-
کنترل و تنظیم: انسولین به رغم کاهش، هنوز به مقدار کافی در خون حضور دارد تا تولید کتونها را کنترل کند و از افزایش بیش از حد آنها جلوگیری کند.
کتوز ناشی از گرسنگی یا روزهداری طولانی
در شرایطی که بدن به مدت طولانی به منابع انرژی خارجی دسترسی ندارد، مانند گرسنگی طولانی مدت یا روزهداری، کتونسازی به عنوان مکانیزم بقا فعال میشود.
-
مکانیسم : با کاهش شدید گلوکز و انسولین و افزایش هورمونهای کاتابولیک مانند گلوکاگون، کبد تولید اجسام کتونی را به منظور تأمین انرژی جایگزین به شدت افزایش میدهد.
-
سطح کتونها: در این حالت سطح کتونیها میتواند تا حدی بالا رود که هنوز از نظر فیزیولوژیک ایمن است ولی در شرایط بسیار طولانی یا شدید ممکن است به سطوح خطرناک نزدیک شود.
-
اثرات فیزیولوژیک : کتوز ناشی از گرسنگی سازگاری طبیعی بدن است و باعث حفظ انرژی و حفاظت از بافتهای حیاتی میشود، به ویژه مغز.
-
ریسکها: اگر گرسنگی بسیار طولانی یا شدید باشد، ممکن است کاهش بیش از حد مواد مغذی و الکترولیتها ایجاد مشکلات جدی کند.
کتوز پاتولوژیک: کتواسیدوز دیابتی و سایر بیماریها
کتوز پاتولوژیک به حالتی گفته میشود که در اثر بیماریهای خاص مانند دیابت نوع 1 یا نارسایی متابولیکی، تولید اجسام کتونی به شکلی کنترل نشده افزایش مییابد.
-
مکانیسم : در دیابت نوع 1، به دلیل کمبود انسولین، کنترل کتونسازی از دست خارج میشود و کبد به طور غیرقابل کنترلی اجسام کتونی تولید میکند.
-
سطح کتونها و اسیدیته : سطح اجسام کتونی در خون بسیار بالا میرود و باعث اسیدی شدن خون (کتواسیدوز) میشود که یک وضعیت اورژانسی و تهدیدکننده زندگی است.
-
علائم بالینی: تهوع، استفراغ، درد شکم، تنفس عمیق و بوی میوهای در تنفس (بوی استون) از علائم شایع این حالت هستند.
-
اهمیت تشخیص: تشخیص سریع و درمان مناسب میتواند از عوارض شدید و مرگ جلوگیری کند.
خلاصه مقایسهای
|
کتوز تغذیهای |
کتوز ناشی از گرسنگی |
کتوز پاتولوژیک (کتواسیدوز) |
ویژگی |
|
رژیم کتوژنیک، کم کربوهیدرات |
روزهداری طولانی، گرسنگی |
کمبود انسولین، دیابت نوع 1 |
علت اصلی |
|
پایین اما قابل کنترل |
بسیار پایین |
بسیار پایین یا صفر |
سطح انسولین |
|
متوسط و ایمن |
بالا ولی کنترل شده |
بسیار بالا و خطرناک |
سطح اجسام کتونی |
|
نرمال |
نرمال یا کمی کاهش یافته |
اسیدیته شدید (کتواسیدوز) |
اسیدیته خون |
|
کم، مفید در درمان و کاهش وزن |
سازگار با بدن، ممکن است خفیف باشد |
وضعیت اورژانسی و تهدیدکننده زندگی |
پیامدها و خطرات |
اثرات کتونسازی در کنترل وزن و بهبود سندرم متابولیک
کتونسازی که عمدتاً در نتیجه رژیمهای کم کربوهیدرات و کتوژنیک ایجاد میشود، به عنوان یک استراتژی موثر برای کاهش وزن و بهبود عوامل مرتبط با سندرم متابولیک شناخته شده است. این فرآیند نه تنها به کاهش چربیهای ذخیره شده کمک میکند، بلکه تاثیرات مفیدی بر پارامترهای کلیدی سلامت متابولیکی دارد.
کتونسازی و کاهش وزن
-
سرکوب اشتها : اجسام کتونی مانند بتا-هیدروکسیبوتیرات (BHB) نقش مهمی در کاهش احساس گرسنگی دارند. این ترکیبات بر سیستم عصبی مرکزی تأثیر گذاشته و باعث افزایش سیری میشوند، که به کاهش مصرف کالری کمک میکند.
-
افزایش مصرف چربی به عنوان سوخت : با کاهش دریافت کربوهیدراتها و افزایش سطح کتونها، بدن ترجیح میدهد از چربیهای ذخیره شده به عنوان منبع اصلی انرژی استفاده کند. این روند موجب کاهش تدریجی چربیهای انباشته شده در بدن میشود.
-
کاهش انسولین و بهبود حساسیت انسولینی: در رژیمهای کتوژنیک و کتوز تغذیهای، سطح انسولین خون کاهش مییابد که باعث افزایش چربیسوزی و کاهش ذخیره چربی میشود.
نقش کتونسازی در بهبود سندرم متابولیک
سندرم متابولیک مجموعهای از عوامل خطر شامل چاقی شکمی، افزایش فشار خون، مقاومت به انسولین، دیسلیپیدمی و التهاب مزمن است که ریسک بیماریهای قلبی-عروقی و دیابت نوع 2 را افزایش میدهد.
-
کاهش مقاومت به انسولین: کتونها و رژیمهای کتوژنیک موجب بهبود عملکرد انسولین و کاهش مقاومت سلولها به این هورمون میشوند، که کلیدیترین عامل در کنترل قند خون و پیشگیری از دیابت است.
-
کاهش التهاب: اجسام کتونی مانند BHB اثرات ضدالتهابی دارند و مسیرهای التهابی کلیدی را مهار میکنند، که به کاهش التهاب مزمن مرتبط با سندرم متابولیک کمک میکند.
-
بهبود پروفایل چربی خون : مطالعات نشان دادهاند که کتونسازی میتواند موجب کاهش تریگلیسیریدها، افزایش کلسترول HDL )خوب) و بهبود نسبت LDL به HDL شود.
-
کنترل فشار خون: برخی شواهد اولیه نشان میدهند که رژیمهای کتوژنیک میتوانند به تنظیم فشار خون کمک کنند، احتمالاً از طریق کاهش وزن و بهبود عملکرد متابولیکی.
مکانیسمهای مولکولی مرتبط
-
فعالسازی مسیرهای سیگنالدهی: اجسام کتونی میتوانند مسیرهای تنظیم کننده متابولیسم انرژی مانند AMPK و SIRT1 را فعال کنند که در بهبود مصرف انرژی و کنترل وزن نقش دارند.
-
تاثیر بر ژنهای مرتبط با چربیسوزی: کتونها با تنظیم بیان ژنهای مرتبط با اکسیداسیون چربی و تولید انرژی، موجب افزایش سوخت و ساز چربیها میشوند.
کتونسازی به عنوان یک فرآیند متابولیکی نه تنها به کاهش وزن کمک میکند، بلکه از طریق بهبود حساسیت به انسولین، کاهش التهاب و بهبود پروفایل لیپیدی، میتواند نقش مهمی در پیشگیری و درمان سندرم متابولیک ایفا کند. این ویژگیها کتونسازی را به یک ابزار موثر در مدیریت بیماریهای مزمن متابولیک تبدیل کردهاند.
نقش کتونسازی در بیماریهای عصبی و تأثیرات نورولوژیکی رژیم کتوژنیک
کتونسازی و رژیمهای کتوژنیک به طور گستردهای به عنوان روشی نوین و مؤثر در درمان و مدیریت بیماریهای عصبی مختلف شناخته شدهاند. این رژیمها نه تنها به عنوان منبع جایگزین انرژی برای مغز عمل میکنند بلکه اثرات محافظتی و تنظیم کننده متعددی بر عملکرد سیستم عصبی مرکزی دارند.
منابع انرژی جایگزین برای مغز
در شرایط نرمال، مغز عمدتاً از گلوکز به عنوان منبع اصلی انرژی استفاده میکند. اما در مواقع کمبود گلوکز یا شرایط کتوز، اجسام کتونی مانند بتا-هیدروکسیبوتیرات و استواستات به عنوان سوخت جایگزین در مغز به کار گرفته میشوند. این موضوع اهمیت ویژهای دارد، زیرا در برخی بیماریهای عصبی توانایی مغز در استفاده از گلوکز مختل میشود و تامین انرژی از طریق کتونها میتواند عملکرد عصبی را حفظ کند.
تأثیرات ضدالتهابی و آنتیاکسیدانی
اجسام کتونی به ویژه بتا-هیدروکسیبوتیرات دارای خواص ضدالتهابی و آنتیاکسیدانی قوی هستند. این ترکیبات میتوانند مسیرهای التهابی مرتبط با آسیبهای عصبی را مهار کرده و استرس اکسیداتیو را کاهش دهند، که این عوامل در بسیاری از بیماریهای نورودژنراتیو مانند آلزایمر، پارکینسون و صرع نقش مهمی ایفا میکنند.
بهبود عملکرد میتوکندری
میتوکندریها مرکز تولید انرژی سلولی هستند و نقش کلیدی در سلامت نورونها دارند. رژیم کتوژنیک با افزایش بیوسنتز میتوکندری و بهبود عملکرد آنها، موجب افزایش تولید ATP و کاهش تولید رادیکالهای آزاد میشود. این عملکردها میتوانند از مرگ سلولی نورونی جلوگیری کرده و سلامت مغز را بهبود بخشند.
تاثیرات بر بیماری صرع
رژیم کتوژنیک به عنوان یکی از قدیمیترین و اثربخشترین درمانهای غیر دارویی در کنترل صرع مقاوم به دارو شناخته شده است. کتونها میتوانند از طریق تعدیل انتقال دهندههای عصبی، کاهش فعالیتهای تشنجی و بهبود تنظیمات متابولیکی، حملات صرعی را کاهش دهند.
نقش در بیماریهای نورودژنراتیو
مطالعات مختلف نشان دادهاند که کتون سازی میتواند پیشرفت بیماریهای نورودژنراتیو مانند آلزایمر و پارکینسون را کند کند. کتونها با بهبود انرژی رسانی به سلولهای عصبی و کاهش التهاب، به حفظ عملکرد شناختی کمک میکنند و ممکن است روند تخریب عصبی را به تعویق اندازند.
اثرات شناختی و روانشناختی
رژیمهای کتوژنیک در برخی مطالعات بهبود عملکرد شناختی، تمرکز و خلق و خو را نشان دادهاند. این اثرات ممکن است به دلیل بهبود متابولیسم مغز، کاهش التهاب عصبی و افزایش تولید نوروترنسمیترهای خاص باشد.
کتونسازی و رژیم کتوژنیک تأثیرات چشمگیری بر سلامت نورولوژیکی دارند که فراتر از تامین انرژی جایگزین است. این فرآیندها میتوانند به کاهش التهاب، بهبود عملکرد میتوکندری، کنترل صرع و کند کردن پیشرفت بیماریهای نورودژنراتیو کمک کنند. بنابراین، کتونسازی به عنوان یک رویکرد درمانی نوین و امیدوارکننده در زمینه بیماریهای عصبی شناخته میشود.
ارتباط کتونسازی با دیابت، بیماری کبد چرب و مقاومت به انسولین
کتونسازی به عنوان یک فرآیند متابولیکی مهم، نقش قابل توجهی در شرایطی مانند دیابت، بیماری کبد چرب غیر الکلی (NAFLD) و مقاومت به انسولین ایفا میکند. این شرایط متابولیکی پیچیده با اختلالات در سوخت و ساز چربیها و گلوکز همراه هستند که کتونسازی در آنها میتواند هم به عنوان شاخص بیماری و هم به عنوان هدف درمانی مطرح شود.
کتونسازی در دیابت
در دیابت نوع 1 و نوع 2، به خصوص در شرایط عدم کنترل مناسب قند خون، افزایش تولید اجسام کتونی به دلیل کمبود انسولین یا مقاومت به آن رخ میدهد. در دیابت نوع 1، کمبود انسولین موجب افزایش تجزیه چربیها و تولید بیش از حد کتونها شده که ممکن است به کتواسیدوز دیابتی منجر شود؛ وضعیتی که میتواند تهدید کننده حیات باشد.
اما در دیابت نوع 2، کتونسازی کنترل شده و با رژیم کتوژنیک درمانی میتواند مفید باشد. رژیم کتوژنیک با کاهش سطح قند خون، بهبود حساسیت به انسولین و کاهش وزن، میتواند علائم بیماری را بهبود داده و نیاز به داروهای ضد دیابت را کاهش دهد.
نقش کتونسازی در بیماری کبد چرب غیر الکلی
کبد به عنوان مرکز اصلی کتونسازی، در بیماری کبد چرب غیر الکلی که با تجمع چربی در کبد و اختلالات متابولیکی همراه است، نقش کلیدی دارد. تحقیقات اخیر نشان دادهاند که کاهش کتونسازی در کبد میتواند موجب تشدید بیماری شود. به عبارت دیگر، اختلال در مسیرهای کتونسازی ممکن است باعث تجمع چربی و التهاب بیشتر در کبد شود.
از سوی دیگر، تقویت کتونسازی از طریق رژیمهای غذایی خاص یا داروهای تنظیم کننده متابولیسم کبد میتواند به کاهش چربی کبد و بهبود عملکرد آن کمک کند. این تأثیرات ممکن است به واسطه کاهش التهاب و بهبود متابولیسم چربیها باشد.
تاثیر کتونسازی بر مقاومت به انسولین
مقاومت به انسولین یکی از مشکلات اصلی در سندرم متابولیک و دیابت نوع 2 است که با کاهش پاسخ سلولها به انسولین همراه است. مطالعات نشان دادهاند که افزایش کتونسازی میتواند به بهبود حساسیت به انسولین کمک کند. اجسام کتونی به عنوان منابع انرژی مؤثر، میتوانند مصرف گلوکز را کاهش داده و بار متابولیکی بر انسولین را کاهش دهند.
علاوه بر این، برخی مکانیسمهای مولکولی مانند فعال شدن مسیرهای سیگنال دهی PPARα و SIRT1 که در کتونسازی دخیل هستند، میتوانند نقش مستقیمی در بهبود متابولیسم گلوکز و لیپیدها و در نهایت کاهش مقاومت به انسولین داشته باشند.
تعادل بین کتونسازی مفید و مضر
با وجود نقشهای مفید کتونسازی در این بیماریها، افزایش بیش از حد کتونها میتواند مشکلساز باشد. به خصوص در دیابت نوع 1، کتواسیدوز دیابتی یک وضعیت بحرانی است که نیاز به درمان فوری دارد. بنابراین، تنظیم دقیق مسیرهای کتونسازی و مانیتورینگ مداوم سطوح کتونی خون اهمیت بالایی دارد.
کتونسازی در بیماریهای متابولیکی مانند دیابت، بیماری کبد چرب و مقاومت به انسولین نقش دوگانهای دارد. در حالی که افزایش کنترل شده کتونها میتواند به بهبود وضعیت متابولیکی کمک کند، تولید بیش از حد آنها به ویژه در دیابت نوع 1 خطرناک است. شناخت بهتر این تعادل و به کارگیری استراتژیهای درمانی مناسب میتواند تاثیرات درمانی قابل توجهی در مدیریت این بیماریها داشته باشد.
نقش کتونها در سلامت کلیه و قلب: دو لبه شمشیر
کتونها، به عنوان متابولیتهای انرژیزا، نقش مهمی در عملکرد اندامهای حیاتی مانند کلیه و قلب دارند. با این حال، تأثیر آنها در این ارگانها میتواند دوگانه باشد؛ هم میتواند محافظتی و مفید باشد و هم در شرایط خاص به آسیبهای جدی منجر شود. این ویژگی دو لبه شمشیر کتونها، اهمیت بررسی دقیق نقش آنها در سلامت و بیماریهای کلیوی و قلبی را نشان میدهد.
نقش کتونها در سلامت کلیه
کلیهها به طور فعال در تنظیم تعادل اسید-باز، دفع متابولیتها و تنظیم فشار خون نقش دارند. در شرایط کتونزایی، اجسام کتونی به عنوان سوخت جایگزین در کلیه مصرف میشوند و میتوانند منبع انرژی مهمی برای سلولهای کلیوی فراهم کنند. مطالعات نشان دادهاند که کتونها میتوانند در محافظت از کلیهها در مقابل آسیبهای ناشی از استرس اکسیداتیو و التهاب نقش داشته باشند.
با این حال، تجمع بیش از حد کتونها و اسیدی شدن خون (کتواسیدوز) میتواند فشار اضافی بر کلیهها وارد کند و منجر به اختلال عملکرد کلیوی شود. کتواسیدوز مزمن ممکن است باعث آسیب طولانی مدت به بافت کلیه شود و عملکرد فیلتراسیون آن را کاهش دهد.
تأثیرات کتونها بر سلامت قلب
قلب، یکی از اصلیترین مصرف کنندگان انرژی در بدن، از کتونها به عنوان منبع سوخت بهره میبرد، خصوصاً در شرایط محدودیت گلوکز مانند گرسنگی، ورزش شدید یا رژیمهای کتوژنیک. استفاده از کتونها توسط قلب میتواند کارایی متابولیکی آن را بهبود بخشد و در شرایط آسیبهای ایسکمیک یا نارسایی قلبی محافظتی عمل کند.
از سوی دیگر، در برخی شرایط پاتولوژیک، افزایش کتونها میتواند موجب اختلال در عملکرد قلب شود. به ویژه در دیابت کنترل نشده، تجمع کتونها همراه با اسیدیته بالا ممکن است به اختلال ریتم قلبی و افزایش خطر سکته قلبی منجر شود.
مکانیسمهای تنظیمی مشترک
در هر دو ارگان کلیه و قلب، مسیرهای سیگنال دهی و تنظیم متابولیکی مانند فعال سازی گیرندههای PPAR و سیتوکرومهای متصل به کتونها، نقش کلیدی دارند. این مسیرها علاوه بر فراهم کردن انرژی، در تنظیم پاسخهای التهابی و استرس اکسیداتیو نیز مؤثر هستند. تنظیم دقیق این مکانیسمها میتواند نقش تعیین کنندهای در حفظ سلامت و پیشگیری از آسیبهای مزمن داشته باشد.
تعادل در استفاده از کتونها
در نهایت، همانطور که اشاره شد، استفاده از کتونها باید در چارچوب تعادل دقیق و شرایط فیزیولوژیکی بهینه باشد. افزایش کنترلشده کتونها میتواند فواید قابل توجهی برای قلب و کلیه داشته باشد، اما افزایش بیش از حد یا عدم تعادل متابولیکی میتواند آسیبهای جدی ایجاد کند.
کتونها به عنوان منابع انرژی جایگزین، نقش مهمی در حفظ عملکرد کلیه و قلب دارند، اما این نقش دوگانه آنها نیازمند توجه دقیق در شرایط سلامت و بیماری است. درک بهتر مکانیسمهای دخیل و حفظ تعادل مناسب کتونسازی میتواند به توسعه راهکارهای درمانی جدید در بیماریهای کلیوی و قلبی کمک کند.
دیدگاه تکاملی به کتونسازی: تجربه تاریخی انسان و جوامع قطبی
کتونسازی به عنوان یک فرایند متابولیکی، نقش مهم و منحصر به فردی در سازگاری انسانها با شرایط محیطی سخت و منابع غذایی محدود ایفا کرده است. از نگاه تکاملی، این مکانیسم باعث شده تا اجداد انسان بتوانند در دورههای طولانی گرسنگی، سرمای شدید، یا دسترسی ناپیوسته به کربوهیدراتها، بقا و ادامه حیات داشته باشند.
کتونسازی به عنوان استراتژی بقا در تاریخ بشر
در طول تاریخ، انسانها غالباً با دورههای فراوانی و قحطیهای غذایی مواجه بودهاند. در چنین شرایطی، ذخایر گلیکوژن کبدی به سرعت مصرف شده و بدن مجبور میشود برای تأمین انرژی، به منابع چربی متکی شود. تجزیه چربیها و تولید کتونها به عنوان سوخت جایگزین برای مغز و سایر بافتها، موجب حفظ عملکردهای حیاتی میشود. این پاسخ متابولیکی، احتمال بقا را افزایش داده و در فرآیند تکامل حفظ شده است.
مطالعات انسانشناسی و باستانشناسی نشان دادهاند که حتی پیش از کشاورزی گسترده، رژیم غذایی انسانهای اولیه عمدتاً شامل منابع غنی از چربی و پروتئین بوده است و مصرف کربوهیدراتها محدود بوده است. در این شرایط، کتونسازی نقش حیاتی در تأمین انرژی و سلامت مغز داشته است.
تجربه جوامع قطبی با کتونسازی
یکی از بارزترین مثالهای زنده تکامل کتونسازی را میتوان در جوامع قطبی یافت که شرایط محیطی سخت و منابع غذایی محدود به حیوانات چرب و پروتئینمحور است. مردمان این مناطق، مانند اسکیموها و سامیها، به طور طبیعی رژیمهایی با کربوهیدرات پایین و چربی بالا داشتهاند.
تحقیقات نشان دادهاند که بدن این افراد در سازگاری با چنین رژیمهایی، توانسته است به طور مؤثر کتون سازی را افزایش دهد و از کتونها به عنوان منبع انرژی اصلی بهرهمند شود. این سازگاری نه تنها توانایی بقا در شرایط سخت را فراهم کرده، بلکه ممکن است در حفظ سلامت متابولیکی و جلوگیری از بیماریهای مرتبط با متابولیسم نقش داشته باشد.
نقش کتونسازی در تطابق انسان با محیطهای مختلف
از دیدگاه تکاملی، کتونسازی به عنوان یک مکانیسم تطابقی، توانسته است به انسان کمک کند تا در محیطهای متفاوت و شرایط گوناگون زیستی، از جمله دورههای گرسنگی، سرما و فعالیتهای بدنی شدید، به حفظ عملکردهای حیاتی بپردازد. این ویژگی متابولیکی نشاندهنده انعطاف پذیری بالای سیستم انرژی بدن انسان است.
علاوه بر این، نقش کتونها در محافظت مغز و حفظ سلامت سیستم عصبی، ممکن است دلیل دیگری برای حفظ و توسعه این مکانیسم در طول تکامل باشد.
کتونسازی نه تنها یک فرایند بیوشیمیایی ساده، بلکه یک سازگاری تکاملی حیاتی است که به انسان اجازه داده در شرایط دشوار محیطی و غذایی زنده بماند و عملکرد بهینه سیستمهای زیستی خود را حفظ کند. تجربه تاریخی انسان و جوامع قطبی مثالهای واضحی از اهمیت این مکانیسم در بقا و سلامت انسان ارائه میدهد.
بررسی مولکولی اختلالات ژنتیکی مرتبط با نقص در کتونسازی
اختلالات ژنتیکی که مسیرهای کتونسازی را مختل میکنند، میتوانند تأثیرات عمیقی بر متابولیسم انرژی و سلامت کلی بدن داشته باشند. این بیماریها معمولاً به دلیل جهش در ژنهایی که کدکننده آنزیمهای کلیدی مسیر کتونسازی یا متابولیسم اسیدهای چرب هستند، رخ میدهند و منجر به کاهش یا توقف تولید کتونها میشوند.
اختلالات آنزیمی در مسیر کتونسازی
یکی از مهمترین آنزیمهای دخیل در کتونسازی، 3-هیدروکسی-3-متیلگلوتاریل-کوآنزیم A لیاز (HMG-CoA لیاز) است که مسئول مرحله کلیدی تبدیل HMG-CoA به استواستات (یکی از اجسام کتونی) است. جهش در ژن کدکننده این آنزیم باعث بیماری نادر اما شدید به نام کمبود HMG-CoA لیاز میشود.
در این بیماری، تولید کتونها به شدت کاهش یافته و بیمار نمیتواند در شرایط گرسنگی یا استرس متابولیکی به طور مؤثر از چربیها انرژی کسب کند. نتیجه این امر بروز علائم شدید مانند هیپوگلیسمی، کتواسیدوز، مشکلات عصبی و حتی مرگ ناگهانی در دوران کودکی است.
اختلالات در متابولیسم اسیدهای چرب
نقص در آنزیمهای مربوط به ß-اکسیداسیون اسیدهای چرب، مانند نقص در آنزیم اکسیداز بلندزنجیره (VLCAD) یا نقص در دئیدروژناز چندین استیله (MCAD) نیز میتواند به صورت ثانویه مسیر کتونسازی را مختل کند. در این موارد، چربیها به طور کامل تجزیه نشده و تولید پیشمادههای کتون محدود میشود.
این اختلالات معمولاً باعث تجمع اسیدهای چرب و متابولیتهای سمی در خون و بافتها شده و مشکلات شدید متابولیکی از جمله هیپوگلیسمی، اسیدوز متابولیک و نارسایی ارگانها ایجاد میکند.
نقش ژنهای تنظیمکننده مسیر کتونسازی
علاوه بر آنزیمهای مستقیم مسیر، برخی ژنها که نقش تنظیمکننده کتونسازی را بر عهده دارند نیز ممکن است دچار اختلال شوند. برای مثال، ژنهای مربوط به PPARα که تنظیمکننده بیان ژنهای مربوط به ß-اکسیداسیون و کتونسازی است، اگر تغییراتی در آن رخ دهد، میتواند باعث کاهش کارایی مسیر کتونسازی شود.
مشکلات در بیان یا عملکرد پروتئینهای SIRT1 نیز ممکن است توانایی سلولها را در تنظیم متابولیسم انرژی و کتونسازی کاهش دهد، هرچند این موارد کمتر شناخته شدهاند و نیازمند تحقیقات بیشتری هستند.
پیامدهای کلینیکی اختلالات ژنتیکی کتونسازی
نقصهای ژنتیکی در مسیر کتونسازی معمولاً با علائم بالینی شدیدی همراه هستند که در دوران نوزادی یا کودکی بروز میکنند. از جمله علائم متداول میتوان به هیپوگلیسمی، ضعف عضلانی، مشکلات عصبی مانند تشنج و تأخیر رشد اشاره کرد.
تشخیص زودهنگام این اختلالات اهمیت بالایی دارد، چرا که مدیریت درمانی به موقع، از جمله اجتناب از گرسنگی طولانی، تغذیه با کربوهیدرات کافی و در برخی موارد استفاده از درمانهای جایگزین انرژی، میتواند از پیامدهای شدید جلوگیری کند.
اختلالات ژنتیکی که مسیر کتونسازی را تحت تأثیر قرار میدهند، ناشی از جهش در آنزیمها یا ژنهای تنظیمکننده کلیدی هستند و منجر به مشکلات جدی در متابولیسم انرژی میشوند. شناخت دقیق این اختلالات و مکانیسمهای مولکولی آنها، کلید درمان مؤثر و پیشگیری از عوارض خطرناک این بیماریها است.
کاربرد بالینی و دارویی القای کتونسازی: از رژیمدرمانی تا مهارکنندههای SGLT2
القاء کتونسازی به عنوان یک راهکار درمانی در بسیاری از بیماریها و شرایط متابولیکی، توجه گستردهای را به خود جلب کرده است. استفاده از روشهای مختلف برای تحریک تولید اجسام کتونی، از رژیمهای غذایی خاص گرفته تا داروهای نوین، میتواند به بهبود عملکرد سلولی و کنترل بیماریها کمک کند.
رژیم کتوژنیک به عنوان ابزار القای کتونسازی
رژیم کتوژنیک با کاهش شدید مصرف کربوهیدرات و افزایش مصرف چربی، وضعیت بدن را به سمت تولید گسترده اجسام کتونی سوق میدهد. این رژیم به ویژه در درمان صرع مقاوم به دارو در کودکان اثربخشی قابل توجهی داشته و در سالهای اخیر در کنترل بیماریهای متابولیکی مانند دیابت نوع ۲، چاقی و سندرم متابولیک نیز به کار رفته است.
مزیت اصلی این رژیم، فراهم کردن منبع انرژی جایگزین برای سلولها، به ویژه سلولهای مغزی است. این انرژی جایگزین میتواند به کاهش التهاب، بهبود عملکرد شناختی و تنظیم بهتر قند خون کمک کند.
مهارکنندههای SGLT2 و القای کتونسازی
مهارکنندههای SGLT2 (سانتگیرنده سدیم-گلوکز نوع 2) گروهی از داروهای ضد دیابت هستند که با افزایش دفع گلوکز از طریق ادرار، سطح قند خون را کاهش میدهند. یکی از اثرات جانبی مهم این داروها، تحریک کتونسازی است.
با کاهش سطح گلوکز خون، بدن به منظور تأمین انرژی به چربیها روی میآورد و کتونها به عنوان سوخت جایگزین تولید میشوند. این مکانیسم علاوه بر کنترل قند خون، میتواند منجر به کاهش وزن و بهبود وضعیت متابولیکی بیماران دیابتی شود.
کاربردهای درمانی القای کتونسازی در بیماریهای مختلف
القاء کتونسازی با رژیم کتوژنیک یا داروهای مرتبط، کاربردهای درمانی متعددی دارد:
-
در صرع مقاوم به درمان : کاهش تعداد حملات تشنج با تأمین سوخت جایگزین برای مغز.
-
در بیماریهای نورودژنراتیو : بهبود عملکرد شناختی و کاهش پیشرفت بیماریهایی مانند آلزایمر و پارکینسون.
-
در دیابت نوع ۲ و سندرم متابولیک : بهبود حساسیت به انسولین، کاهش وزن و کنترل بهتر قند خون.
-
در اختلالات متابولیکی خاص: مانند برخی از بیماریهای نقص متابولیسم چربی که در آنها القای کتونسازی میتواند به تأمین انرژی سلولی کمک کند.
محدودیتها و عوارض بالقوه
با وجود فواید، القای کتونسازی ممکن است با برخی عوارض همراه باشد، مانند کتواسیدوز دیابتی در بیماران تحت درمان با مهارکنندههای SGLT2 ، یا مشکلات گوارشی و کمبود مواد مغذی در رژیمهای کتوژنیک طولانیمدت.
لذا پایش دقیق پزشکی و تنظیم دقیق دوز داروها و رژیم غذایی از اهمیت بالایی برخوردار است.
تأثیر رژیمهای روزهداری مانند رمضان در تحریک کتونسازی
روزهداری متناوب به عنوان یک الگوی غذایی با فواید متابولیکی شناخته شده است که میتواند به طور طبیعی کتونسازی را تحریک کند. در این میان، روزهداری ماه رمضان یکی از شناختهشدهترین نمونههای روزهداری است که میلیونها نفر در سراسر جهان هر ساله آن را انجام میدهند.
مکانیزم تحریک کتونسازی در طول روزهداری
در طول دوره روزه داری، به ویژه زمانی که دسترسی به غذا قطع میشود، ذخایر گلیکوژن کبدی کاهش مییابد. پس از تخلیه این ذخایر، بدن برای تأمین انرژی مورد نیاز خود به سمت استفاده از چربیها و تولید اجسام کتونی میرود.
این تغییر سوخت و ساز باعث افزایش سطح اجسام کتونی در خون میشود که میتواند به عنوان منبع انرژی جایگزین برای بسیاری از بافتها، به ویژه مغز، عمل کند. این فرآیند به عنوان یک پاسخ فیزیولوژیک طبیعی برای حفظ انرژی در شرایط کمبود غذا محسوب میشود.
روزهداری در رمضان و الگوی کتونسازی
ماه رمضان با الگوی خاص روزهداری از طلوع تا غروب آفتاب، باعث ایجاد نوسانات مشخصی در سطح اجسام کتونی خون میشود. در ساعات پس از شروع روزه (زمان بدون مصرف غذا)، سطح کتونها به تدریج افزایش مییابد و پس از افطار ممکن است کاهش یابد.
مطالعات نشان دادهاند که روزه داری متناوب در رمضان میتواند باعث افزایش موقتی سطح کتونها شود که این موضوع به بهبود حساسیت به انسولین، کاهش التهاب و بهبود عملکرد متابولیکی کمک میکند.
فواید بالقوه تحریک کتونسازی در روزهداری
تحریک کتونسازی در طول روزهداری ممکن است چندین مزیت برای سلامت داشته باشد:
-
کاهش وزن و چربی بدن : افزایش مصرف چربیها به عنوان سوخت اصلی میتواند به کاهش ذخایر چربی کمک کند.
-
بهبود حساسیت به انسولین : کاهش نوسانات قند خون و افزایش استفاده از کتونها باعث بهبود پاسخ سلولها به انسولین میشود.
-
حفاظت نورونها و افزایش سلامت مغز : اجسام کتونی به عنوان سوخت کارآمد برای مغز، نقش محافظتی در مقابل آسیبهای اکسیداتیو و التهاب دارند.
-
کاهش التهاب سیستمیک: کتونها میتوانند مسیرهای التهابی را مهار کنند و به کاهش التهاب مزمن کمک کنند.
نکات مهم در روزهداری و کتونسازی
با وجود مزایای ذکر شده، باید توجه داشت که روزهداری طولانی یا شدید بدون رعایت نکات تغذیهای مناسب ممکن است به کمآبی، کاهش انرژی و مشکلات متابولیکی منجر شود. همچنین، افراد مبتلا به برخی بیماریها باید پیش از شروع روزهداری با پزشک خود مشورت کنند.
تحلیل انتقادی رژیم کتوژنیک: مزایا، محدودیتها و پیامدهای بلندمدت
رژیم کتوژنیک، با تأکید بر مصرف بالای چربیها، پروتئین متوسط و کربوهیدرات بسیار کم، به عنوان یکی از روشهای محبوب برای کاهش وزن و بهبود برخی شرایط متابولیکی مطرح شده است. با این حال، این رژیم در کنار مزایای بالقوهاش، محدودیتها و نگرانیهایی نیز به همراه دارد که در این بخش به صورت انتقادی بررسی میشوند.
مزایای رژیم کتوژنیک
-
کاهش وزن مؤثر و سریع : با محدودیت کربوهیدرات و افزایش مصرف چربی، بدن به سرعت وارد فاز کتوز شده و چربیها را به عنوان منبع اصلی انرژی میسوزاند که منجر به کاهش وزن میشود.
-
بهبود حساسیت به انسولین و کنترل قند خون : بسیاری از مطالعات نشان دادهاند که رژیم کتوژنیک میتواند به بهبود کنترل قند خون در افراد مبتلا به دیابت نوع 2 کمک کند.
-
کاهش التهاب و بهبود برخی بیماریهای عصبی: اجسام کتونی دارای اثرات ضدالتهابی بوده و میتوانند به کاهش علائم بیماریهایی مانند صرع و بیماری آلزایمر کمک کنند.
-
کاهش اشتها و بهبود کنترل اشتها : مصرف چربی و پروتئین بالا باعث احساس سیری طولانیتر شده و میتواند به کاهش مصرف کالری منجر شود.
محدودیتها و نگرانیها
-
تعادل مواد مغذی نامناسب: کاهش شدید مصرف کربوهیدرات ممکن است منجر به کمبود فیبر، ویتامینها و مواد معدنی شود که برای سلامت دستگاه گوارش و عملکرد سیستم ایمنی حیاتی هستند.
-
اثرات جانبی کوتاهمدت : بسیاری از افراد در روزهای اولیه رژیم با عوارضی مانند سردرد، خستگی، تهوع و مشکلات گوارشی مواجه میشوند که به «آنفلوآنزای کتو» معروف است.
-
احتمال افزایش چربیهای اشباع و اثرات قلبی-عروقی : مصرف بالای چربیهای اشباع در برخی افراد ممکن است ریسک بیماریهای قلبی را افزایش دهد، اگرچه دادهها هنوز قطعی نیستند.
-
پایداری پایین رژیم : رعایت سختگیرانه رژیم کتوژنیک در طولانیمدت برای بسیاری دشوار است و ترک رژیم میتواند به بازگشت وزن منجر شود.
پیامدهای بلندمدت رژیم کتوژنیک
مطالعات بلند مدت در زمینه رژیم کتوژنیک هنوز محدود است و پیامدهای طولانی مدت آن به طور کامل شناخته نشدهاند. نگرانیهایی درباره تأثیرات این رژیم بر سلامت کلیه، کبد و متابولیسم استخوانها وجود دارد که نیازمند تحقیقات بیشتر است.
از سوی دیگر، برخی شواهد نشان میدهند که کتونسازی مزمن ممکن است باعث تغییرات در عملکرد هورمونی و متابولیکی شود که اثرات مثبت یا منفی آنها هنوز به طور کامل روشن نیست.
توصیههای نهایی
با توجه به مزایا و محدودیتهای رژیم کتوژنیک، توصیه میشود این رژیم تحت نظر متخصص تغذیه و با توجه به شرایط فردی اجرا شود. همچنین، ترکیب این رژیم با سبک زندگی سالم، فعالیت بدنی منظم و بررسیهای پزشکی منظم میتواند به بهبود نتایج کمک کند.
پرسشهای رایج متخصصان درباره کتونسازی و پاسخ علمی به آنها
در حوزه کتونسازی، به ویژه با افزایش محبوبیت رژیمهای کتوژنیک و کاربردهای درمانی آن، پرسشهای متعددی مطرح میشود که در ادامه مهمترین آنها به همراه پاسخهای علمی ارائه شده است.
آیا کتونسازی فقط در شرایط گرسنگی یا رژیمهای کمکربوهیدرات اتفاق میافتد؟
خیر. کتونسازی در شرایط مختلفی مانند گرسنگی طولانیمدت، ورزش شدید، بیماریهای خاص (مانند دیابت نوع 1) و حتی در برخی شرایط فیزیولوژیک طبیعی، مانند نوزادی و شیردهی، فعال میشود. رژیمهای کمکربوهیدرات یا کتوژنیک تنها یکی از روشهای تحریک این مسیر هستند.
آیا کتونها فقط منبع انرژی برای مغز هستند؟
کتونها نه تنها منبع مهم انرژی برای مغز به ویژه در شرایط کمبود گلوکز هستند، بلکه نقش تنظیمی بر روی عملکردهای سلولی، از جمله کاهش استرس اکسیداتیو و تنظیم بیان ژنها دارند. همچنین قلب، کلیهها و عضلات نیز از کتونها به عنوان سوخت بهره میبرند.
آیا رژیم کتوژنیک برای همه افراد مناسب است؟
خیر. افرادی که دارای بیماریهای خاص مانند نارسایی کبدی یا کلیوی، برخی اختلالات متابولیکی ژنتیکی و زنان باردار هستند باید با احتیاط و تحت نظر پزشک از رژیم کتوژنیک استفاده کنند. همچنین رعایت مداوم این رژیم ممکن است برای برخی افراد دشوار و حتی مضر باشد.
آیا کتونسازی باعث افزایش اسیدیته خون و خطر اسیدوز میشود؟
کتونسازی طبیعی در رژیم کتوژنیک یا گرسنگی کنترل شده معمولاً منجر به اسیدوز نمیشود، زیرا بدن مکانیزمهای تنظیمی قدرتمندی برای حفظ تعادل اسیدی-بازی دارد. اسیدوز کتواسیدوز معمولاً در شرایط پاتولوژیک مانند دیابت نوع 1 رخ میدهد.
آیا مصرف مکملهای کتونساز (کتون بادی) میتواند اثرات رژیم کتوژنیک را تقلید کند؟
مصرف مکملهای کتونساز میتواند به افزایش سریع سطوح کتونها در خون کمک کند، اما به تنهایی نمیتواند تمام مزایای متابولیکی رژیم کتوژنیک را ایجاد کند. رژیم کتوژنیک علاوه بر تولید کتونها، تغییرات گستردهای در متابولیسم انرژی و تنظیم هورمونی ایجاد میکند.
چه ارتباطی بین کتونسازی و کاهش التهاب وجود دارد؟
کتونها با کاهش تولید گونههای فعال اکسیژن و تنظیم مسیرهای التهابی مانند NLRP3 inflammasome نقش ضدالتهابی دارند. این اثرات میتوانند در بیماریهای مزمن التهابی و عصبی مفید واقع شوند.
کتونسازی چگونه میتواند به بهبود عملکرد شناختی کمک کند؟
کتونها سوختی کارآمد برای مغز هستند و میتوانند منجر به افزایش تولید انرژی در نورونها، کاهش آسیب اکسیداتیو و بهبود نورونوترانسمیترها شوند که در مجموع باعث بهبود حافظه، تمرکز و کاهش علائم برخی بیماریهای نورولوژیک میشود.
جمعبندی و چشمانداز آینده پژوهشها در حوزه کتونسازی
در این مقاله، به بررسی جامع فرآیند کتونسازی و نقش کلیدی آن در متابولیسم بدن پرداختیم. کتونسازی به عنوان یک مسیر متابولیکی حیاتی، علاوه بر تأمین انرژی در شرایط کمبود گلوکز، نقشهای مهم تنظیمی و محافظتی در سیستمهای مختلف بدن ایفا میکند. از تأثیرات آن در کنترل وزن و بهبود سندرم متابولیک گرفته تا نقش حیاتی در عملکرد سیستم عصبی، قلب و کلیه، کتونها نشاندهنده پتانسیلهای درمانی فراوانی هستند.
با وجود پیشرفتهای چشمگیر، هنوز بسیاری از جنبههای مولکولی، سلولی و سیستمیک کتونسازی نیازمند بررسی دقیقتر است. فهم بهتر مکانیزمهای تنظیم این مسیر، تعامل آن با سایر مسیرهای متابولیک و اثرات بلندمدت آن بر سلامت انسان، از اولویتهای اصلی تحقیقات آینده به شمار میرود.
از سوی دیگر، توسعه داروهای هدفمند برای القای کتونسازی یا بهبود بهرهوری کتونها در شرایط بیماریهای مزمن مانند دیابت، اختلالات عصبی و بیماریهای قلبی-عروقی، مسیرهای نوینی برای درمانهای شخصیسازیشده باز میکند.
همچنین، بررسی تأثیرات متابولیکی و ایمنی رژیمهای مختلف غذایی و روزهداری، به ویژه در بافتها و جمعیتهای مختلف، میتواند به بهبود راهبردهای تغذیهای و پزشکی کمک کند.
در نهایت، ترکیب تحقیقات پایه با مطالعات بالینی و اپیدمیولوژیک، و بهرهگیری از فناوریهای نوین مانند متابولومیکس و زیستنانو، کلید توسعه دانش عمیقتر و کاربردیتر در زمینه کتونسازی خواهد بود.