پروتئین فسفوریلاسیون؛ نقش در تنظیم سلولی و مسیرهای سیگنالینگ
مقدمه
فسفوریلاسیون پروتئین یکی از مهمترین و حیاتیترین فرایندهای پساترجمهای است که در تنظیم فعالیتهای سلولی نقش کلیدی دارد. این فرایند به معنای اضافه شدن گروه فسفات (PO4) به پروتئینهاست که معمولا توسط آنزیمهای کیناز صورت میگیرد و میتواند ساختار و عملکرد پروتئین هدف را به طور قابل توجهی تغییر دهد. فسفوریلاسیون پروتئین، به عنوان یک سوئیچ مولکولی، امکان فعال یا غیر فعال شدن پروتئینها را فراهم کرده و بدین ترتیب کنترل دقیق مسیرهای سیگنالینگ سلولی، تنظیم چرخه سلولی، تمایز، متابولیسم و پاسخ به محرکهای محیطی را ممکن میسازد.
اولین کشفهای مرتبط با فسفوریلاسیون پروتئین به بیش از پنجاه سال پیش بازمیگردد که طی آن پژوهشگران دریافتند تغییرات شیمیایی در پروتئینها، فراتر از توالی اسیدهای آمینه، نقش مهمی در تنظیم عملکرد سلولی دارد. از آن زمان تاکنون، فسفوریلاسیون به عنوان یک مکانیسم کلیدی در زیستشناسی سلولی شناخته شده و مطالعات گستردهای برای درک بهتر نقش آن در سلامت و بیماری انجام شده است. اهمیت این فرایند در بیماریهایی مانند سرطان، اختلالات عصبی و بیماریهای متابولیک به خوبی اثبات شده است و امروزه هدف بسیاری از درمانهای نوین قرار گرفته است.
در این مقاله، تلاش شده است تا مروری جامع بر روی فسفوریلاسیون پروتئین ارائه شود که تمامی جوانب آن از مکانیسمهای پایهای، نقش در مسیرهای سیگنالینگ، ارتباط با بیماریها، روشهای شناسایی تا کاربردهای درمانی را پوشش دهد. هدف این است که متخصصان حوزه زیستشناسی مولکولی، بیوشیمی، پزشکی و علوم مرتبط پاسخ تمامی سوالات احتمالی خود را در یک منبع کامل بیابند و ضمن افزایش دانش، بتوانند دیدگاههای نوین و کاربردی را در پژوهشها و درمانهای خود به کار گیرند.
مکانیسم فسفوریلاسیون پروتئین
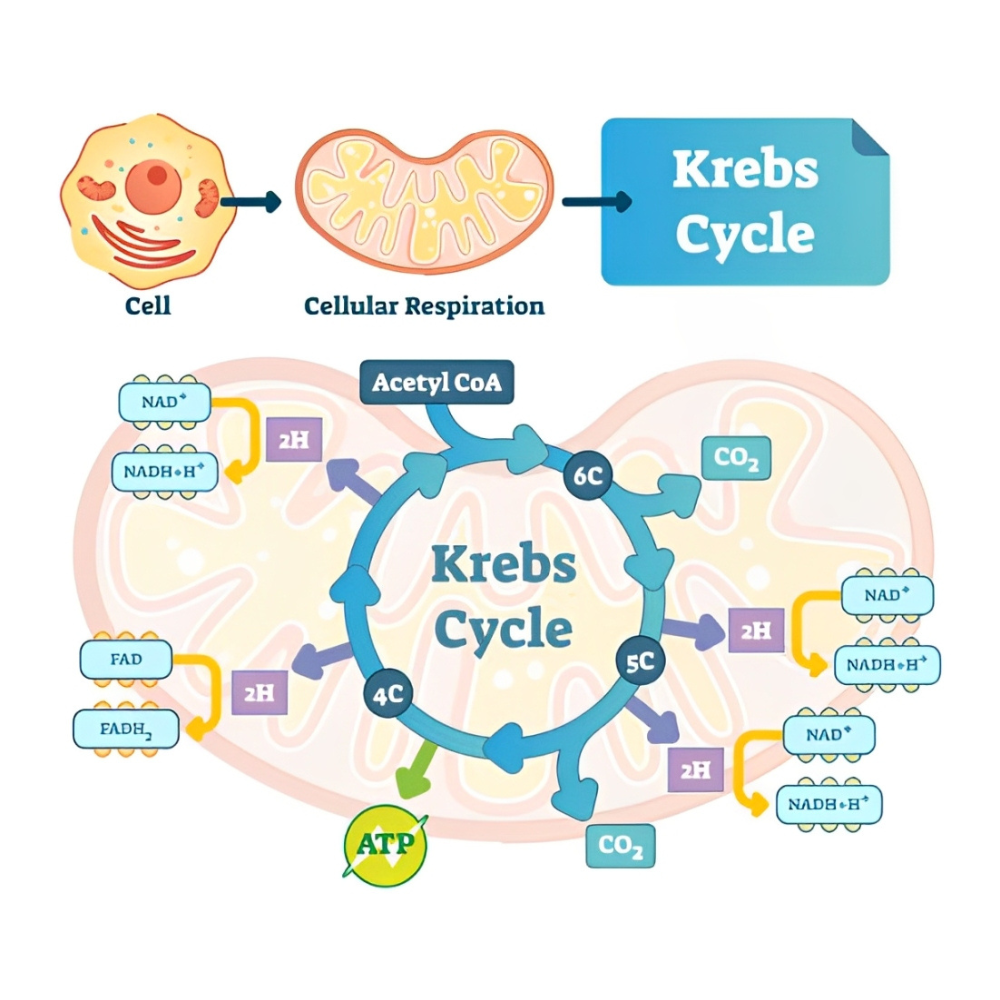
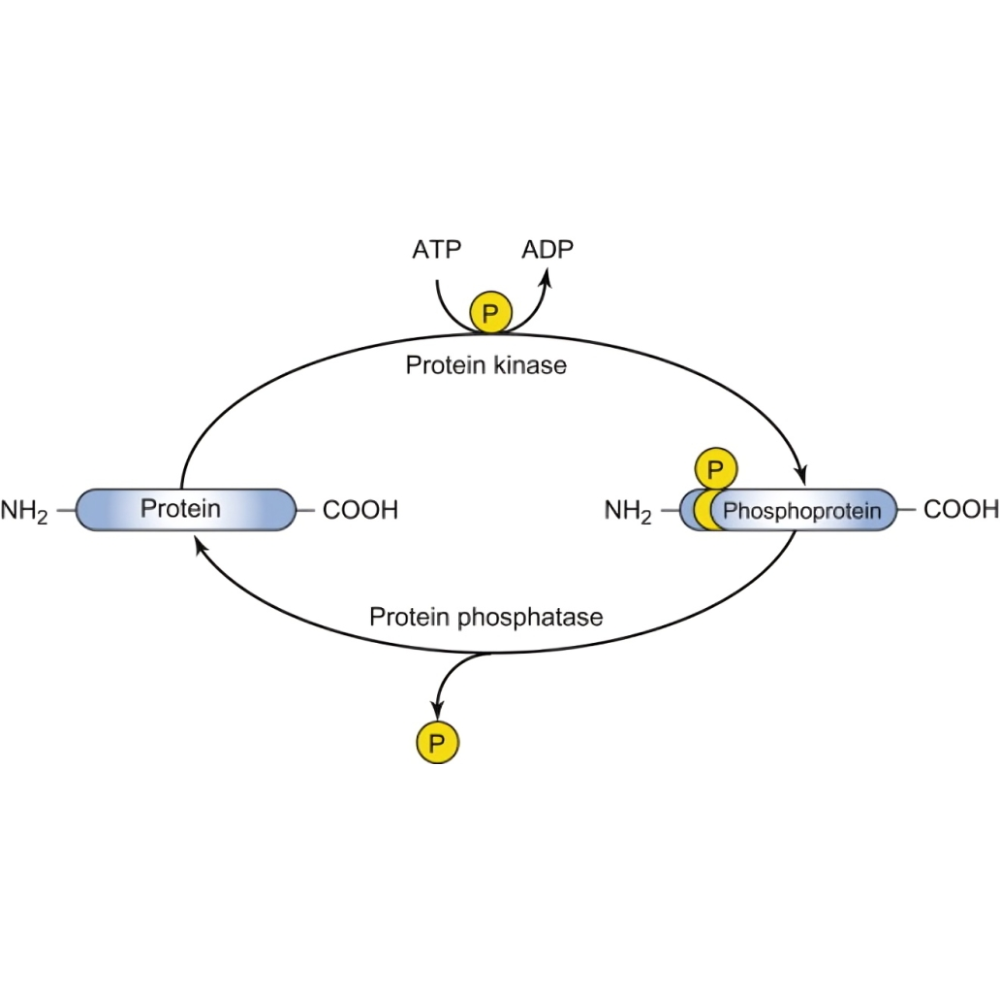
فسفوریلاسیون پروتئین فرایندی است که طی آن گروه فسفات (PO4) به صورت کووالانسی به یک یا چند اسید آمینه خاص در زنجیره پروتئینی متصل میشود. این اتصال معمولاً به واسطه آنزیمهای کیناز صورت میگیرد و میتواند باعث تغییرات ساختاری و عملکردی پروتئین شود. در مقابل، فسفاتازها وظیفه حذف این گروه فسفات را دارند و به این ترتیب فسفوریلاسیون و دفسفوریلاسیون به عنوان یک چرخه پویا، فعالیت پروتئینها را تنظیم میکنند.
اسیدهای آمینه هدف در فسفوریلاسیون معمولاً سرین، ترئونین و تیرونین هستند که در پروتئینهای یوکاریوتی بیشترین میزان فسفوریلاسیون روی آنها رخ میدهد. علاوه بر این، فسفوریلاسیون روی هیستیدین، آسپارتات و آرژنین نیز در برخی موارد دیده میشود، به ویژه در پروکاریوتها. این تنوع در جایگاه فسفوریلاسیون، به سلول امکان میدهد تا کنترلهای بسیار دقیقی بر مسیرهای سیگنالینگ و عملکردهای سلولی داشته باشد.
فرآیند فسفوریلاسیون شامل انتقال گروه فسفات از یک منبع انرژیدار، معمولاً آدنوزین تریفسفات (ATP)، به پروتئین هدف است. آنزیمهای کیناز ابتدا ATP را به ADP تبدیل میکنند و همزمان گروه فسفات را به اسید آمینه هدف متصل میسازند. این واکنش معمولاً در محلهای خاصی از پروتئین که به آنها «سایت فسفوریلاسیون» گفته میشود، اتفاق میافتد و حضور توالیهای کنترلی خاص در اطراف این سایتها باعث شناسایی دقیق توسط کینازها میشود.
فسفوریلاسیون میتواند باعث تغییرات متعددی در پروتئین شود که از جمله مهمترین آنها میتوان به تغییر در ساختار فضایی پروتئین (کنفورماسیون)، تغییر در فعالیت آنزیمی، تغییر در توانایی اتصال به سایر مولکولها و تنظیم محل قرارگیری پروتئین در سلول اشاره کرد. به عنوان مثال، در برخی موارد فسفوریلاسیون باعث فعال شدن پروتئین و در برخی موارد دیگر باعث غیرفعال شدن آن میشود.
این فرایند نقش کلیدی در تنظیم مسیرهای سیگنالینگ داخل سلولی دارد و به سلول امکان پاسخدهی سریع و دقیق به محرکهای خارجی و داخلی را میدهد. به همین دلیل، تنظیم دقیق فعالیت کینازها و فسفاتازها برای حفظ هموستازی سلولی بسیار حیاتی است و اختلال در این تعادل میتواند منجر به بروز بیماریهای مختلف شود.
فسفوریلاسیون در تنظیم مسیرهای سیگنالینگ سلولی
فسفوریلاسیون پروتئین یکی از کلیدیترین مکانیسمها در تنظیم مسیرهای سیگنالینگ سلولی به شمار میآید و نقش حیاتی در انتقال پیامهای زیستی از سطح سلول به داخل آن ایفا میکند. این فرایند به واسطه تغییرات ساختاری و عملکردی پروتئینها، امکان کنترل دقیق و پاسخ سریع سلول به محرکهای محیطی و داخلی را فراهم میسازد.
یکی از مهمترین ویژگیهای فسفوریلاسیون در سیگنالینگ، قابلیت تبدیل سیگنالهای شیمیایی به پاسخهای زیستی مشخص است. وقتی یک پیامرسان مانند هورمون یا فاکتور رشد به گیرندههای سطح سلول متصل میشود، آنزیمهای کیناز فعال شده و به سرعت پروتئینهای خاص را فسفوریله میکنند. این تغییر باعث فعال شدن یا غیرفعال شدن پروتئین هدف و در نتیجه تحریک زنجیرهای از واکنشها میشود که نهایتاً منجر به تغییراتی در رفتار سلول مانند رشد، تمایز، تقسیم یا آپوپتوز میگردد.
مسیرهای سیگنالینگ کلیدی که تحت تاثیر فسفوریلاسیون قرار دارند، شامل مسیر MAPK/ERK، مسیر PI3K/Akt، مسیر JAK/STAT و مسیرهای وابسته به کینازهای پروتئین سرین/ترئونین و تیروزین هستند. به عنوان مثال، در مسیر MAPK/ERK، فسفوریلاسیون متوالی چندین پروتئین باعث انتقال سیگنال از گیرندههای سطحی به هسته سلول شده و تنظیم بیان ژنهای مرتبط با رشد و تکثیر را ممکن میسازد.
علاوه بر این، فسفوریلاسیون به عنوان یک کلید کنترلی، امکان تعامل میان مسیرهای مختلف سیگنالینگ را فراهم میکند که این موضوع به سلول کمک میکند تا پاسخهای پیچیده و متناسب با شرایط محیطی خود داشته باشد. به عنوان نمونه، هم زمانی و تعادل فسفوریلاسیون در مسیرهای PI3K/Akt و AMPK میتواند تعیینکننده وضعیت متابولیکی سلول و پاسخ به استرسهای انرژی باشد.
اختلالات در فسفوریلاسیون پروتئینها میتواند منجر به ناهنجاریهای گستردهای شود که بسیاری از بیماریها مانند سرطان، دیابت، بیماریهای عصبی و اختلالات التهابی را به دنبال دارد. به همین دلیل، مطالعه مسیرهای فسفوریلاسیون و درک دقیق نقش آنها در سیگنالینگ سلولی، اهمیت ویژهای در توسعه درمانهای هدفمند دارد.
در مجموع، فسفوریلاسیون به عنوان یک سوئیچ مولکولی، توانایی تغییر دینامیک عملکردهای سلولی را دارد و به عنوان یکی از پیچیدهترین و حیاتیترین مکانیسمهای تنظیم سلولی شناخته میشود.
فسفوریلاسیون و بیماریها
فسفوریلاسیون پروتئینها یکی از مکانیزمهای کلیدی در تنظیم عملکردهای سلولی است و هرگونه اختلال در این فرآیند میتواند منجر به بروز یا پیشرفت بیماریهای متعدد شود. تغییرات نابجای فسفوریلاسیون ممکن است فعالیت آنزیمها، پروتئینهای ساختاری، یا فاکتورهای رونویسی را تغییر داده و تعادل حساس سیگنالهای درونسلولی را بر هم بزند. این موضوع در بیماریهایی نظیر سرطان، اختلالات نورودژنراتیو، دیابت، و اختلالات التهابی به وضوح مشاهده شده است.
فسفوریلاسیون و سرطان
در سرطان، فسفوریلاسیون غیرطبیعی اغلب نتیجه جهش در ژنهای کینازی یا افزایش بیش فعالی آنها است. برای مثال، در بسیاری از انواع سرطان، مسیرهای سیگنال دهی شامل PI3K/Akt، MAPK/ERK و JAK/STAT بیشفعال میشوند که این امر موجب رشد سلولی کنترل نشده، جلوگیری از آپوپتوز و القای آنژیوژنز میگردد. نمونه شناخته شده این حالت، جهش در گیرندهی تیروزین کیناز HER2 در سرطان پستان است که باعث فسفوریلاسیون پایدار و افزایش سیگنال دهی تکثیر سلولی میشود. همچنین، جهش در ژن BCR-ABL در لوسمی مزمن میلوئیدی (CML) موجب تولید یک تیروزین کیناز پیوسته فعال میگردد که با افزایش فسفوریلاسیون پروتئینها، به پیشرفت بیماری کمک میکند. درمانهای هدفمندی نظیر ایماتینیب (Gleevec) دقیقاً این مسیرهای فسفوریلاسیون را هدف قرار میدهند.
فسفوریلاسیون در بیماریهای نورودژنراتیو
در بیماری آلزایمر، فسفوریلاسیون بیش از حد پروتئین Tau منجر به تشکیل ساختارهای غیرطبیعی به نام فیبریلهای نوروفیبریلاری میشود. این تجمعات در نهایت به مرگ نورونها و کاهش عملکرد شناختی میانجامد. تحقیقات نشان میدهند که تنظیم نادرست فسفوریلاسیون Tau ، به واسطهی فعالیت بیشازحد کینازهایی مانند GSK-3β و CDK5 و کاهش فعالیت فسفاتازهایی مثل PP2A رخ میدهد. به همین دلیل، کنترل دقیق این کینازها و فسفاتازها به عنوان راهکار درمانی در حال بررسی است. در بیماری پارکینسون نیز فسفوریلاسیون غیرطبیعی پروتئین α-synuclein نقش مهمی در ایجاد تجمعات لیوی و پیشرفت بیماری دارد.
فسفوریلاسیون و دیابت
در دیابت نوع ۲، اختلال در فسفوریلاسیون گیرنده انسولین یا پروتئینهای پایین دستی مسیر PI3K/Akt منجر به مقاومت انسولینی میشود. به طور معمول، اتصال انسولین به گیرنده خود منجر به فسفوریلاسیون تیروزین در این گیرنده و فعال شدن مسیرهای متابولیکی میشود، اما در افراد دیابتی، فسفوریلاسیون جایگزین روی باقیماندههای سرین/ترئونین ممکن است فعالیت گیرنده را مهار کند. این نوع فسفوریلاسیونهای ناسالم در نهایت باعث اختلال در جذب گلوکز و هموستاز انرژی میشود.
فسفوریلاسیون و بیماریهای التهابی
در اختلالات خودایمنی و التهابی مانند آرتریت روماتوئید یا بیماری کرون، فسفوریلاسیون نقش دوگانهای دارد. از یک سو با فعالسازی مسیرهای NF-κB و MAPK میتواند تولید سایتوکاینهای التهابی را تحریک کند، و از سوی دیگر میتواند به تنظیم پاسخهای ضدالتهابی نیز کمک نماید. عدم تعادل در این دو مسیر، میتواند موجب تشدید التهاب و آسیب بافتی شود.
فسفوریلاسیون در بیماریهای میتوکندریایی
مطالعات اخیر نشان دادهاند که فسفوریلاسیون پروتئینهای میتوکندریایی نیز با اختلالات متابولیکی و آسیب اکسیداتیو در ارتباط است. برای مثال، در لیپوتوکسیسیته ناشی از دیابت، فسفوریلاسیون غیرطبیعی پروتئینهای زنجیره تنفسی ممکن است به تولید بیش از حد ROS و مرگ سلولی منجر شود.
در مجموع، تغییرات در الگوهای فسفوریلاسیون میتوانند شاخصهایی حساس برای شناسایی زودهنگام بیماریها باشند و فرصتهایی برای مداخلات درمانی دقیق فراهم آورند. درک بهتر این فرآیندها راه را برای توسعهی داروهای هدفمند با عوارض جانبی کمتر هموار میسازد.
ابزارها و روشهای شناسایی و تحلیل فسفوریلاسیون پروتئین
شناسایی دقیق و تحلیل فسفوریلاسیون پروتئینها برای درک عمیق مسیرهای سیگنالینگ و نیز توسعه داروهای هدفمند ضروری است. از آنجا که فسفوریلاسیون اغلب در مقادیر کم و به صورت گذرا اتفاق میافتد، استفاده از روشهای حساس و دقیق در این زمینه اهمیت ویژهای دارد. در ادامه، مهمترین تکنیکها و ابزارهای مورد استفاده برای مطالعه فسفوریلاسیون بررسی میشوند.
الکتروفورز دوبعدی (2D-PAGE ) و رنگآمیزی اختصاصی فسفوپروتئینها
الکتروفورز دوبعدی یکی از روشهای کلاسیک برای جداسازی پروتئینها بر اساس ایزوالکتریک پوینت و وزن مولکولی است. در این روش میتوان از رنگهای اختصاصی مانند Pro-Q Diamond برای شناسایی پروتئینهای فسفریله استفاده کرد. این روش گرچه قدرت تفکیک بالایی دارد، اما در مقایسه با تکنولوژیهای نوین از حساسیت و دقت کمتری برخوردار است.
بلاتگذاری با آنتیبادیهای فسفوریلهشده (Western blot)
یکی از رایجترین روشها برای شناسایی پروتئینهای فسفریله، استفاده از آنتیبادیهای اختصاصی فسفوریلاسیون است. این آنتی بادیها معمولاً به فسفوتیروزین، فسفوسرین یا فسفوترئونین اختصاص دارند. بلات گذاری غربی به ویژه برای تحلیل کمّی سطح فسفوریلاسیون یک پروتئین خاص در شرایط مختلف بیولوژیکی مفید است. هرچند محدودیت این روش در وابستگی به آنتیبادیهای با کیفیت بالا و نیز ناتوانی در بررسی گسترده فسفوسایتهاست.
ایمنواسی (ELISA) و ایمونوهیستوشیمی
ELISA با استفاده از آنتیبادیهای اختصاصی میتواند تغییرات فسفوریلاسیون در شرایط آزمایشگاهی و بالینی را شناسایی کند. همچنین، ایمونوهیستوشیمی با استفاده از برشهای بافتی امکان بررسی مکانی فسفوریلاسیون در درون سلول یا بافت را فراهم میسازد.
کروماتوگرافی مایع با کارایی بالا (HPLC)
HPLC به ویژه هنگامی که با آشکارساز UV یا فلورسانس ترکیب شود، میتواند برای جداسازی و شناسایی پپتیدهای فسفریله به کار رود. اما به دلیل نیاز به مقدار زیاد نمونه و دقت محدود در سطح سایتهای خاص فسفوریلاسیون، امروزه بیشتر برای آماده سازی نمونه در کنار طیفسنجی جرمی استفاده میشود.
طیفسنجی جرمی (Mass Spectrometry)
طیفسنجی جرمی (MS) به عنوان دقیقترین و جامعترین روش برای شناسایی و موقعیتیابی فسفوریلاسیون در پروتئینها شناخته میشود. این روش امکان شناسایی فسفوسایتهای منفرد، بررسی تغییرات فسفوریلاسیون در شرایط مختلف و حتی تحلیل دینامیک فسفوریلاسیون در طول زمان را فراهم میسازد. برای افزایش حساسیت، از روشهایی مانند جداسازی پپتیدهای فسفریله با TiO₂ affinity chromatography یا IMAC (Immobilized Metal Affinity Chromatography) پیش از ورود به دستگاه MS استفاده میشود.
فناوریهای پروتئومیکس فسفوریلاسیون (Phosphoproteomics)
با پیشرفت فناوریهای اومیکس، رویکردهایی مانند phosphoproteomics این امکان را میدهند تا الگوهای فسفوریلاسیون هزاران پروتئین به صورت همزمان بررسی شود. این روشها با استفاده از دستگاههای پیشرفته MS و تحلیلهای بیوانفورماتیکی، امکان ترسیم نقشه کامل از شبکههای سیگنالینگ فسفوریله شده را فراهم کردهاند.
بیوانفورماتیک و پایگاههای داده فسفوریلاسیون
تحلیل دادههای حاصل از MS و سایر تکنیکها به کمک نرمافزارهای بیوانفورماتیکی مانند MaxQuant، Scaffold، یا Perseus انجام میشود. همچنین پایگاههای دادهای مانند PhosphoSitePlus و UniProt اطلاعات ارزشمندی از فسفوسایتهای گزارششده، مسیرهای سیگنالینگ مرتبط و تغییرات آنها در شرایط بیماری ارائه میدهند.
روشهای تصویربرداری زنده سلولی
استفاده از حسگرهای فلورسانس حساس به فسفوریلاسیون، مانند FRET-based biosensors، این امکان را میدهد تا فسفوریلاسیون پروتئینها به صورت زنده و در زمان واقعی درون سلول بررسی شود. این ابزارها بهویژه برای مطالعه دینامیک مسیرهای سیگنالینگ و پاسخ به محرکهای محیطی اهمیت دارند.
در مجموع، انتخاب روش مناسب به هدف مطالعه، نوع نمونه، و حساسیت مورد نیاز بستگی دارد. ترکیب روشهای کلاسیک و فناوریهای پیشرفته مانند طیفسنجی جرمی و بیوانفورماتیک، دیدی جامع و دقیق از الگوهای فسفوریلاسیون فراهم میسازد و راه را برای تحلیلهای عملکردی و بالینی هموار میکند.
نقش فسفوریلاسیون در تنظیم متابولیسم و پاسخ به استرس سلولی
فسفوریلاسیون به عنوان یکی از اصلیترین مکانیسمهای تنظیم پسا ترجمهای، به سلول این امکان را میدهد که بهصورت سریع و قابل برگشت به تغییرات محیطی و درون سلولی پاسخ دهد. این مکانیسم نه تنها مسیرهای متابولیکی را تنظیم میکند، بلکه در مدیریت پاسخهای استرس فیزیولوژیک، مانند کمبود انرژی، اکسیداتیو استرس، گرما و سموم محیطی، نیز نقشی کلیدی دارد.
کنترل مسیرهای متابولیکی از طریق فسفوریلاسیون
در شرایط عادی یا استرسزا، فعالیت آنزیمهای کلیدی متابولیسم مانند پیروات دهیدروژناز، فسفوفروکتوکیناز، گلیکوزیل ترانسفرازها یا آنزیمهای چرخه TCA میتواند به واسطه فسفوریلاسیون تغییر یابد. بهعنوان مثال:
-
AMPK، به عنوان حسگر اصلی انرژی سلول، زمانی که سطح AMP افزایش مییابد، فعال میشود و از طریق فسفوریلاسیون مجموعهای از اهداف پاییندستی، مسیرهای کاتابولیک (مانند اکسیداسیون اسیدهای چرب) را فعال و مسیرهای آنابولیک (مانند سنتز لیپید) را مهار میکند.
-
mTOR، در نقطه مقابل AMPK، در پاسخ به غنای مواد مغذی فعال شده و از طریق فسفوریلاسیون پروتئینهایی مانند S6K و 4E-BP1، فرآیندهای رشد سلولی و سنتز پروتئین را تحریک میکند.
این تعادل فسفوریلاسیونی میان AMPK و mTOR نقش مهمی در تصمیمگیریهای متابولیک سلول دارد و اختلال در آنها میتواند منجر به دیابت نوع ۲، سرطان یا بیماریهای نورودژنراتیو شود.
فسفوریلاسیون به عنوان تنظیمکننده پاسخ به استرس اکسیداتیو
در پاسخ به استرس اکسیداتیو، پروتئینهای دخیل در دفاع آنتیاکسیدانی مانند Nrf2، Keap1، یا آنزیمهایی مانند سوپراکسید دیسموتاز و کاتالاز ممکن است بهواسطه فسفوریلاسیون تنظیم شوند. فسفوریلاسیون Nrf2 در برخی موقعیتها منجر به آزادسازی آن از Keap1 و ورود آن به هسته برای فعالسازی ژنهای آنتیاکسیدان میشود.
در مقابل، برخی فسفوتازها نیز مانند PP2A یا PTEN میتوانند از طریق حذف گروههای فسفات از پروتئینهای کلیدی، پاسخهای استرس را سرکوب یا تعدیل کنند.
تنظیم فسفوریلاسیون در شرایط کمبود اکسیژن و مواد مغذی
در شرایطی مانند هیپوکسی (کاهش اکسیژن) یا گرسنگی سلولی، فسفوریلاسیون پروتئینهایی مانند HIF-1α باعث پایداری آن و افزایش بیان ژنهای هدفی میشود که متابولیسم بیهوازی را تقویت میکنند. همچنین، این مسیر به سازگاری سلول با کمبود انرژی از طریق افزایش جذب گلوکز و کاهش فعالیت میتوکندری کمک میکند.
فسفوریلاسیون و تنظیم عملکرد میتوکندری
پروتئینهای میتوکندریایی مانند UCPها، کمپلکسهای زنجیره انتقال الکترون، یا آنزیمهای β-اکسیداسیون نیز به شدت تحت کنترل فسفوریلاسیون هستند. فسفوریلاسیون میتواند:
-
میزان مصرف اکسیژن و تولید ATP را تنظیم کند.
-
میزان ROS (گونههای فعال اکسیژن) را کاهش دهد.
-
فرآیندهای آپوپتوز میتوکندریایی را تعدیل کند.
در بیماریهای متابولیکی مانند دیابت و سندرم متابولیک، اختلال در فسفوریلاسیون این پروتئینها موجب نارسایی میتوکندری، افزایش استرس اکسیداتیو و التهاب مزمن میشود.
نقش فسفوریلاسیون در هماهنگی بین مسیرهای سیگنالینگ و متابولیسم
برهمکنش متقابل میان مسیرهای سیگنالینگ و متابولیسم از طریق فسفوریلاسیون تضمین میشود. برای نمونه:
-
مسیر PI3K/AKT که به گیرندههای انسولین متصل است، از طریق فسفوریلاسیون آنزیمهایی مانند GSK3β یا FOXOها باعث تنظیم ذخیره گلوکز و لیپوژنز میشود.
-
مسیر JNK و p38 MAPK در پاسخ به استرس محیطی یا سیتوکینها فعال شده و از طریق فسفوریلاسیون فاکتورهای رونویسی یا کوفاکتورها، متابولیسم را به سمت مقابله با آسیب هدایت میکنند.
ارتباط با فرآیند اتوفاژی و بقا یا مرگ سلولی
فسفوریلاسیون پروتئینهایی مانند ULK1، Beclin-1، یا ATGها نقش مستقیم در فعالسازی یا مهار فرآیند اتوفاژی دارد. این تنظیم موجب حفظ تعادل انرژی، دفع اجزای آسیب دیده سلولی و مقابله با استرسهای طولانی مدت میشود.
بهطور مثال، AMPK با فسفوریلاسیون ULK1 اتوفاژی را تحریک کرده و mTOR با فسفوریلاسیون مهاری همین پروتئین آن را سرکوب میکند.
فسفوریلاسیون در سلولهای باکتریایی و گیاهی
فسفوریلاسیون نه تنها در سلولهای یوکاریوتی اهمیت دارد، بلکه در پروکاریوتها و گیاهان نیز به عنوان یکی از اصلیترین مکانیسمهای تنظیمی نقش کلیدی ایفا میکند. با اینکه ساختارها و مسیرهای سلولی این موجودات با یوکاریوتها متفاوت است، اما اصول فسفوریلاسیون به عنوان سیستمی برای پاسخ به محرکهای محیطی، تنظیم رشد، متابولیسم، و دفاع، قابل مشاهده است.
فسفوریلاسیون در باکتریها: سیستمهای دوسیگنال
یکی از شناخته شده ترین مکانیزمهای فسفوریلاسیون در باکتریها، سیستمهای دوسیگنال (Two-Component Systems) هستند. این سیستمها که به طور گسترده در باکتریها یافت میشوند، شامل دو بخش اصلیاند:
-
سنسور کیناز هیستیدین (Histidine Kinase) : این پروتئین در پاسخ به محرکهای محیطی مانند تغییرات pH، دما، یا وجود مواد مغذی فعال میشود و خود را در موقعیت خاصی فسفریله میکند.
-
پروتئین پاسخگر (Response Regulator) : گروه فسفات از هیستیدین کیناز به این پروتئین منتقل شده و باعث فعال یا غیرفعال شدن آن میشود؛ اغلب این فعالسازی به تنظیم بیان ژنها منجر میشود.
این مسیر به باکتریها اجازه میدهد که بهسرعت خود را با شرایط متغیر وفق دهند، از جمله تنظیم تحرک، تشکیل بیوفیلم، یا تولید آنتیبیوتیک.
نقش فسفوریلاسیون در تنظیم متابولیسم باکتریایی
در باکتریها، بسیاری از آنزیمهای متابولیکی نیز تحت تأثیر فسفوریلاسیون قرار دارند. بهعنوان نمونه، آنزیم پیروات دهیدروژناز یا مسیرهای گلیکولیتیک میتوانند با فسفوریلاسیون کنترل شوند تا با شرایط انرژی سلول هماهنگ باشند.
برخی باکتریها نیز از فسفوریلاسیون در مسیرهای پاتوژنیسیته بهره میبرند؛ بهطور مثال، برخی گونههای Salmonella و E. coli از کینازهای خاص برای فعال سازی ژنهای بیماریزا استفاده میکنند.
فسفوریلاسیون در گیاهان: تنظیم رشد، فتوسنتز و دفاع
سلولهای گیاهی نیز از فسفوریلاسیون برای تنظیم بسیاری از فرآیندهای حیاتی خود استفاده میکنند. به دلیل وابستگی گیاهان به نور، آب و شرایط محیطی، فسفوریلاسیون در آنها یکی از ابزارهای مهم پاسخ دهی به استرسهای محیطی است.
تنظیم فتوسنتز
در کلروپلاستها، فسفوریلاسیون پروتئینهای مرتبط با زنجیره انتقال الکترون فتوسنتزی، از جمله پروتئینهای PSII و LHCII، نقش مهمی در بهینه سازی کارایی نورگیری و سازگاری با شدتهای نوری مختلف دارد. فسفوریلاسیون این پروتئینها منجر به باز توزیع انرژی نور میان فتوسیستمها و جلوگیری از آسیب نوری میشود.
مسیرهای سیگنالینگ هورمونی
فسفوریلاسیون همچنین در سیگنالینگ هورمونهای گیاهی مانند اسید آبسزیک (ABA)، براسینوستروئیدها، و اتیلن نقش دارد. کینازهایی مانند SnRK2 و MAPK در پاسخ به تنشهایی مانند خشکی، شوری، یا حمله پاتوژن فعال شده و از طریق فسفوریلاسیون فاکتورهای رونویسی، بیان ژنهای دفاعی یا تنظیم کننده رشد را تغییر میدهند.
پاسخ به استرسهای زیستی و غیرزیستی
فسفوریلاسیون در گیاهان برای مقابله با استرسهایی مانند حمله حشرات، قارچها، باکتریها، یا آسیب مکانیکی بهکار میرود. کینازهایی مانند CDPKها و MAPKها با شناسایی سیگنال اولیه، زنجیرهای از واکنشهای فسفوریلاسیون را راهاندازی کرده که به تولید فیتوالکسینها، تقویت دیواره سلولی، و تنظیم مسیرهای دفاعی منجر میشود.
تفاوتهای کلیدی میان فسفوریلاسیون در گیاهان، باکتریها و جانوران
-
نوع اسید آمینه هدف : در باکتریها معمولاً هیستیدین و آسپارتات، در حالی که در گیاهان و جانوران بیشتر سرین، ترئونین و تیروزین فسفریله میشوند.
-
نوع کینازها: کینازهای گیاهی اغلب ساختار متفاوتی نسبت به حیوانات دارند، بهویژه در مسیریابی سیگنالها به واسطه گیرندههای سطح سلول.
-
تنوع مسیرها : گیاهان به دلیل بیحرکتی و وابستگی به محیط، شبکههای فسفوریلاسیونی گستردهتری برای تنظیم تنشهای محیطی دارند.
فسفوریلاسیون به عنوان هدف درمانی
فسفوریلاسیون، به عنوان یکی از اساسیترین مکانیسمهای تنظیم فعالیت پروتئینها، نقش حیاتی در تعادل عملکرد سلولی ایفا میکند. اختلال در این فرآیند میتواند منجر به بیماریهایی از جمله سرطان، دیابت، اختلالات نورودژنراتیو و بیماریهای التهابی شود. به همین دلیل، مسیرهای فسفوریلاسیون و آنزیمهای مرتبط با آن بهعنوان اهداف بالقوه برای مداخلات درمانی مورد توجه ویژه پژوهشگران و صنعت داروسازی قرار گرفتهاند.
مهارکنندههای کینازها
یکی از استراتژیهای اصلی در درمان بیماریهای مرتبط با فسفوریلاسیون، استفاده از مهارکنندههای کیناز است. این داروها با مسدود کردن فعالیت آنزیمهای کیناز مانع از فسفوریلاسیون غیرقابل کنترل و فعال سازی بیشازحد مسیرهای سیگنالی میشوند. مثالهای برجسته شامل:
-
ایماتینیب (Imatinib) : مهارکنندهی تیروزینکیناز BCR-ABL در درمان لوکمیا میلوئیدی مزمن (CML).
-
ترستوزوماب (Trastuzumab) : آنتیبادی مونوکلونال علیه گیرنده HER2 که از طریق مهار فسفوریلاسیون، در درمان سرطان پستان مؤثر است.
-
رافینیب و سورافنیب : مهارکنندههای چندکینازی برای درمان تومورهای جامد و متاستاتیک.
این مهارکنندهها میتوانند به صورت انتخابی یا عمومی عمل کنند و بسته به بیماری، ترکیب دارویی مناسب برای بیمار تجویز میشود.
فسفوتازها به عنوان اهداف نوین
در مقابل کینازها، فسفوتازها نیز میتوانند اهداف درمانی جذابی باشند. افزایش فعالیت برخی فسفوتازها میتواند منجر به غیرفعال شدن مسیرهای مهم دفاع سلولی یا تنظیم متابولیسم شود. بهعنوان نمونه، در برخی سرطانها، افزایش فعالیت فسفوتازهایی مانند PTEN یا PP2A منجر به خاموشی مسیرهای رشد طبیعی میشود. در این موارد، مهار فسفوتاز با هدف بازگرداندن سیگنالدهی به حالت تعادل، میتواند سودمند باشد.
درمانهای ترکیبی و شخصیسازیشده
با پیچیدگی زیاد مسیرهای فسفوریلاسیون، استفاده از درمانهای ترکیبی که چندین کیناز یا مسیر سیگنالینگ را همزمان هدف قرار میدهند، نتایج امیدوارکنندهای در درمان بیماریهای مقاوم نشان دادهاند. این درمانها با کاهش احتمال بروز مقاومت دارویی، پاسخ پایدارتر و مؤثرتری ارائه میدهند.
همچنین، با پیشرفت تکنولوژیهای ژنومی و فسفوپروتئومیکس، زمینه برای درمانهای شخصی سازی شده فراهم شده است. در این روش، الگوی فسفوریلاسیون خاص هر بیمار شناسایی شده و بر اساس آن، مهارکنندهها یا ترکیبات دارویی ویژه تجویز میشود. این رویکرد میتواند دقت و اثربخشی درمان را به شکل چشمگیری افزایش دهد.
فسفوریلاسیون در درمان بیماریهای غیرسرطانی
علاوه بر سرطان، نقش فسفوریلاسیون در بیماریهایی چون دیابت نوع ۲، بیماری آلزایمر، پارکینسون، و بیماریهای خودایمنی نیز بهخوبی اثبات شده است. در این موارد:
-
در دیابت، تنظیم کینازهایی مانند AMPK و Akt نقش کلیدی در تنظیم برداشت گلوکز و حساسیت به انسولین دارد.
-
در آلزایمر، فسفوریلاسیون غیرطبیعی پروتئین Tau موجب شکل گیری ساختارهای نوروفیبریلار و اختلال عملکرد عصبی میشود.
-
در بیماریهای التهابی، مسیرهای فسفوریلاسیون MAPK و NF-κB به عنوان نقاط مداخله دارویی در نظر گرفته شدهاند.
چالشها و چشمانداز آینده
اگرچه مهار مسیرهای فسفوریلاسیون ابزار درمانی قدرتمندی است، اما چالشهایی نیز در این مسیر وجود دارد:
-
اختصاصیت پایین برخی داروها میتواند منجر به اثرات جانبی ناخواسته شود.
-
سازگاری سلولی و مقاومت دارویی در درمانهای بلندمدت یک مانع جدی است.
-
درک ناقص از شبکههای سیگنالینگ در برخی بیماریها باعث میشود نتوان مسیرهای مناسب درمان را با اطمینان شناسایی کرد.
با این حال، توسعه داروهای نسل جدید، بهره گیری از هوش مصنوعی در طراحی مولکولی، و پیشرفت در حوزه زیست شناسی سامانهای میتواند راه را برای درمانهای مؤثرتر هموار سازد.
یادگیری ماشین و هوش مصنوعی در پیشبینی و تحلیل فسفوریلاسیون
در عصر داده محور کنونی، بهرهگیری از فناوریهای نوین مانند یادگیری ماشین (Machine Learning) و هوش مصنوعی (Artificial Intelligence) تحولی چشمگیر در زیستشناسی مولکولی و بیوانفورماتیک ایجاد کرده است. فسفوریلاسیون پروتئینها، بهعنوان یکی از پیچیدهترین و پویاترین فرآیندهای تنظیم پساترجمهای، بهویژه از این پیشرفتها بهرهمند شده است. تحلیل و پیشبینی دقیق محلهای فسفوریلاسیون با استفاده از الگوریتمهای یادگیری ماشین به درک عمیقتر از شبکههای سیگنالینگ سلولی و توسعه داروهای هدفمند کمک شایانی کرده است.
پیشبینی سایتهای فسفوریلاسیون با الگوریتمهای یادگیری ماشین
الگوریتمهای یادگیری ماشین با استفاده از مجموعهدادههای عظیم پروتئینی، میتوانند محلهای بالقوه فسفوریلاسیون را در پروتئینهای جدید یا ناشناخته پیشبینی کنند. در این راستا:
-
مدلهای طبقهبندی (Classification models) مانند Random Forest، Support Vector Machines (SVM) و XGBoost با استفاده از ویژگیهای توالی آمینواسیدی، ساختار ثانویه، بار الکتریکی، و ویژگیهای بیوفیزیکی به شناسایی محلهای فسفوریلاسیون کمک میکنند.
-
شبکههای عصبی عمیق (Deep Neural Networks) به ویژه مدلهای CNN و LSTM، با در نظر گرفتن وابستگیهای بلند مدت در توالی پروتئین، عملکرد بسیار دقیقی در شناسایی سایتهای فسفوریلاسیون خاص دارند.
سامانههایی مانند MusiteDeep، DeepPhos، NetPhos و GPS نمونههایی از ابزارهای توسعه یافته با این رویکردها هستند که توسط جامعه علمی برای پیش بینی سایتهای فسفوریلاسیون مورد استفاده قرار میگیرند.
نقش یادگیری عمیق در تحلیل شبکههای فسفوریلاسیون
هوش مصنوعی، بهویژه یادگیری عمیق (Deep Learning)، به تحلیل شبکههای پیچیده فسفوریلاسیون و تعاملات بین پروتئینها نیز کمک میکند. مدلهای گراف محور مانند Graph Neural Networks (GNNs) قادرند تعاملات پروتئین-پروتئین، مسیرهای سیگنالینگ، و توزیع زمانی-مکانی فسفوریلاسیون را درون سلول تحلیل کنند.
از این طریق، دانشمندان میتوانند:
-
مسیرهای فسفوریلاسیون مختلشده در بیماریها را شناسایی کنند.
-
نقاط مداخلهای جدید برای درمان دارویی را کشف کنند.
-
تفاوتهای فسفوریلاسیون در بافتهای سالم و بیمار را بررسی کنند.
یکپارچهسازی دادههای امیکس برای تحلیل جامع فسفوریلاسیون
فناوریهای اومیکس مانند پروتئومیکس، فسفوپروتئومیکس، ترانسکریپتومیکس و متابولومیکس دادههای متنوع و عظیمی تولید میکنند. استفاده از هوش مصنوعی برای یکپارچه سازی این دادهها میتواند:
-
دیدگاه سیستمی و چندلایهای درباره نقش فسفوریلاسیون در تنظیم زیستی فراهم کند.
-
تعاملات بین فسفوریلاسیون و سایر تغییرات پساترجمهای مانند استیلاسیون یا یوبیکوئیتیناسیون را روشن کند.
-
الگوریتمهایی بسازد که قادر به پیشبینی رفتار سلولی در شرایط مختلف باشند.
کاربرد در طراحی داروهای هدفمند و طب شخصی
تحلیل الگوهای فسفوریلاسیون با الگوریتمهای یادگیری ماشین، به توسعه درمانهای شخصی سازیشده کمک میکند. با تطبیق پروفایل فسفوریلاسیون بیماران، میتوان داروهایی با بیشترین اثربخشی و کمترین عوارض جانبی تجویز کرد.
همچنین، مدلهای پیشبینیگر میتوانند پاسخ بیماران به داروهای مهارکننده کیناز را تخمین بزنند و به بهینه سازی درمان کمک کنند. این امر بهویژه در درمان سرطان، بیماریهای نورودژنراتیو و اختلالات خودایمنی بسیار مفید است.
چالشها و آینده پژوهش
با وجود پیشرفتهای چشمگیر، هنوز چالشهایی در مسیر استفاده از یادگیری ماشین در تحلیل فسفوریلاسیون وجود دارد:
-
کیفیت پایین یا ناقص بودن دادههای تجربی میتواند بر دقت مدلها تأثیر منفی بگذارد.
-
نیاز به مجموعه دادههای بزرگ و برچسبخورده برای آموزش مدلها وجود دارد.
-
تفسیر زیستی نتایج خروجی مدلها (مانند شبکههای عصبی عمیق) هنوز دشوار و نیازمند ابزارهای قابل تفسیر است.
با این حال، توسعه مدلهای self-supervised learning، بهرهگیری از هوش مصنوعی قابل توضیح (Explainable AI)، و افزایش دسترسی به دادههای فسفوپروتئومیک با کیفیت، آیندهای روشن را برای به کارگیری AI در زیستشناسی و پزشکی نوید میدهد.
جمعبندی و چشمانداز آینده پژوهشهای فسفوریلاسیون پروتئین
فسفوریلاسیون پروتئین به عنوان یکی از اساسیترین و پویاترین مکانیسمهای تنظیمی در موجودات زنده، نقش محوری در هدایت فرآیندهای زیستی از جمله چرخه سلولی، تنظیم ژن، متابولیسم، و پاسخ به محرکهای محیطی دارد. پژوهشهای انجامشده طی دهههای گذشته، موجب درک عمیقتری از پیچیدگیهای این فرایند و تعاملات گسترده آن با سایر مسیرهای تنظیمی شدهاند. با پیشرفت فناوریهای پیشرفته بیولوژیکی و محاسباتی، زمینههای جدیدی برای تحلیل و کاربردهای درمانی فسفوریلاسیون گشوده شده است.
از یکسو، توسعه روشهای آزمایشگاهی پیشرفته مانند طیف سنجی جرمی دقیق، فسفوپروتئومیکس با وضوح بالا، و سیستمهای تصویربرداری زنده، امکان شناسایی گسترده و دقیقتری از سایتهای فسفوریلاسیون در زمان و مکان خاص سلولی را فراهم کردهاند. از سوی دیگر، استفاده از یادگیری ماشین، هوش مصنوعی و الگوریتمهای شبکهای به درک بهتر از نقش فسفوریلاسیون در ساختارهای پیچیده زیستی کمک کردهاند؛ به گونهای که امروز میتوانیم مسیرهای سیگنالینگ مختلشده در بیماریها را مدلسازی کرده و اهداف درمانی مؤثرتری شناسایی کنیم.
با وجود این پیشرفتها، چالشهایی همچنان پابرجاست. در بسیاری از موارد، نقش دقیق بیولوژیکی سایتهای فسفوریلاسیون خاص یا تعامل آنها با سایر تغییرات پساترجمهای ناشناخته باقی مانده است. همچنین، تداخل و همپوشانی بین عملکردهای فسفوریلاسیون در بافتها یا شرایط فیزیولوژیکی مختلف، تفسیر دادهها را پیچیدهتر میکند.
در چشمانداز آینده، ترکیب دادههای چندلایه (multi-omics integration) و پیشرفت در فناوریهای single-cell phosphoproteomics میتواند به فهم پویایی فسفوریلاسیون در سطح سلول منفرد کمک کند. همچنین، توسعه داروهای هدفمند که به طور انتخابی سایتهای خاص فسفوریلاسیون یا کینازهای مختص بیماری را مهار میکنند، به درمانهای دقیقتر و کمعارضهتر منجر خواهد شد.
در کنار اینها، حرکت بهسوی طراحی الگوریتمهای قابل تفسیر و سامانههای یادگیری خودنظارتی (self-supervised) میتواند به کشف الگوهای ناشناخته در فسفوریلاسیون کمک کند و از مرزهای زیستشناسی کلاسیک عبور نماید.
در نهایت، پژوهش در حوزه فسفوریلاسیون نه تنها در درک بنیادین زیستشناسی سلولی بلکه در تحول پزشکی شخصی، طراحی واکسن، و توسعه زیستداروهای هوشمند نقشآفرین خواهد بود. این حوزه میانرشتهای همچنان نویدبخش تحولات بزرگ علمی و کاربردی در دهههای پیش رو است.