پیریمیدین و پورین بیوسنتز؛ مسیر و تنظیم آن
معرفی کلی و اهمیت نوکلئوتیدها
نوکلئوتیدها از مهمترین مولکولهای زیستی در سلولهای زنده هستند که نقشهای حیاتی و گستردهای در حفظ و انتقال اطلاعات ژنتیکی، تأمین انرژی، و تنظیم فعالیتهای سلولی ایفا میکنند. این ترکیبات از سه جزء اصلی تشکیل شدهاند: یک قند پنجکربنه (ریبوز یا دئوکسیریبوز)، یک گروه فسفات، و یک باز نیتروژنی که خود به دو گروه اصلی تقسیم میشود: بازهای پورینی (آدنین و گوانین) و بازهای پیریمیدینی (سیتوزین، تیمین و یوراسیل).
نوکلئوتیدها در ساختار اسیدهای نوکلئیک یعنی DNA و RNA شرکت میکنند. این دو ماکرومولکول اساس کد ژنتیکی را تشکیل میدهند و فرایندهای تکثیر، رونویسی و ترجمه را امکانپذیر میسازند. اما کارکرد نوکلئوتیدها فراتر از نقش آنها در ساختار ژنوم است؛ برخی نوکلئوتیدها مانند ATP، GTP، NAD⁺، FAD و cAMP بهعنوان کوآنزیمها، منابع انرژی و پیامرسانهای درونسلولی نیز عمل میکنند.
از جنبه متابولیکی، نوکلئوتیدها جزو متابولیتهای حیاتیاند که سنتز دقیق و کنترلشده آنها برای حفظ سلامت و عملکرد سلول ضروری است. افزایش یا کاهش غیرعادی سطح نوکلئوتیدها میتواند با بیماریهایی مانند سرطان، اختلالات متابولیک ارثی و بیماریهای ویروسی همراه باشد. به همین دلیل، مسیرهای بیوسنتز و بازیافت نوکلئوتیدها همواره مورد توجه محققان، داروسازان و پزشکان قرار دارد.
از سوی دیگر، نوکلئوتیدها بهدلیل تنوع عملکرد، به عنوان اهداف دارویی در درمانهای ضدسرطانی، ضدویروسی و ضدالتهابی مطرح شدهاند. برای مثال، داروهایی مانند آزاتایوپرین و فلورواوراسیل با تداخل در سنتز نوکلئوتیدها، رشد سلولهای سرطانی را مهار میکنند. همچنین آنالوگهای نوکلئوتیدی در درمان بیماریهایی نظیر هپاتیت B، HIV و برخی تومورها استفاده میشوند.
در سطح سلولی، تعادل بین سنتز نوکلئوتیدهای پورین و پیریمیدین برای تقسیم سلولی، تکثیر DNA و پاسخ به استرسهای محیطی اهمیت دارد. هرگونه اختلال در تنظیم این مسیرها میتواند تأثیرات گستردهای بر عملکرد بافتها و بروز بیماری داشته باشد.
در مجموع، نوکلئوتیدها نه تنها واحدهای سازنده حیات، بلکه مولکولهایی کلیدی برای تنظیم و هدایت فرایندهای سلولی هستند. درک دقیق مسیرهای سنتز، تنظیم و بازیافت آنها، زمینهساز پیشرفتهای چشمگیر در علوم زیستی، پزشکی مولکولی، داروسازی و بیوتکنولوژی خواهد بود.
مسیر بیوسنتز نوکلئوتیدهای پیریمیدین
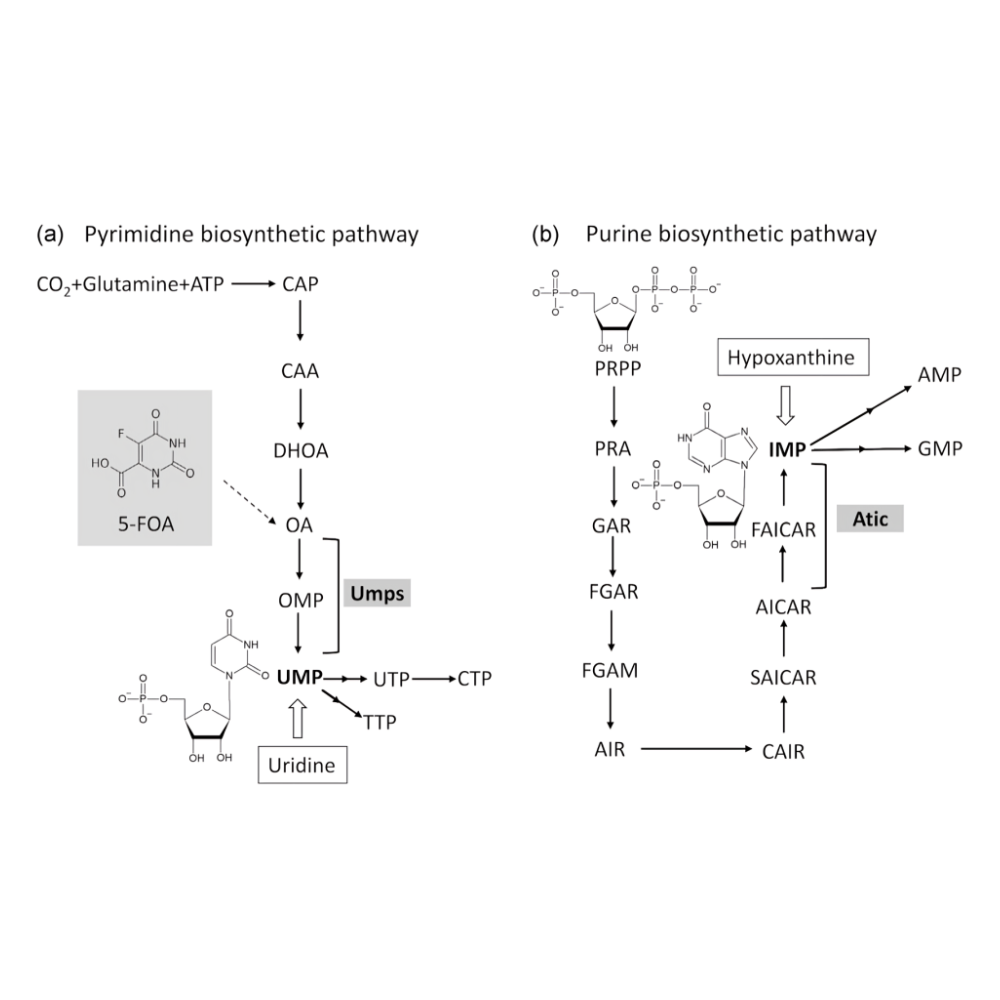
نوکلئوتیدهای پیریمیدینی از جمله سیتیدین، یوریدین و تیمیدین، نقش اساسی در ساختار RNA و DNA، و همچنین در فرایندهای متابولیکی نظیر گلیکوزیلاسیون پروتئینها دارند. برخلاف نوکلئوتیدهای پورینی که حلقه باز نیتروژنی آنها در کنار قند ساخته میشود، حلقه پیریمیدینی ابتدا بهصورت کامل سنتز میشود و سپس به قند متصل میگردد. این تفاوت بنیادی باعث متمایز شدن مسیرهای بیوسنتزی دو گروه نوکلئوتیدی میشود.
مراحل اصلی سنتز پیریمیدینها
سنتز de novo نوکلئوتیدهای پیریمیدینی از مواد سادهای مانند گلوتامین، آسپارتات و کربندیاکسید آغاز میشود. این فرایند در سیتوپلاسم سلول انجام میگیرد و دارای چندین مرحله کلیدی است:
تشکیل کاربامویل فسفات:
فرایند بیوسنتز با آنزیم کاربامویل فسفات سنتتاز II (CPSII) آغاز میشود که در سیتوزول و نه میتوکندری فعال است. این آنزیم از گلوتامین، CO₂ و ATP برای تولید کاربامویل فسفات استفاده میکند. این مرحله، بهعنوان مرحله محدودکننده نرخ (rate-limiting step) شناخته میشود و به شدت توسط مکانیسمهای تنظیمی کنترل میگردد.
تشکیل حلقه پیریمیدین:
کاربامویل فسفات با آسپارتات ترکیب شده و کاربامویل آسپارتات را تولید میکند. سپس این ترکیب توسط آنزیم دیهیدرواورتاز به دیهیدرواورتات تبدیل میشود. در مرحله بعد، دیهیدرواورتات توسط آنزیم دیهیدرواورتات دهیدروژناز به اوروتات اکسید میشود. این آنزیم در میتوکندری قرار دارد و از اهمیت زیادی در تنظیم مسیر برخوردار است.
تشکیل یوریدین مونوفسفات (UMP) :
اوروتات با کمک آنزیم اوروتات فسفوریبوزیل ترانسفراز (OPRT) و در حضور PRPP (فسفوریبوزیل پیروفسفات)، به OMP ا(ُرُتیدین مونوفسفات) تبدیل شده و در مرحله بعدی توسط OMP دکربوکسیلاز به UMP تبدیل میشود.
UMP بهعنوان پیشساز اصلی سایر نوکلئوتیدهای پیریمیدینی محسوب میشود. از طریق فسفوریلاسیون، UMP به UDP و سپس به UTP تبدیل میشود. با افزودن یک گروه آمین از گلوتامین به UTP، نوکلئوتید CTP (سیتیدین تریفسفات) تولید میگردد. برای ساخت dTTP (دئوکسیتیمیدین تریفسفات)، مسیر به طور جداگانه از dUMP و با کمک آنزیم تیمیدین سنتتاز انجام میشود.
تنظیم مسیر سنتز پیریمیدینها
تنظیم این مسیر بهصورت پیچیدهای انجام میگیرد تا از تعادل بین ساخت و مصرف نوکلئوتیدها اطمینان حاصل شود. ATP بهعنوان یک فعالکننده برای CPSII عمل میکند، در حالی که UTP، محصول نهایی مسیر، موجب مهار فیدبک این آنزیم میشود. این مکانیسم بازخورد منفی، نقش مهمی در ممانعت از تجمع بیرویه پیریمیدینها دارد.
اهمیت بالینی مسیر پیریمیدینسازی
اختلال در آنزیمهای مسیر سنتز پیریمیدینها میتواند با بیماریهای متعددی همراه باشد. برای مثال، نقص در آنزیم OPRT یا OMP دکربوکسیلاز منجر به بیماری نادر اوروتیک اسیدوریا میشود که با تجمع اوروتات در ادرار، آنمی مقاوم به درمان و تأخیر در رشد همراه است. همچنین داروهایی مانند لفلونوماید و فلورواوراسیل از طریق مهار آنزیمهای این مسیر، در درمان سرطانها و بیماریهای خودایمنی کاربرد دارند.
مسیر بیوسنتز نوکلئوتیدهای پورین
نوکلئوتیدهای پورینی مانند آدنوزین (AMP) و گوانوزین (GMP)، اجزای اساسی در ساختار DNA، RNA، کوآنزیمها (نظیر NAD⁺ و FAD) و مولکولهای انتقال انرژی همچون ATP محسوب میشوند. برخلاف پیریمیدینها که ابتدا حلقه ساخته شده و سپس به قند متصل میشود، در سنتز پورینها، حلقه آلی نیتروژنی به تدریج روی قند ریبوز در قالب PRPP (فسفوریبوزیل پیروفسفات) ساخته میشود. این فرایند پیچیده بهصورت مرحلهبهمرحله با استفاده از منابع نیتروژن و کربن صورت میگیرد.
آغاز سنتز از PRPP
سنتز de novo پورینها با فعالسازی ریبوز-۵-فسفات بهوسیله آنزیم PRPP سنتتاز آغاز میشود. این واکنش نیاز به ATP دارد و PRPP را تولید میکند که اسکلت اصلی قند را برای ساخت پورین فراهم میسازد.
در مرحله بعد، آنزیم گلوتامین-PRPP آمیدوترانسفراز، اولین نیتروژن را از گلوتامین به PRPP منتقل میکند و ساختار 5-فسفوریبوزیل-آمین را تشکیل میدهد. این مرحله بهعنوان مرحله محدودکننده نرخ (rate-limiting) مسیر پورینسازی شناخته شده و توسط AMP و GMP تنظیم منفی میشود.
مراحل ساخت حلقه پورینی
در ادامه، ترکیبات مختلفی به ساختار افزوده میشوند تا هسته حلقوی دوگانه پورین شکل بگیرد:
-
گلیسین بهعنوان منبع کربن و نیتروژن وارد میشود.
-
گروههای فرمیلی از تتراهیدروفولات (THF) اضافه میگردند.
-
آسپارتات، CO₂ و گلوتامین در مراحل بعدی شرکت میکنند.
پس از انجام ۱۰ واکنش آنزیمی پیچیده، محصول نهایی، اینوزین مونوفسفات (IMP) بهدست میآید. IMP بهعنوان پیشساز مشترک دو نوکلئوتید اصلی پورینی یعنی AMP و GMP محسوب میشود.
انشعاب مسیر به سمت AMP و GMP
-
برای سنتز AMP، IMP ابتدا به آدنیلوسوکسینات تبدیل شده و سپس توسط آنزیم آدنیلوسوکسینات لیاز به AMP و فومارات شکسته میشود. این مسیر نیاز به GTP دارد.
-
برای سنتز GMP، IMP ابتدا به گزانتوزین مونوفسفات (XMP) اکسید شده و سپس با دریافت نیتروژن از گلوتامین توسط آنزیم GMP سنتتاز به GMP تبدیل میشود. این مسیر نیاز به ATP دارد.
این وابستگی متقابل به GTP و ATP برای سنتز GMP و AMP به حفظ تعادل بین این دو نوکلئوتید کمک میکند.
تنظیم بیوسنتز پورینها
تنظیم این مسیر بهشدت توسط مکانیسمهای بازخورد منفی انجام میشود:
-
IMP، AMP و GMP فعالیت گلوتامین-PRPP آمیدوترانسفراز را مهار میکنند.
-
AMP و GMP مسیرهای اختصاصی تبدیل IMP را تنظیم مینمایند.
-
افزایش PRPP در شرایط خاص مانند نقصهای متابولیکی میتواند باعث تحریک بیشازحد مسیر و تولید غیرطبیعی پورینها شود.
اهمیت بالینی مسیر سنتز پورین
اختلال در مسیر بیوسنتز پورینها با بیماریهای مهمی ارتباط دارد. برای مثال:
-
سندرم لش-نیهان ناشی از کمبود آنزیم HGPRT در مسیر بازیافت پورینها باعث افزایش سنتز de novo و تجمع اوریک اسید میشود که با ناتوانی عصبی و خودزنی شدید همراه است.
-
نقرس (Gout) نیز با تجمع اوریک اسید و تشکیل کریستال در مفاصل شناخته میشود که به دنبال افزایش تجزیه نوکلئوتیدهای پورینی رخ میدهد.
-
داروهایی مانند آزاتیوپرین و مرکاپتوپورین با مهار سنتز پورینها در درمان سرطانها و بیماریهای خودایمنی کاربرد دارند.
تنظیم مسیرهای بیوسنتز پیریمیدین و پورین
تنظیم دقیق مسیرهای بیوسنتزی نوکلئوتیدهای پیریمیدینی و پورینی برای حفظ تعادل نوکلئوتیدی، رشد سلولی مناسب و جلوگیری از اختلالات متابولیکی ضروری است. این تنظیم عمدتاً از طریق مکانیسمهای بازخورد منفی (Feedback Inhibition)، تنظیمهای آنزیمی، اثرات متقابل بین پورین و پیریمیدین، و مسیرهای بازیافت انجام میشود.
مکانیسم بازخورد منفی بهعنوان محور اصلی تنظیم
یکی از راههای اصلی تنظیم بیوسنتز نوکلئوتیدها، بازخورد منفی نهایی محصولات بر آنزیمهای کلیدی مسیر است. برای مثال:
-
در مسیر پورین، نوکلئوتیدهایی مانند AMP، GMP و IMP آنزیم گلوتامین-PRPP آمیدوترانسفراز را مهار میکنند؛ آنزیمی که آغازگر واکنشهای ساخت پورین است.
-
در مسیر پیریمیدین، CTP بهعنوان محصول نهایی، آنزیم ATCase (آسپارتات ترانسکاربامیلاز) را مهار میکند که یکی از مراحل ابتدایی و محدودکننده سرعت مسیر پیریمیدینسازی محسوب میشود.
این نوع تنظیم تضمین میکند که در صورت فراوانی محصول نهایی، مسیر بیوسنتزی کند یا متوقف شود تا از مصرف بیرویه انرژی و مواد اولیه جلوگیری شود.
نقش PRPP و سطح انرژی سلول
ترکیب PRPP (فسفوریبوزیل پیروفسفات) یک کوفاکتور کلیدی در آغاز مسیرهای پورینی و پیریمیدینی است. سطح بالای PRPP در سلول، محرک مهمی برای آغاز سنتز نوکلئوتیدهاست، اما مقادیر بیشازحد آن ممکن است در بیماریهایی مانند نقرس باعث افزایش سنتز نوکلئوتید و تجمع اوریکاسید شود.
همچنین، در هر دو مسیر، وابستگی شدید به ATP و GTP باعث شده سطح انرژی کلی سلول نیز نقش تعیینکنندهای در سرعت واکنشها داشته باشد. زمانی که انرژی در سطح پایین است (مانند هنگام گرسنگی یا استرس سلولی)، مسیرهای بیوسنتز کاهش مییابند تا منابع سلولی حفظ شوند.
تنظیم متقابل بین پورین و پیریمیدین
بین سنتز پورین و پیریمیدین همواره نوعی تنظیم متقابل (cross-regulation) وجود دارد تا تعادل بین آنها حفظ شود. بهعنوان نمونه:
-
سنتز AMP به GTP نیاز دارد، و سنتز GMP به ATP، بهطوری که این وابستگی متقابل باعث تعادل میان نوکلئوتیدهای پورینی میشود.
-
در برخی مراحل سلولی، میزان بالای dATP یا dGTP میتواند مهارکننده آنزیم ردوکتاز ریبونوکلئوتید باشد و مانع تبدیل سایر نوکلئوتیدها به فرم دیاکسی شود که این امر در تقسیم سلولی پیامد دارد.
تنظیم از طریق آنزیمهای ایزوفرمی و فسفوریلاسیون
برخی آنزیمهای مسیر نوکلئوتیدسازی دارای ایزوفرمهایی با پاسخ دهی متفاوت به فاکتورهای تنظیمی هستند. برای مثال:
-
آنزیمهای مسیر پیریمیدین مانند CAD (ترکیبی از کاربامیلاز، آسپارتات ترانسکاربامیلاز و دیهیدرواراتاز) میتوانند توسط فسفوریلاسیون از طریق مسیرهای سیگنالینگ مانند mTOR و MAPK فعال یا مهار شوند. این تنظیمات پاسخ مستقیم به شرایط رشد، تغذیه و تکثیر سلولی هستند.
-
مسیرهای پاسخ به DNA damage نیز میتوانند باعث تنظیم سنتز نوکلئوتیدها از طریق کنترل بیان آنزیمهای بیوسنتزی شوند.
اهمیت تنظیم مسیر در شرایط پاتولوژیک
نقص در تنظیم مسیرهای بیوسنتز نوکلئوتید میتواند منجر به بیماریهای متعددی شود:
-
رشد بیرویه سلولها در سرطانها اغلب با افزایش فعالیت مسیرهای بیوسنتزی نوکلئوتید همراه است. به همین دلیل داروهایی مانند فلورواوراسیل و متوترکسات با مهار سنتز پیریمیدین و پورین در درمان تومورها استفاده میشوند.
-
در نقصهای مادرزادی مانند نقص آنزیم OPRT یا آنزیمهای مرتبط با چرخه اوروتات، سنتز پیریمیدین دچار اختلال شده و موجب کمخونی مگالوبلاستیک میشود.
-
در بیماریهای متابولیکی مانند سندرم لش-نیهان، اختلال در بازیافت پورینها موجب فعال شدن بیشازحد مسیر de novo و تجمع اوریکاسید میگردد.
هماهنگی با چرخه سلولی و نیازهای بافتی
بیوسنتز نوکلئوتیدها با فاز S چرخه سلولی هماهنگ است. سلولها تنها در مواقعی که آماده تقسیم هستند، مسیرهای سنتز را فعال میکنند. در غیر این صورت، مصرف منابع و انرژی در حداقل حفظ میشود.
علاوه بر آن، بافتهایی مانند مغز، کبد و مغز استخوان که سرعت متابولیسم بالایی دارند، دارای تنظیمهای اختصاصی برای حفظ تعادل نوکلئوتیدها هستند.
نقش بیوسنتز نوکلئوتیدها در بیماریها و درمانها
مسیرهای بیوسنتز نوکلئوتیدها نهتنها نقش اساسی در رشد، تکثیر و بقای سلولی دارند، بلکه در بسیاری از بیماریها، بهویژه سرطان، اختلالات متابولیک و بیماریهای مادرزادی، نقش کلیدی ایفا میکنند. درک دقیق این مسیرها نهتنها به تشخیص بهتر بیماریها کمک میکند، بلکه فرصتهای درمانی نوینی را فراهم میسازد، بهویژه در طراحی داروهای هدفمند که روی آنزیمهای خاصی از این مسیرها اثر میگذارند.
بیوسنتز نوکلئوتیدها و سرطان
یکی از ویژگیهای بارز سلولهای سرطانی، نیاز شدید به نوکلئوتیدها برای تکثیر سریع است. این سلولها اغلب مسیرهای بیوسنتز de novo نوکلئوتیدها را بهشدت فعال میکنند تا بتوانند DNA و RNA مورد نیاز برای تقسیمهای مکرر را تأمین نمایند. این وضعیت، هدف مناسبی برای داروهای ضدسرطان فراهم کرده است.
داروهایی مانند:
-
متوترکسات : با مهار آنزیم دیهیدروفولات ردوکتاز، سنتز پورین و تیمیدین را مختل کرده و رشد سلولهای توموری را متوقف میکند.
-
فلورواوراسیل( 5-FU ) : با مهار تیمیدین سنتتاز، مانع سنتز تیمیدین میشود و در درمان سرطانهای کولورکتال و سینه بهکار میرود.
-
میرکاپتوپورین و آزاتیوپرین: آنالوگهای پورینی هستند که در مسیر سنتز وارد میشوند و بهعنوان مهارکنندههای تقسیم سلولی در درمان لوسمیها مؤثرند.
اختلالات ژنتیکی مرتبط با بیوسنتز نوکلئوتید
برخی بیماریهای متابولیک بهعلت نقصهای ژنتیکی در آنزیمهای مسیر بیوسنتز نوکلئوتید بروز میکنند. نمونههای شاخص عبارتند از:
-
سندرم لش-نیهان : ناشی از نقص آنزیم HGPRT در مسیر بازیافت پورینهاست که منجر به تجمع اوریکاسید و رفتارهای خودآزاری در بیماران میشود.
-
اوروتیک اسیدوری نوع I و II : نتیجه کمبود آنزیمهای OPRT و اوروتیدین ۵'-مونوفسفات دکربوکسیلاز در مسیر پیریمیدین است که باعث کم خونی مگالوبلاستیک و دفع اوروتیک اسید در ادرار میشود.
-
کمبود ADA (آدنوزین دآمیناز) : موجب نقص ایمنی شدید (SCID) میشود، زیرا تجمع دئوکسیآدنوزین برای لنفوسیتها سمی است.
نقش بیوسنتز نوکلئوتیدها در عفونتها و طراحی آنتیویروسها
ویروسها نیز مانند سلولهای سرطانی به منابع نوکلئوتیدی برای تکثیر وابستهاند. بنابراین، مهار مسیرهای سنتز نوکلئوتید یا استفاده از آنالوگهای ساختاری در درمان عفونتهای ویروسی نیز مؤثر است. نمونههایی از این داروها عبارتند از:
-
آسیکلوویر : آنالوگ گوانوزین که در سلولهای آلوده به ویروس هرپس فعال شده و از سنتز DNA ویروسی جلوگیری میکند.
-
زیدوودین: (AZT) آنالوگ تیمیدین برای درمان HIV که در آنزیم ترانسکریپتاز معکوس وارد شده و باعث توقف زنجیره DNA ویروسی میشود.
-
رمدسیویر: مهارکننده RNA پلیمراز ویروسی که در درمان کروناویروسها بهکار رفته است.
بیوسنتز نوکلئوتیدها و بیماریهای التهابی و خودایمنی
در بیماریهای خودایمنی مانند لوپوس، روماتوئید آرتریت و پسوریازیس، استفاده از داروهایی که سنتز نوکلئوتید را مهار میکنند (مانند متوترکسات) موجب کاهش فعالیت بیشازحد لنفوسیتها و کنترل پاسخ ایمنی میشود. این نوع درمان که «سرکوب تقسیم سلولی» را هدف قرار میدهد، یکی از پایههای درمانهای ایمونوساپرسیو است.
جنبههای دارویی و طراحی آنالوگهای نوکلئوتیدی
توسعه آنالوگهای نوکلئوتیدی برای درمان بیماریها، یکی از راهبردهای پیشرفته در داروسازی نوین است. این آنالوگها بهگونهای طراحی میشوند که شبیه نوکلئوتیدهای طبیعی وارد مسیر شوند اما عملکرد نهایی را مختل کنند. طراحی آنها باید بسیار دقیق باشد تا:
-
در سلولهای سالم بهحداقل اثر برسند.
-
در سلولهای پاتولوژیک (مانند سلولهای سرطانی یا آلوده به ویروس) فعالیت انتخابی داشته باشند.
-
سمیت کمتری برای بافتهای حیاتی مانند مغز استخوان، کبد و کلیه ایجاد کنند.
کاربردهای بیوتکنولوژیکی و تحقیقاتی نوکلئوتیدها
نوکلئوتیدها، بهعنوان واحدهای سازندهی اسیدهای نوکلئیک و مولکولهایی با فعالیت بیولوژیکی مستقل، جایگاه برجستهای در بیوتکنولوژی، زیست شناسی مولکولی و تحقیقات پزشکی دارند. بهرهگیری از آنها در روشهای تشخیصی، تولید دارو، مهندسی ژنتیک و مطالعات متابولیکی، بیشمار است و با گسترش فناوریهای نوین، نقش نوکلئوتیدها از ابزاری تحقیقاتی به اجزایی کاربردی و حتی درمانی ارتقا یافته است.
استفاده از نوکلئوتیدهای سنتزی در روشهای زیستمولکولی
در پژوهشهای مولکولی، انواع نوکلئوتیدهای مصنوعی یا برچسب خورده برای تکثیر، تشخیص، و شناسایی اسیدهای نوکلئیک مورد استفاده قرار میگیرند. این کاربردها شامل موارد زیر است:
-
واکنش زنجیرهای پلیمراز: (PCR) در این روش، دئوکسینوکلئوتید تریفسفاتها (dNTPs) بهعنوان زیرلایه اصلی برای سنتز رشته مکمل DNA مورد استفاده قرار میگیرند. اصلاحاتی مانند برچسبگذاری فلورسنت روی نوکلئوتیدها امکان ردیابی دقیق توالیها را فراهم میکند.
-
روشهای سکانسیابی نسل جدید (NGS) : این فناوریها به dNTPهای خاصی نیاز دارند که قابلیت توقف یا تشخیص نوری داشته باشند تا روند خوانش توالی دقیقاً کنترل شود.
-
تکنولوژی CRISPR/Cas9 : در این سیستم، RNA راهنما با نوکلئوتیدهای سنتزی طراحی میشود تا دقت اتصال به توالی هدف افزایش یابد و احتمال اثرات خارج از هدف کاهش یابد.
نوکلئوتیدها در تولید نوکلئیکاسیدهای مصنوعی و واکسنهای ژنی
در صنعت بیوتکنولوژی، سنتز RNA یا DNA مصنوعی برای تولید واکسنهای ژنی، داروهای مبتنی بر نوکلئیکاسید و RNAهای مداخلهگر( siRNA، miRNA )ضروری است. در این حوزه:
-
mRNA واکسنها (مانند واکسنهای کرونا) از نوکلئوتیدهای اصلاحشده (مانند pseudouridine یا 5-methylcytidine )برای افزایش پایداری و کاهش پاسخ ایمنی ذاتی استفاده میشود.
-
واکسنهای: DNA حاوی پلاسمیدهایی هستند که با توالیهای کدکننده آنتیژن طراحی شدهاند و در میزبان ترجمه میشوند.
کاربرد نوکلئوتیدها در طراحی نانوحاملها و سیستمهای دارورسانی
نوکلئوتیدها، بهویژه RNAهای ساختاری، در طراحی نانوذرات زیستی مانند:
-
DNA origami : برای تولید سازههای نانومقیاس با دقت بالا.
-
RNA aptamerها : بهعنوان گیرندههای اختصاصی برای انتقال هدفمند دارو یا تصویربرداری مولکولی.
این فناوریها امکان رساندن داروها یا عوامل درمانی به سلولهای خاص با حداقل آسیب به بافتهای سالم را فراهم میکنند.
نوکلئوتیدها بهعنوان مکمل غذایی یا داروی حمایتی
در صنایع داروسازی و تغذیه، نوکلئوتیدها به صورت ترکیبات مکمل در موارد زیر استفاده میشوند:
-
تغذیه نوزادان: مکملهای حاوی نوکلئوتیدها به فرمولهای شیرخشک اضافه میشوند تا رشد ایمنی و عملکرد رودهای را تقویت کنند.
-
بهبود عملکرد سیستم ایمنی : در بزرگسالان، مصرف مکملهای نوکلئوتیدی میتواند پاسخ ایمنی را تقویت کرده و ریکاوری پس از بیماری را سرعت بخشد.
-
درمانهای حمایتی در بیماران دچار نارساییهای ایمنی یا کبدی : به ویژه در شرایطی که سنتز داخلی نوکلئوتیدها دچار اختلال شده است.
نوکلئوتیدها بهعنوان نشانگرهای زیستی در تحقیقات بالینی
برخی نوکلئوتیدهای آزاد یا متابولیتهای آنها در پلاسما و ادرار بهعنوان بیومارکر برای بررسی وضعیت متابولیک، استرس اکسیداتیو، یا آسیب سلولی به کار میروند. برای نمونه:
-
تجمع dUTP در سلولها میتواند نشان دهنده کمبود فولات یا ویتامین B12 باشد.
-
افزایش اوریکاسید به دلیل تجزیه نوکلئوتیدهای پورینی، میتواند نشانگر نقرس یا سندرم لیز تومور باشد.