چربیسوزی و متابولیسم لیپید؛ بتا-اکسیداسیون و اهمیت آن
مقدمه: چرا متابولیسم لیپید مهم است؟
در بدن انسان، لیپیدها (چربیها) نهتنها منابع اصلی انرژی هستند، بلکه نقش کلیدی در ساختار سلولی، تنظیم هورمونی، پاسخ به استرس، و عملکردهای ایمنی و عصبی ایفا میکنند. برخلاف کربوهیدراتها که ذخایر محدودی دارند، لیپیدها میتوانند به صورت تریگلیسرید در بافت چربی ذخیره شده و در مواقع نیاز انرژی قابل توجهی آزاد کنند. این ویژگی لیپیدها را به مخازن استراتژیک انرژی در بدن تبدیل کرده است.
از طرف دیگر، متابولیسم لیپید تنها محدود به چربی سوزی برای تولید انرژی نیست. مسیرهای متابولیکی چربی در طیف گستردهای از عملکردهای حیاتی دخیلاند: از تنظیم دمای بدن توسط بافت چربی قهوهای گرفته تا کنترل بیان ژن توسط محصولات میانجی لیپیدی مانند اسیدهای چرب آزاد، پروستاگلاندینها و لکوتریئنها.
اختلال در متابولیسم چربی میتواند زمینهساز بروز بیماریهای پیچیدهای مانند دیابت نوع ۲، بیماریهای قلبی-عروقی، کبد چرب غیرالکلی، و سندرم متابولیک شود. به همین دلیل، درک دقیق فرآیندهای دخیل در بتا-اکسیداسیون، سنتز لیپید، و تنظیم هورمونی مسیرهای چربی برای توسعه روشهای نوین درمانی و پیشگیری اهمیت فراوانی دارد.
در دوران مدرن، که چاقی، تغذیه ناصحیح و سبک زندگی بیتحرک به مشکلات شایع بهداشتی بدل شدهاند، شناخت علمی متابولیسم لیپید نهتنها برای پژوهشگران، بلکه برای پزشکان، متخصصان تغذیه و ورزشکاران حرفهای نیز حیاتی است. این مقاله با هدف بررسی عمیق فرآیندهای اصلی مرتبط با چربیسوزی، بهویژه مسیر بتا-اکسیداسیون اسیدهای چرب، تنظیم آن در شرایط فیزیولوژیک و پاتولوژیک، و کاربردهای درمانی، تدوین شده است.
مبانی متابولیسم لیپید: از جذب تا اکسیداسیون
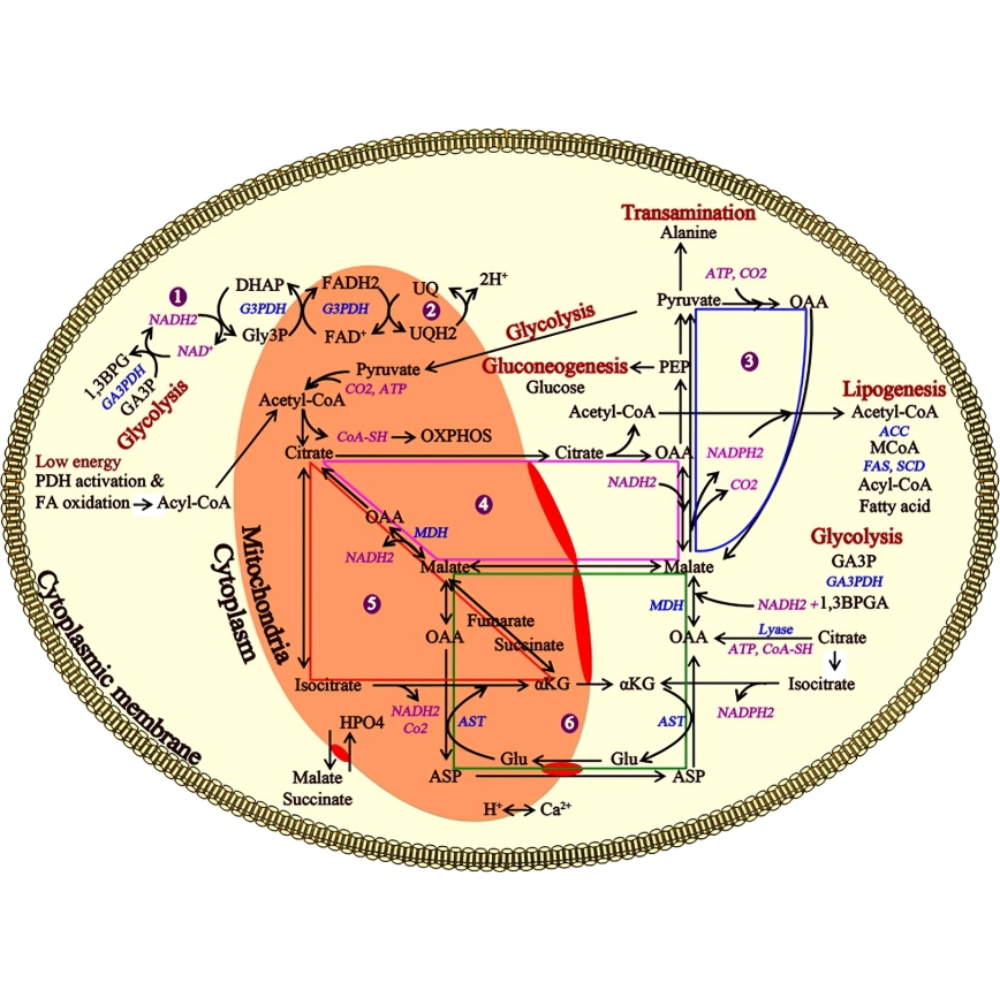
لیپیدها از جمله مولکولهای انرژیزای اساسی در بدن انسان هستند که از منابع مختلف غذایی نظیر چربیهای اشباع و غیراشباع، فسفولیپیدها و کلسترول تأمین میشوند. فرآیند متابولیسم لیپیدها از زمان ورود به دستگاه گوارش تا اکسیداسیون در میتوکندری مجموعهای از مراحل تنظیمشده و هماهنگ را شامل میشود.
جذب لیپیدها در دستگاه گوارش
فرآیند هضم لیپیدها عمدتاً در روده باریک انجام میشود. در این مرحله، اسیدهای صفراوی ترشحشده از کبد موجب امولسیونسازی چربیها میشوند که این عمل سطح تماس آنزیمها با لیپیدها را افزایش میدهد. سپس آنزیم لیپاز پانکراس تریگلیسریدها را به اسیدهای چرب آزاد و مونوگلیسریدها تجزیه میکند.
این محصولات با ایجاد میکِلها وارد سلولهای اپیتلیال روده شده و پس از بازسازی به تریگلیسرید، درون کایلومیکرونها بستهبندی و وارد سیستم لنفاوی و سپس گردش خون میشوند.
حمل و نقل لیپیدها در خون
پس از جذب، چربیها به شکل لیپوپروتئینها مانند VLDL، LDL و HDL در خون حمل میشوند. لیپوپروتئین لیپاز (LPL) که روی سطح سلولهای اندوتلیال فعال است، تریگلیسریدهای موجود در این ذرات را تجزیه کرده و اسیدهای چرب را آزاد میکند. این اسیدهای چرب سپس توسط سلولهای هدف مانند عضله یا بافت چربی جذب میشوند.
ذخیرهسازی یا اکسیداسیون: سرنوشت اسیدهای چرب
اسیدهای چرب پس از ورود به سلول یا به صورت تریگلیسرید در آدیپوسیتها ذخیره میشوند یا وارد مسیر بتا-اکسیداسیون در میتوکندری شده و برای تولید انرژی مصرف میگردند.
ورود اسیدهای چرب بلند زنجیر به میتوکندری نیازمند سیستم کارنیتین شاتل است. پس از فعالسازی توسط آنزیم اسیلکوآ سنتتاز، اسیدهای چرب به آسیل-کوآ تبدیل میشوند و در صورت نیاز به اکسیداسیون، به کمک کارنیتین پالمیتویل ترانسفراز 1 و 2 ( CPT1 و CPT2) به درون میتوکندری منتقل میگردند.
بتا-اکسیداسیون: مسیر اصلی چربیسوزی
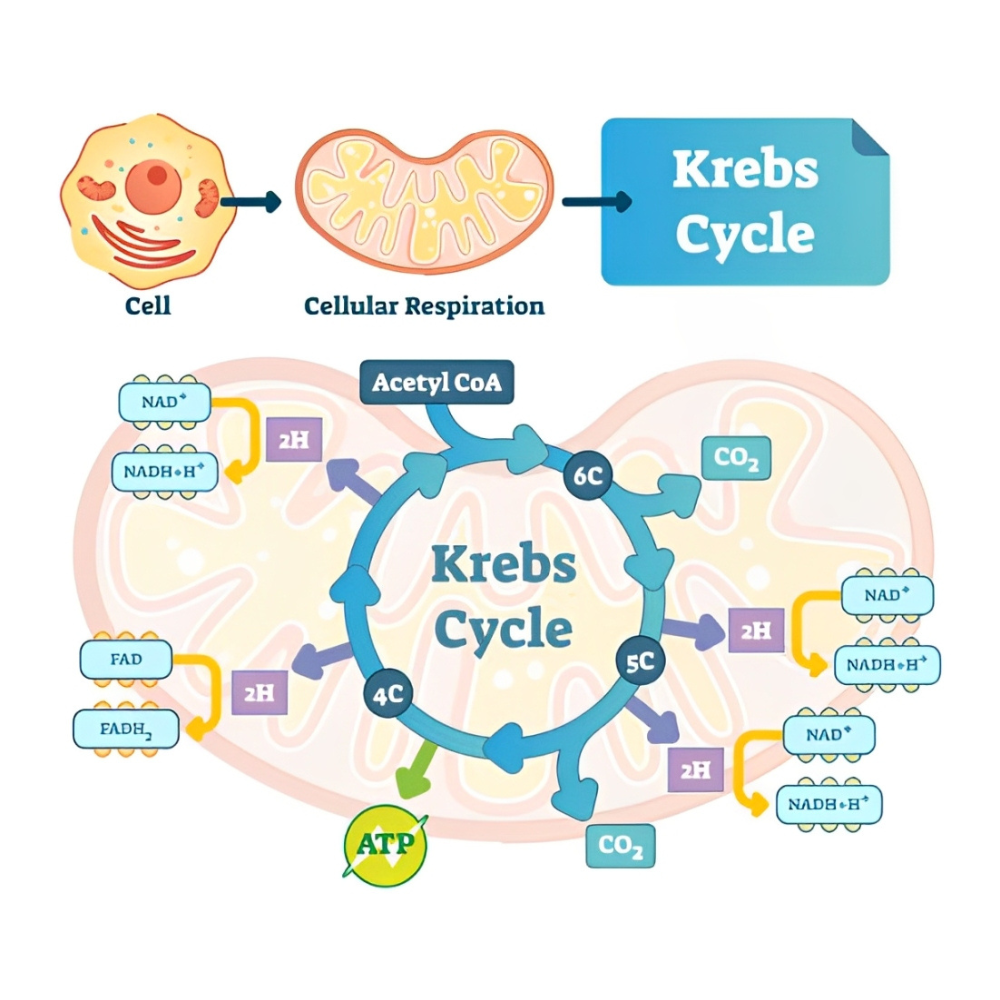
در میتوکندری، آسیلکوآ وارد چرخه بتا-اکسیداسیون میشود. در هر دور از این چرخه، یک مولکول استیلکوآ، FADH2 و NADH تولید میگردد که این کوفاکتورها سپس وارد زنجیره انتقال الکترون میشوند و تولید ATP را به همراه دارند. این فرآیند تا زمانی ادامه دارد که کل زنجیره اسید چرب به استیلکوآ تبدیل شود.
نکته مهم این است که بتا-اکسیداسیون چندین برابر بیشتر از گلیکولیز انرژی تولید میکند، به همین دلیل در شرایط روزه داری، ورزشهای هوازی، یا رژیمهای کم کربوهیدرات، بدن بیشتر به سراغ لیپیدها بهعنوان منبع سوخت میرود.
بتا-اکسیداسیون اسیدهای چرب: مسیر اصلی چربیسوزی
بتا-اکسیداسیون فرآیندی حیاتی در متابولیسم انرژی است که طی آن اسیدهای چرب بلند زنجیر درون میتوکندری تجزیه میشوند و مولکولهایی با انرژی بالا تولید میگردند. این مسیر، هسته اصلی چربیسوزی سلولی را تشکیل میدهد، بهویژه در شرایطی که منابع گلوکز کاهش یافتهاند یا نیاز انرژی افزایش یافته است، مانند ورزش، روزهداری، یا رژیمهای کمکربوهیدرات.
مقدمهای بر ورود اسیدهای چرب به میتوکندری
اسیدهای چرب فعالشده (به صورت آسیل-کوآ) نمیتوانند بهطور مستقیم وارد ماتریکس میتوکندری شوند. برای عبور از غشای داخلی میتوکندری، از سیستم کارنیتین شاتل استفاده میشود. در این فرآیند، آنزیم CPT1 آسیلکوآ را به آسیل-کارنیتین تبدیل کرده و این ترکیب وارد فضای داخلی میتوکندری میشود، سپس توسط CPT2 دوباره به آسیلکوآ بازسازی میگردد.
مراحل اصلی بتا-اکسیداسیون
درون ماتریکس میتوکندری، بتا-اکسیداسیون طی چهار واکنش متوالی تکرار میشود تا زنجیره اسید چرب به صورت تدریجی کوتاه شده و به مولکولهای استیلکوآ تبدیل گردد:
-
اکسیداسیون اولیه توسط آسیل-کوآ دهیدروژناز : این آنزیم یک پیوند دوگانه بین کربنهای آلفا و بتا ایجاد میکند و FADH₂ تولید میشود.
-
هیدراسیون توسط انویل-هیدراتاز: آب به مولکول افزوده میشود و پیوند دوگانه به یک گروه هیدروکسی تبدیل میشود.
-
اکسیداسیون دوم توسط هیدروکسی آسیل-کوآ دهیدروژناز : هیدروکسیل به کتونی تبدیل شده و NADH تولید میگردد.
-
شکستن پیوند توسط تیولاز: مولکول به دو بخش تقسیم میشود که یکی استیلکوآ و دیگری یک آسیلکوآ کوتاهتر است.
این مراحل تا جایی تکرار میشود که تمام زنجیره چرب به مولکولهای استیلکوآ تبدیل شود.
حاصل نهایی: ATP بیشتر، کارایی بالاتر
هر مولکول استیلکوآ وارد چرخه کربس شده و سپس محصولات آن وارد زنجیره انتقال الکترون میشوند. در مجموع، یک اسید چرب 16 کربنه مانند پالمیتیک اسید میتواند حدود 106 مولکول ATP تولید کند؛ این عدد در مقایسه با 36 تا 38 ATP حاصل از یک مولکول گلوکز، بسیار قابل توجه است.
این ویژگی بتا-اکسیداسیون را به مسیر غالب تولید انرژی در فعالیتهای هوازی تبدیل میکند، بهخصوص در بافتهایی مانند عضله قلب، عضله اسکلتی در حین ورزش، و کبد در شرایط روزه داری.
تنظیم بتا-اکسیداسیون توسط نیاز متابولیک
بتا-اکسیداسیون تحت تنظیم آنزیمی و هورمونی شدیدی قرار دارد. برای مثال:
-
انسولین با مهار CPT1، مانع از ورود اسیدهای چرب به میتوکندری میشود.
-
گلوکاگون و اپینفرین از طریق افزایش سطح cAMP، لیپولیز را در بافت چربی فعال کرده و غلظت اسیدهای چرب آزاد را در خون افزایش میدهند.
-
مالونیلکوآ بهعنوان مهارکنندهی مستقیم CPT1، نقش مهمی در کنترل رقابت بین سنتز اسید چرب و اکسیداسیون آن دارد.
تنظیم متابولیسم چربی توسط هورمونها و فاکتورهای تغذیهای
متابولیسم چربی، یک مسیر دینامیک و پیچیده است که بهشدت تحتتأثیر سیگنالهای هورمونی و وضعیت تغذیهای بدن قرار دارد. هماهنگی دقیق بین سیستم عصبی، سیستم غدد درونریز و فاکتورهای تغذیهای تضمین میکند که اسیدهای چرب در زمان مناسب و به مقدار کافی وارد چرخه انرژی شوند یا بهصورت ذخیره در بافت چربی باقی بمانند.
انسولین؛ مهارگر اصلی چربیسوزی
انسولین بهعنوان یک هورمون آنابولیک، مهمترین تنظیمکننده منفی بتا-اکسیداسیون و لیپولیز است. این هورمون با:
-
فعالسازی آنزیم لیپوژنز )سنتز اسیدهای چرب)
-
مهار آنزیم HSL (هورمون حساس لیپاز در بافت چربی(
-
افزایش غلظت مالونیلکوآ که CPT1 را مهار میکند
عملاً مسیر چربیسوزی را در شرایط تغذیهای پرکربوهیدرات متوقف میسازد.
گلوکاگون و اپینفرین؛ تحریککنندههای لیپولیز و اکسیداسیون چربی
در پاسخ به گرسنگی، ورزش یا استرس، هورمونهای گلوکاگون و اپینفرین ترشح میشوند و با فعالسازی مسیر cAMP–PKA، منجر به:
-
تحریک لیپولیز در بافت چربی و افزایش اسیدهای چرب آزاد در خون
-
تسهیل ورود این اسیدهای چرب به سلولهای هدف مانند عضله و کبد
-
فعالسازی بتا-اکسیداسیون درون میتوکندری
میشوند. این فرایندها نقش اساسی در تأمین انرژی در شرایط کاهش گلوکز دارند.
هورمون رشد و کورتیزول؛ تنظیم بلندمدت و تطبیقی
-
هورمون رشد (GH) با افزایش حساسیت سلولها به کاتکولآمینها، بهصورت غیرمستقیم لیپولیز را افزایش میدهد.
-
کورتیزول، با اثرات پرولانگه و تطبیقی، موجب افزایش دسترسی اسیدهای چرب آزاد در شرایط استرس مزمن یا بیماریهای متابولیک میشود.
هرچند کورتیزول در کوتاهمدت به تأمین انرژی کمک میکند، اما در بلندمدت میتواند سبب تجمع چربی احشایی و مقاومت به انسولین شود.
فاکتورهای تغذیهای و مسیرهای سیگنالینگ تغذیهمحور
نوع و نسبت درشتمغذیهای دریافتی تأثیر مستقیمی بر متابولیسم چربی دارد:
-
رژیمهای پرکربوهیدرات موجب افزایش ترشح انسولین و مهار لیپولیز میشوند.
-
رژیمهای کمکربوهیدرات و کتوجنیک سطح انسولین را کاهش داده و با افزایش کتونها، بتا-اکسیداسیون را تقویت میکنند.
-
اسیدهای چرب غیراشباع (مثل امگا-۳) با فعالسازی گیرندههای PPARα، ژنهای دخیل در اکسیداسیون چربی را افزایش میدهند.
همچنین ترکیباتی نظیر رزوراترول، پلیفنولها و کافئین نیز با فعالسازی مسیرهای AMPK میتوانند چربیسوزی را تقویت نمایند.
نقش تمرین ورزشی در تعدیل سیگنالهای هورمونی
ورزش نهتنها با مصرف مستقیم اسیدهای چرب بهعنوان منبع انرژی عمل میکند، بلکه بهصورت مزمن منجر به:
-
افزایش حساسیت انسولینی
-
بهبود فعالیت آنزیمهای بتا-اکسیداسیون
-
تنظیم مثبت مسیر AMPK و PGC1-α
میشود. درنتیجه ورزش منظم میتواند بافت عضلانی را بهسمت چربیسوزی کارآمدتر بازبرنامهریزی کند.
متابولیسم لیپید در بافتهای مختلف
متابولیسم چربی نهتنها یک فرایند همگن نیست، بلکه در بافتهای مختلف بدن با الگوها و عملکردهای متمایز انجام میگیرد. هر بافت با توجه به نیازهای انرژیزا، ترکیب آنزیمی، و پاسخهای هورمونی، نقش متفاوتی در اکسیداسیون، ذخیرهسازی یا سنتز لیپیدها ایفا میکند. درک این تفاوتها برای تحلیل دقیق وضعیتهای فیزیولوژیک و پاتولوژیک بسیار حائز اهمیت است.
کبد؛ مرکز تنظیم متابولیسم چربی
کبد مهمترین ارگان در تنظیم هموستاز لیپیدی است و عملکردهای زیر را برعهده دارد:
-
سنتز اسیدهای چرب از گلوکز (لیپوژنز) در شرایط مازاد انرژی
-
اکسیداسیون اسیدهای چرب و تولید ATP به ویژه در دوران روزهداری
-
تولید کتون بادیها در شرایط کاهش قند خون یا رژیمهای کتوجنیک
-
بازسازی تریگلیسریدها و لیپوپروتئینهای VLDL برای ارسال چربی به سایر بافتها
کبد نقش کلیدی در توزیع مجدد چربیها و تنظیم سطح چربی خون دارد.
بافت چربی؛ مرکز ذخیرهسازی و آزادسازی چربی
بافت چربی (بهویژه بافت چربی سفید) مکان اصلی ذخیرهسازی چربیها بهشکل تریگلیسرید است. این بافت تحت تأثیر هورمونها میتواند بهصورت پویا عمل کند:
-
در حضور انسولین، لیپوژنز و ذخیره چربی افزایش مییابد.
-
در شرایط ناشتا یا ورزش، با فعالسازی لیپازها، اسیدهای چرب آزاد (FFA) به خون وارد میشوند تا در سایر بافتها مصرف گردند.
در مقابل، بافت چربی قهوهای بهواسطه داشتن میتوکندریهای فراوان و پروتئین UCP1، وظیفه تولید گرما از چربیها را دارد و نقش مهمی در ترموژنز غیرلرزشی ایفا میکند.
عضلات اسکلتی؛ مصرفکننده بزرگ اسیدهای چرب در ورزش و استراحت
عضلات، بسته به شدت فعالیت فیزیکی، از منابع مختلف انرژی استفاده میکنند. در شرایط استراحت یا فعالیتهای هوازی سبک تا متوسط:
-
اسیدهای چرب منبع اصلی انرژی هستند
-
با افزایش شدت تمرین، سهم مصرف گلوکز افزایش مییابد
-
تمرین مداوم موجب افزایش ظرفیت اکسیداتیو عضله میشود (افزایش آنزیمهای بتا-اکسیداسیون، تراکم میتوکندری)
عضلات تمریندیده بهطور قابل توجهی در استفاده بهینه از چربیها کارآمدتر میشوند.
قلب؛ مصرفکننده دائمی اسیدهای چرب
عضله قلب بهطور غالب از بتا-اکسیداسیون اسیدهای چرب برای تولید انرژی استفاده میکند، حتی در زمان استراحت. ویژگیهای خاص متابولیک قلب شامل موارد زیر است:
-
تراکم بالای میتوکندری
-
توان بالای مصرف اکسیژن
-
انعطافپذیری در استفاده از کتونها، لاکتات و گلوکز در شرایط مختلف
در نارسایی قلبی، متابولیسم چربی بهنفع استفاده از گلوکز تغییر میکند، که نشاندهنده اهمیت تطبیق متابولیک در بیماریهاست.
مغز؛ وابسته به گلوکز ولی با توانایی تطبیق با کتونها
مغز در حالت نرمال از گلوکز بهعنوان منبع اصلی انرژی استفاده میکند، چراکه عبور اسیدهای چرب از سد خونی-مغزی محدود است. اما در شرایط گرسنگی یا رژیم کتوجنیک:
-
کبد با تولید اجسام کتونی (مانند بتاهیدروکسیبوتیرات(, منبع جایگزین برای سوخترسانی به مغز فراهم میکند
-
این تطبیق، بقاء نورونها را در دورههای کمبود قند خون ممکن میسازد
در بیماریهای نورودژنراتیو، استفاده از کتونها بهعنوان سوخت جایگزین مورد توجه درمانی قرار گرفته است.
بتا-اکسیداسیون و سلامت زنان یائسه
دوره یائسگی با تغییرات چشمگیری در سطح هورمونهای جنسی، بهویژه کاهش استروژن همراه است. این تغییرات هورمونی تأثیر مستقیم و غیرمستقیم بر متابولیسم چربی و فرایند بتا-اکسیداسیون دارند. بهدلیل کاهش کارایی سوختوساز چربی در این دوران، زنان یائسه در معرض افزایش چربی احشایی، کاهش حساسیت به انسولین و افزایش ریسک بیماریهای قلبی و متابولیک قرار میگیرند.
نقش استروژن در تنظیم اکسیداسیون چربی
استروژن از طریق گیرندههای هستهای مانند ERα و ERβ، بیان ژنهای مرتبط با بتا-اکسیداسیون اسیدهای چرب در میتوکندری را تحریک میکند. مطالعات نشان دادهاند که:
-
استروژن موجب افزایش فعالیت آنزیمهایی مانند CPT1، HADH و ACADL میشود که برای ورود و تجزیه اسیدهای چرب در میتوکندری ضروری هستند.
-
در دوره پس از یائسگی، کاهش استروژن منجر به افت ظرفیت اکسیداتیو عضلات و تمایل بیشتر به ذخیرهسازی چربی میگردد.
-
همچنین، عملکرد میتوکندری در سلولهای عضلانی زنان یائسه تضعیف شده و تولید ATP از طریق چربیها کاهش مییابد.
تغییرات ترکیب بدنی و خطرات متابولیکی
زنان یائسه معمولاً شاهد افزایش چربی احشایی و کاهش توده عضلانی هستند. این تغییرات ترکیب بدنی با کاهش نرخ بتا-اکسیداسیون و افزایش چربی خون همراه است. پیامدهای این تغییر عبارتند از:
-
افزایش مقاومت به انسولین
-
افزایش ریسک دیابت نوع ۲
-
بالا رفتن احتمال ابتلا به سندرم متابولیک و بیماریهای قلبیعروقی
بهطور خاص، کاهش توانایی بدن در سوزاندن چربی باعث میشود زنان یائسه نسبت به قبل، کمتر از انرژی چربیها استفاده کنند و در برابر افزایش وزن مستعدتر باشند.
نقش ورزش هوازی و قدرتی در تحریک بتا-اکسیداسیون
ورزش، بهویژه تمرینات هوازی منظم، میتواند بهعنوان راهکاری مؤثر برای افزایش ظرفیت بتا-اکسیداسیون در زنان یائسه مورد استفاده قرار گیرد. اثرات مثبت ورزش در این گروه شامل:
-
افزایش فعالیت آنزیمهای میتوکندریایی مرتبط با بتا-اکسیداسیون
-
بهبود حساسیت به انسولین و کاهش چربی شکمی
-
افزایش توده عضلانی و متابولیسم پایه
ترکیب ورزش هوازی با تمرینات مقاومتی همچنین در افزایش قدرت عضلات و تنظیم مجدد ترکیب بدنی نقش دارد، که نهایتاً منجر به افزایش اکسیداسیون چربی در حال استراحت و حین فعالیت میشود.
نقش تغذیه هدفمند و مکملها
رژیم غذایی در تنظیم بتا-اکسیداسیون نقش کلیدی دارد. زنان یائسه میتوانند با انتخاب مواد غذایی مناسب به افزایش ظرفیت چربیسوزی بدن خود کمک کنند. این شامل موارد زیر است:
-
رژیمهای با کربوهیدرات پایین و چربیهای سالم (مثل رژیم مدیترانهای یا کتوجنیک ملایم(
-
مصرف اسیدهای چرب امگا-3 که موجب افزایش آنزیمهای بتا-اکسیداسیون میشود
-
مکملهایی مانند ال-کارنیتین که انتقال اسیدهای چرب به درون میتوکندری را تسهیل میکند
با این حال، هرگونه مداخله غذایی یا مصرف مکمل باید تحت نظر متخصص تغذیه یا پزشک انجام شود.
متابولیسم لیپید در سلولهای بنیادی و رشد سلولی
سلولهای بنیادی بهعنوان واحدهای پایهای بازسازی و ترمیم بافتها، نیازمند تنظیم دقیق مسیرهای متابولیکی هستند. برخلاف تصور رایج که گلوکز را تنها منبع انرژی سلولی میداند، امروزه مشخص شده است که متابولیسم لیپید نقش کلیدی در بقا، تمایز و خودنوزایی سلولهای بنیادی دارد. در این میان، مسیرهایی نظیر بتا-اکسیداسیون، سنتز اسیدهای چرب و مسیرهای لیپوژنیک/لیپولیتیک بهشدت در تنظیم فعالیت سلولهای بنیادی مشارکت میکنند.
بتا-اکسیداسیون و حفظ حالت نابالغ سلولهای بنیادی
در شرایطی که سلولهای بنیادی در وضعیت غیرفعال یا غیرتمایزیافته قرار دارند، مطالعات نشان میدهند که آنها برای تولید انرژی به بتا-اکسیداسیون اسیدهای چرب در میتوکندری تکیه میکنند. این مکانیسم به دلایل زیر اهمیت دارد:
-
تولید ATP پایدار و پاک بدون تولید زیاد رادیکالهای آزاد
-
تأمین استیلکوآ برای مسیرهای اپیژنتیکی مانند استیلاسیون هیستونها
-
حمایت از حالت self-renewal و بازدارندگی از ورود به تمایز زودهنگام
این وابستگی به لیپیدها به سلول اجازه میدهد در محیطهای با گلوکز پایین نیز به عملکرد خود ادامه دهد.
نقش سنتز چربی در فرایند تمایز
در هنگام شروع تمایز، سلولهای بنیادی دستخوش تغییرات متابولیکی چشمگیری میشوند، از جمله:
-
کاهش بتا-اکسیداسیون و جایگزینی آن با افزایش گلیکولیز
-
افزایش بیوسنتز لیپیدها برای پاسخ به نیازهای غشایی سلولهای در حال رشد
-
فعالسازی آنزیمهایی چون ACC، FASN و SCD که نقش کلیدی در ساخت اسیدهای چرب اشباع و غیر اشباع دارند
این تغییر به سلول اجازه میدهد تا برای تکثیر و رشد، منابع ساختاری مورد نیاز (نظیر فسفولیپیدهای غشایی) را تولید کند.
تنظیم متابولیسم لیپید توسط فاکتورهای رشد و مسیرهای سیگنالی
متابولیسم لیپید در سلولهای بنیادی بهشدت تحت تأثیر مسیرهای سیگنالدهی نظیر mTOR، AMPK و Wnt/β-catenin قرار دارد. این مسیرها با توجه به وضعیت محیطی و سلولی، میتوانند مسیرهای لیپوژنیک یا لیپولیتیک را فعال یا مهار کنند. برای مثال:
-
فعالسازی mTOR باعث تحریک سنتز چربی و افزایش تمایز سلولی میشود
-
فعالسازی AMPK موجب افزایش بتا-اکسیداسیون و حمایت از حالت stemness میگردد
-
مسیر Wnt میتواند از طریق تنظیم آنزیمهای لیپوژنیک، بر سرنوشت سلول بنیادی تأثیر بگذارد
کاربردهای پزشکی و درمانی شناخت این مسیرها
درک عمیق از نحوه تنظیم متابولیسم لیپید در سلولهای بنیادی، میتواند منجر به پیشرفتهای مهمی در زمینههای زیر شود:
-
افزایش کارایی درمانهای سلولدرمانی از طریق کنترل سوختوساز سلولها در محیط آزمایشگاهی
-
افزایش توان بازسازی بافتها از طریق تحریک مسیرهای لیپولیتیک هدفمند
-
مقابله با سرطانهای بنیادیمنشأ با مهار متابولیسم چربی در سلولهای بنیادی سرطانی
متابولیسم لیپید در سلولهای بنیادی و رشد سلولی
سلولهای بنیادی بهعنوان پایهایترین اجزای بازسازی و نوسازی بافتهای بدن، نیازمند تنظیم دقیق فعالیتهای متابولیکی هستند. برخلاف برداشت سنتی که مسیرهای گلوکولیتیک را منبع اصلی انرژی در نظر میگرفت، اکنون روشن شده که متابولیسم لیپید، بهویژه بتا-اکسیداسیون اسیدهای چرب، نقش محوری در بقای سلولهای بنیادی، تصمیمگیری برای تمایز، و حفظ وضعیت ناپخته (undifferentiated state) دارد.
نقش بتا-اکسیداسیون در حفظ حالت بنیادی
در شرایطی که سلولهای بنیادی در وضعیت سکون یا self-renewal هستند، آنها ترجیح میدهند از بتا-اکسیداسیون اسیدهای چرب بهعنوان منبع انرژی تمیز و پایدار استفاده کنند. این فرآیند، علاوه بر تولید ATP، میزان تولید رادیکالهای آزاد را پایین نگه میدارد و از آسیب اکسیداتیو جلوگیری میکند. همچنین، محصولات میانی این مسیر مانند استیلکوآ نقش مهمی در تنظیم اپیژنتیکی ژنها از طریق استیلاسیون هیستونها ایفا میکنند.
تعویض متابولیکی هنگام آغاز تمایز سلولی
با شروع تمایز، سلولهای بنیادی دچار یک شیفت متابولیکی از اکسیداسیون چربیها به گلیکولیز میشوند. همزمان، فعالیت آنزیمهای سنتز اسیدهای چرب نیز افزایش مییابد تا نیاز سلولهای در حال رشد به فسفولیپیدها و دیگر چربیهای ساختاری تأمین گردد. این بازآرایی متابولیکی برای پشتیبانی از تقسیم سریع، تشکیل غشاهای جدید و تنظیم سیگنالینگ تمایزی ضروری است.
کنترل متابولیسم لیپید توسط مسیرهای سیگنالینگ
تنظیم متابولیسم چربی در سلولهای بنیادی بهشدت وابسته به مسیرهای سیگنالینگ درونسلولی نظیر mTOR، AMPK، PPAR و Wnt/β-catenin است. برای مثال:
-
AMPK با فعالسازی اکسیداسیون چربیها و مهار سنتز آنها، به حفظ انرژی و بقای سلولهای بنیادی کمک میکند.
-
mTOR زمانی که فعال میشود، سنتز لیپیدها را افزایش داده و تمایز سلول را تحریک میکند.
-
PPARα و γ نیز بهترتیب در تنظیم بتا-اکسیداسیون و لیپوژنز نقش ایفا میکنند.
ترکیب این مسیرها تعیین میکند که آیا سلول بنیادی در وضعیت خام باقی بماند یا وارد تمایز شود.
کاربردهای درمانی و پژوهشی تنظیم متابولیسم لیپید در سلولهای بنیادی
درک دقیق از تنظیم متابولیسم لیپید در سلولهای بنیادی میتواند به پیشرفتهای بزرگی در طب بازساختی، درمانهای مبتنی بر سلول، و حتی سرطانشناسی منجر شود:
-
در سلولدرمانی، تنظیم صحیح مسیرهای لیپیدی در شرایط کشت، میتواند بقای سلولها را افزایش دهد.
-
در درمان سرطان، هدفگیری مسیرهای متابولیسم چربی در سلولهای بنیادی سرطانی به عنوان یک راهبرد ضد توموری جدید مطرح است.
-
در مهندسی بافت، بهینهسازی مسیرهای لیپیدی میتواند ظرفیت بازسازی و تمایز بافتی را افزایش دهد.
تنظیم متابولیسم لیپید در شرایط استرس و بیماریها
در شرایط فیزیولوژیکی، متابولیسم چربیها بهگونهای تنظیم میشود که انرژی مورد نیاز سلولها را تأمین کند و همزمان از تعادل بین سنتز و تخریب لیپیدها محافظت نماید. اما در شرایط استرس سلولی، بیماریهای مزمن یا حاد، و اختلالات متابولیک، این تعادل دستخوش تغییراتی میشود که میتواند منجر به آسیب سلولی، التهاب یا پیشرفت بیماری گردد.
پاسخ متابولیکی بدن به استرسهای فیزیولوژیک و پاتولوژیک
در شرایط استرس فیزیولوژیک مانند گرسنگی، ورزش شدید یا سرما، بدن با افزایش لیپولیز در بافت چربی و افزایش بتا-اکسیداسیون در کبد و عضلات پاسخ میدهد تا ATP لازم را فراهم آورد. این فرآیند عمدتاً تحت تأثیر هورمونهای استرس مانند اپینفرین، نوراپینفرین و کورتیزول انجام میشود.
در مقابل، در استرس پاتولوژیک مانند عفونت، آسیب بافتی یا شوک سپتیک، تغییرات پیچیدهتری رخ میدهد. در این شرایط، واکنش التهابی و تولید سایتوکاینها ممکن است متابولیسم چربی را دچار اختلال کرده و منجر به انباشت اسیدهای چرب آزاد و تریگلیسیریدها در بافتهای غیرچربی مانند کبد و عضله شود. این پدیده، موسوم به لیپوتوکسیسیتی، میتواند به التهاب و نکروز سلولی بینجامد.
تغییر متابولیسم چربی در بیماریهای متابولیک مزمن
در بیماریهایی مانند دیابت نوع ۲، چاقی، بیماری کبد چرب غیرالکلی (NAFLD) و سندرم متابولیک، تنظیم متابولیسم چربی دچار اختلالات عمیق میشود. از جمله:
-
در دیابت نوع ۲، مقاومت به انسولین باعث افزایش لیپولیز در بافت چربی و افزایش اسیدهای چرب آزاد (FFA) در خون میشود که با مهار اکسیداسیون چربی در کبد و تحریک سنتز تریگلیسیرید همراه است.
-
در کبد چرب غیرالکلی، عدم توازن بین ورود، سنتز، اکسیداسیون و خروج چربیها منجر به تجمع چربی و التهاب میشود که نهایتاً میتواند به فیبروز یا سیروز پیشرفت کند.
تنظیمات دفاعی سلول در مواجهه با لیپوتوکسیسیتی
سلولها برای مقابله با لیپوتوکسیسیتی ناشی از تجمع چربی، مکانیسمهای حفاظتی متعددی را فعال میکنند:
-
افزایش اکسیداسیون اسیدهای چرب در میتوکندری، پراکسیزوم و شبکه آندوپلاسمی
-
افزایش اتوفاژی لیپیدها (لیپوفاژی) برای حذف قطرات چربی مازاد
-
تنظیم ترشح آدیپوکاینها برای تعدیل التهاب و حفظ هموستاز متابولیک
با این حال، اگر فشار متابولیکی از آستانه توانایی سلول فراتر رود، ممکن است منجر به استرس اکسیداتیو، اختلال عملکرد میتوکندری، و مرگ سلولی آپوپتوتیک یا نکرونیک گردد.
نقش تغذیه، دارو و سبک زندگی در بازگرداندن تعادل متابولیکی
مطالعات نشان دادهاند که رژیمهای غذایی کمکربوهیدرات و پرچرب کنترلشده (مثل کتوژنیک)، مکملهای تغذیهای نظیر اُمگا-۳، پلیفنولها، و کارنیتین، و همچنین افزایش فعالیت بدنی منظم میتوانند به بازگرداندن تعادل بین سنتز و اکسیداسیون لیپیدها کمک کنند.
از سوی دیگر، داروهایی مانند متفورمین، تیازولیدیندیونها (TZDs)، و مهارکنندههای SGLT2 نیز از طریق مسیرهای مختلف در بهبود متابولیسم چربی و کاهش التهاب مؤثر بودهاند.
تنظیمکنندههای مولکولی کلیدی در متابولیسم لیپید: PPARها، AMPK، و نقش میتوکندری
متابولیسم لیپید به دقت توسط شبکهای از تنظیمکنندههای مولکولی کنترل میشود که به سلولها امکان میدهند تا با تغییر شرایط محیطی و انرژی، پاسخ مناسبی در مصرف و ذخیره چربیها داشته باشند. در میان این تنظیمکنندهها، PPARها (Peroxisome Proliferator-Activated Receptors)، AMPK (AMP-Activated Protein Kinase) و میتوکندری نقشهای حیاتی دارند که در ادامه به بررسی آنها میپردازیم.
نقش PPARها در تنظیم متابولیسم چربی
PPARها خانوادهای از گیرندههای هستهای هستند که به عنوان فاکتورهای رونویسی عمل کرده و بیان ژنهای مرتبط با متابولیسم اسیدهای چرب، التهاب و تولید انرژی را تنظیم میکنند. سه ایزوفرم اصلی این خانواده عبارتند از:
-
: PPARα عمدتاً در کبد، قلب، و عضله اسکلتی بیان میشود و بیان ژنهای مرتبط با اکسیداسیون اسیدهای چرب در میتوکندری و پراکسیزومها را افزایش میدهد. فعالسازی PPARα موجب افزایش ظرفیت بتا-اکسیداسیون و کاهش تریگلیسیریدهای سرم میشود.
-
PPARγ : عمدتاً در بافت چربی بیان شده و در تنظیم تمایز آدیپوسیتها و ذخیره چربی نقش دارد. این گیرنده همچنین حساسیت به انسولین را بهبود میبخشد.
-
PPARδ یا: (PPARβ) در بافتهای مختلفی مانند عضله و مغز بیان میشود و در تنظیم انرژی و سوختوساز لیپید نقش دارد.
فعالسازی PPARها توسط لیگاندهای طبیعی (مانند اسیدهای چرب و مشتقاتشان) و داروهای خاص (مانند فیبراتها و تیازولیدیندیونها) موجب بهبود متابولیسم لیپید و کاهش التهاب مزمن میشود.
نقش AMPK به عنوان سنسور انرژی سلول
AMPK یک کیناز حساس به نسبت AMP/ATP است که در شرایط کمبود انرژی فعال میشود. فعال شدن AMPK باعث:
-
افزایش فرآیندهای کاتابولیک مانند بتا-اکسیداسیون اسیدهای چرب و گلیکولیز
-
مهار فرآیندهای آنابولیک مانند سنتز لیپید و پروتئین
-
تحریک ورود گلوکز به سلولها
AMPK به واسطه این مکانیسمها به حفظ تعادل انرژی سلولی کمک میکند و نقش مهمی در پیشگیری از اختلالات متابولیک مانند چاقی و دیابت دارد.
میتوکندری؛ مرکز سوختوساز و کنترلکننده متابولیسم لیپید
میتوکندریها نقش محوری در اکسیداسیون اسیدهای چرب دارند و بتا-اکسیداسیون را درون خود انجام میدهند تا انرژی به شکل ATP تولید شود. کارکرد صحیح میتوکندری برای حفظ سلامت سلولی و کنترل متابولیسم لیپید حیاتی است.
در شرایطی مانند استرس اکسیداتیو، آسیب میتوکندریایی میتواند منجر به کاهش ظرفیت اکسیداسیون چربی و افزایش تولید رادیکالهای آزاد شود که به التهاب و تخریب سلولی میانجامد. علاوه بر این، تغییرات در بیوژنز میتوکندری و فرآیندهای مرتبط مانند فیوژن و فیسیون، میتواند بر عملکرد کلی سلول و پاسخ آن به تغییرات متابولیکی تأثیرگذار باشد.
تعامل بین PPARها، AMPK و میتوکندری
این سه تنظیمکننده مولکولی در یک شبکه پیچیده با هم تعامل دارند. به عنوان مثال، فعالسازی AMPK میتواند منجر به افزایش بیان PPARα شود و بهبود عملکرد میتوکندری را تقویت کند. همچنین، PPARها نقش تنظیمکننده ژنهای کدکننده پروتئینهای میتوکندریایی را دارند که در فرایند اکسیداسیون چربی شرکت میکنند.
این هماهنگی باعث میشود که سلولها بتوانند در برابر تغییرات انرژی محیطی واکنش بهینهای نشان دهند و تعادل بین ذخیره و مصرف لیپید را حفظ کنند.
درمانهای هدفمند در متابولیسم چربی: رویکردهای نوین و پیشرفتهای درمانی
با افزایش شیوع بیماریهای مرتبط با اختلالات متابولیسم چربی مانند چاقی، دیابت نوع ۲، بیماریهای قلبی-عروقی و اختلالات کبد چرب، توسعه درمانهای هدفمند که بهصورت مستقیم مسیرهای متابولیکی چربی را تنظیم کنند، به یک ضرورت تبدیل شده است. این درمانها معمولاً با هدف اصلاح ناهنجاریهای متابولیسم لیپید، بهبود عملکرد سلولی و کاهش عوارض ناشی از تجمع چربی طراحی میشوند.
داروهای تنظیمکننده فعالیت PPARها
همانطور که در بخشهای پیشین بیان شد، PPARها تنظیمکنندههای مهمی در متابولیسم لیپید هستند و داروهایی که این گیرندهها را هدف میگیرند، اثرات مفیدی در درمان اختلالات متابولیکی دارند. نمونههای مهم شامل:
-
فیبراتها : که فعالکنندههای PPARα هستند و باعث افزایش اکسیداسیون اسیدهای چرب و کاهش تریگلیسیریدها در خون میشوند. این داروها به ویژه در درمان دیسلیپیدمی موثرند.
-
تیازولیدیندیونها (TZDs) : فعالکنندههای PPARγ بوده و باعث بهبود حساسیت به انسولین و تنظیم ذخیره چربی میشوند. این داروها در درمان دیابت نوع ۲ کاربرد دارند اما به دلیل برخی عوارض جانبی، استفادهشان محدود شده است.
هدفگیری AMPK و مسیرهای مرتبط
فعالسازی AMPK به عنوان یک سنسور انرژی، یکی از استراتژیهای مهم برای بهبود متابولیسم چربی است. داروهایی مانند متفورمین، که در درمان دیابت نوع ۲ کاربرد دارد، از طریق فعالسازی AMPK باعث افزایش اکسیداسیون چربی و بهبود حساسیت به انسولین میشوند.
در سالهای اخیر، داروهای جدیدی نیز توسعه یافتهاند که مستقیماً مسیرهای فعالسازی AMPK را هدف میگیرند یا از طریق مسیرهای مرتبط، تعادل انرژی سلولی را بهبود میبخشند.
استفاده از تنظیمکنندههای میتوکندریایی
میتوکندری به عنوان مرکز سوختوساز چربی، هدف مهمی برای داروهای نوین به شمار میآید. برخی داروها و ترکیبات طبیعی با هدف بهبود عملکرد میتوکندری، افزایش بیوژنز و کاهش استرس اکسیداتیو میتوانند به بهبود متابولیسم لیپید کمک کنند.
برای نمونه، برخی آنتیاکسیدانها و مولکولهای کوچک که باعث بهبود ظرفیت اکسیداتیو میتوکندری میشوند، در مطالعات آزمایشگاهی و بالینی مورد بررسی قرار گرفتهاند.
درمانهای نوین مبتنی بر RNA و ژندرمانی
پیشرفتهای فناوریهای زیستی، امکان طراحی درمانهای مبتنی بر RNAهای کوچک (مانند siRNA و( miRNA را فراهم کرده که قادرند ژنهای کلیدی در مسیرهای متابولیک لیپید را به صورت هدفمند خاموش یا تنظیم کنند.
این رویکردها پتانسیل زیادی برای درمان دقیقتر بیماریهای متابولیکی دارند، اگرچه هنوز در مراحل ابتدایی تحقیق و توسعه قرار دارند.
نقش تغذیه و مکملهای غذایی در درمان هدفمند
در کنار داروهای شیمیایی، ترکیبات طبیعی مانند اسیدهای چرب امگا-۳، پلیفنولها، و ترکیبات گیاهی میتوانند به عنوان درمانهای مکمل برای تنظیم متابولیسم لیپید مورد استفاده قرار گیرند.
این مواد میتوانند از طریق بهبود فعالیت آنزیمها، تنظیم بیان ژنها، و کاهش التهاب مزمن، به تعادل بهتر متابولیسم چربی کمک کنند.
تکنولوژیهای نوین در بررسی و کنترل متابولیسم لیپید: چشماندازهای آینده
پیشرفتهای سریع در فناوریهای زیستی و ابزارهای تحلیلی، تحولی چشمگیر در مطالعه و کنترل متابولیسم لیپید ایجاد کردهاند. این تکنولوژیها امکان فهم عمیقتر مکانیزمهای مولکولی و سلولی متابولیسم چربی را فراهم میآورند و راه را برای درمانهای شخصیسازی شده و دقیقتر هموار میکنند.
تکنولوژیهای تصویربرداری پیشرفته
تصویربرداریهای پیشرفته مانند MRI با تشدید چربی (Fat MRI) و PET-CT امکان مشاهده تجمع، توزیع و تغییرات متابولیکی چربی در بافتهای مختلف را در بدن زنده فراهم میکنند. این فناوریها به ویژه در مطالعه چاقی، بیماریهای کبد چرب و متابولیسم بافتهای چربی سفید و قهوهای کاربرد دارند.
فناوریهای اومیکس (Omics)
با توسعه فناوریهای ژنومیکس، ترانسکریپتومیکس، پروتئومیکس و متابولومیکس، محققان قادر شدهاند تا نقشههای گستردهای از تغییرات مولکولی مرتبط با متابولیسم لیپید در سطح ژن، RNA، پروتئین و متابولیتها را تهیه کنند.
-
متابولومیکس به خصوص در شناسایی مسیرهای جدید متابولیکی و نشانگرهای زیستی بیماریها نقش کلیدی دارد.
-
این دادهها با استفاده از هوش مصنوعی و یادگیری ماشین تحلیل شده و الگوهای پیچیده متابولیسم چربی را آشکار میکنند.
فناوری CRISPR و مهندسی ژنتیک
استفاده از سیستم ویرایش ژن CRISPR-Cas9 امکان دستکاری دقیق ژنهای کلیدی متابولیسم لیپید را فراهم کرده است. این فناوری در مدلهای حیوانی و سلولی برای مطالعه عملکرد ژنها و توسعه درمانهای ژنتیکی به کار میرود.
نانوتکنولوژی در تحویل داروهای هدفمند
نانوزیستفناوری به ویژه در توسعه سیستمهای تحویل دارو برای هدفگیری دقیق سلولها و بافتهای مرتبط با متابولیسم چربی اهمیت یافته است. این سیستمها میتوانند داروها یا مولکولهای تنظیمکننده متابولیسم را با دقت بالا و با حداقل عوارض جانبی به محل مورد نظر برسانند.
حسگرهای زیستی و فناوریهای پوشیدنی
حسگرهای زیستی پیشرفته و دستگاههای پوشیدنی قادرند به طور مداوم پارامترهای متابولیکی بدن، مانند سطح اسیدهای چرب آزاد، گلوکز و کتونها را اندازهگیری کنند. این فناوریها امکان پایش لحظهای و مدیریت بهتر بیماریهای متابولیکی را فراهم میکنند.
جمعبندی و پاسخ به پرسشهای پرتکرار متخصصان در زمینه متابولیسم لیپید
متابولیسم لیپید یکی از فرآیندهای حیاتی در بدن است که نقش کلیدی در تأمین انرژی، ساختار سلولی و تنظیم هومئوستاز متابولیکی ایفا میکند. طی این مقاله، به بررسی جامع مسیرهای متابولیسم چربی، تنظیمهای هورمونی، نقش بافتهای مختلف، و تأثیر شرایط فیزیولوژیک و پاتولوژیک پرداختیم. همچنین، فناوریهای نوین و روشهای درمانی هدفمند را مرور کردیم که همگی در جهت بهبود فهم و کنترل فرآیندهای مرتبط با چربیها در بدن هستند.
در این بخش، به تعدادی از پرسشهای پرتکرار متخصصان پاسخ داده میشود تا ابهامات رایج رفع و اطلاعات کاربردیتر ارائه گردد:
متابولیسم لیپید چگونه میتواند در کنترل بیماریهای متابولیک نقش داشته باشد؟
تنظیم دقیق متابولیسم چربی از طریق کنترل هورمونی و مولکولی، به ویژه با تأکید بر مسیرهای بتا-اکسیداسیون و فعالیت PPARها، میتواند از پیشرفت بیماریهایی مانند دیابت نوع ۲، چاقی و بیماریهای قلبی جلوگیری کند. بهبود عملکرد میتوکندری و استفاده از درمانهای هدفمند نیز از استراتژیهای مؤثر به شمار میروند.
آیا تکنولوژیهای نوین واقعا کاربرد بالینی دارند یا بیشتر در سطح تحقیق باقی میمانند؟
بسیاری از فناوریهای نوین مانند CRISPR، حسگرهای زیستی و تصویربرداری پیشرفته هماکنون در مطالعات بالینی و برخی موارد درمانی به کار رفتهاند. اما برای رسیدن به کاربردهای گستردهتر، تحقیقات بیشتر و بررسی ایمنی طولانیمدت نیاز است.
چگونه میتوان متابولیسم لیپید را در شرایط استرس یا بیماری بهبود بخشید؟
در شرایط استرس و بیماری، افزایش سطح هورمونهای کاتابولیک و التهاب میتواند متابولیسم چربی را مختل کند. مداخلات تغذیهای، کنترل التهاب، استفاده از داروهای ضد التهابی و تنظیمکنندههای مولکولی مانند AMPK میتوانند به بهبود این وضعیت کمک کنند.
نقش متابولیسم لیپید در سلولهای بنیادی چه اهمیتی دارد؟
متابولیسم چربی در تأمین انرژی و تولید سیگنالهای زیستی برای تمایز و رشد سلولهای بنیادی حیاتی است. تنظیم این مسیرها میتواند در بهبود درمانهای سلولی و بازسازی بافتها موثر باشد.
آینده پژوهشهای متابولیسم لیپید به کدام سمت در حال حرکت است؟
تمرکز آینده بر روی استفاده از دادههای بزرگ (Big Data)، یادگیری ماشین، و فناوریهای مولکولی برای طراحی درمانهای شخصیسازی شده و درک بهتر ارتباط متابولیسم چربی با بیماریهای مزمن و پیری است.