اصول کلی روش الکتروفورز Electrophoresis
الکتروفورز ژل آگارز برای جداسازی قطعات DNA
الکتروفورز ژل آگارز مؤثرترین روش برای جداسازی قطعات DNA با اندازههای مختلف است که دامنهای از 100 جفت باز (bp) تا 25 هزار جفت باز (kb) را در بر میگیرد.
آگارز از جلبکهای دریایی از جنس Gelidium و Gracilaria استخراج میشود و از زیرواحدهای تکرارشوندهی آگاروبیوز (که شامل L- و D-گالاکتوز است) تشکیل شده است. هنگام ژل شدن (gelation)، پلیمرهای آگارز بهصورت غیرکوالانسی با یکدیگر پیوند برقرار میکنند و شبکهای از دستهها (bundles) را تشکیل میدهند که اندازهی حفرههای موجود در این شبکه، ویژگیهای جداسازی مولکولی ژل را تعیین میکند.
استفاده از الکتروفورز ژل آگارز یک انقلاب در جداسازی DNA به وجود آورد. پیش از آن، جداسازی DNA معمولاً با سانتریفیوژ گرادیان چگالی ساکارز (sucrose density gradient centrifugation) انجام میشد که تنها میتوانست تقریبی از اندازهی DNA ارائه دهد، نه اندازهی دقیق آن.
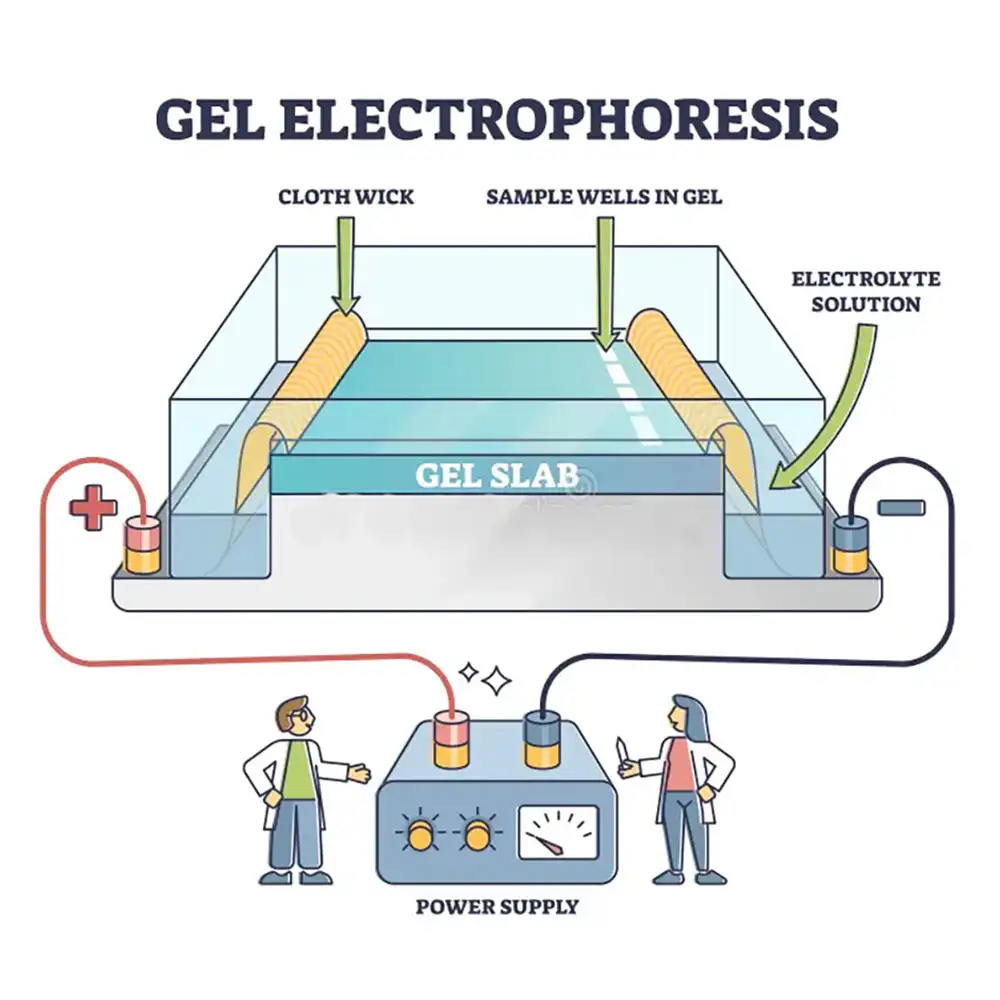
برای جداسازی DNA با استفاده از ژل آگارز، نمونههای DNA درون چاهکهای از قبل آمادهشده در ژل ریخته میشوند و سپس جریان الکتریکی اعمال میگردد. چون ستون فُسفات موجود در ساختار DNA (و RNA) دارای بار منفی است، زمانی که در میدان الکتریکی قرار میگیرد، قطعات DNA به سمت آند (قطب مثبت) حرکت میکنند.
از آنجایی که DNA دارای نسبت جرم به بار یکنواختی است، مولکولهای DNA فقط بر اساس اندازه از یکدیگر جدا میشوند. در ژل آگارز، فاصلهای که DNA طی میکند با لگاریتم وزن مولکولی آن نسبت معکوس دارد؛ یعنی هر چه قطعه کوچکتر باشد، بیشتر حرکت میکند.
مدل غالب برای حرکت DNA در ژل آگارز «خزیدن جهتدار (biased reptation)» است، که در آن لبهی جلویی DNA به جلو حرکت میکند و بقیهی مولکول را به دنبال خود میکشد.
عوامل مؤثر بر سرعت حرکت DNA در ژل آگارز عبارتند از:
-
اندازهی مولکول DNA
-
غلظت آگارز
-
ساختار (کانفورماسیون) DNA
-
میزان ولتاژ اعمالشده
-
وجود یا عدم وجود اتیدیوم بروماید (ethidium bromide)
-
نوع آگارز استفادهشده
-
نوع بافر الکتروفورز
بعد از جداسازی، مولکولهای DNA با استفاده از رنگهای خاص قابل مشاهده میشوند، که در زیر نور UV پس از رنگآمیزی مناسب، بهصورت باندهایی نمایان میگردند.
با دنبال کردن این پروتکل، دانشجویان باید بتوانند:
-
مکانیزم جداسازی قطعات DNA درون ماتریس ژل را درک کنند.
-
درک کنند که چگونه ساختار DNA بر تحرک آن درون ژل تأثیر میگذارد.
-
غلظت مناسب آگارز را بر اساس نیازشان انتخاب کنند.
-
ژل آگارز را برای الکتروفورز نمونههای DNA آماده کنند.
-
دستگاه الکتروفورز و منبع تغذیه را راهاندازی نمایند.
-
ولتاژ مناسب برای جداسازی قطعات DNA را انتخاب کنند.
-
مکانیزم عملکرد اتیدیوم بروماید در مشاهدهی باندهای DNA را بفهمند.
-
اندازهی قطعات DNA جداسازیشده را تعیین کنند.
پروتکل
1. آمادهسازی ژل
مقدار مناسبی از آگارز را وزن کرده و درون یک ارلن (فلاسک مخروطیشکل) بریزید. ژل آگارز به صورت محلول درصد وزنی/حجمی (w/v) تهیه میشود. غلظت آگارز در ژل به اندازه قطعات DNA که قرار است جدا شوند بستگی دارد، اما معمولاً بین ۰.۵٪ تا ۲٪ متغیر است. حجم بافر نباید از یکسوم ظرفیت فلاسک بیشتر باشد.
سپس بافر رانینگ را به فلاسک حاوی آگارز اضافه کنید و با چرخاندن بهآرامی مخلوط کنید. رایجترین بافرهای استفادهشده برای ژل عبارتاند از:
-
TAE (حاوی ۴۰ میلیمولار تریس-استات و ۱ میلیمولار EDTA)
-
TBE (حاوی ۴۵ میلیمولار تریس-بورات و ۱ میلیمولار EDTA)
مخلوط آگارز و بافر را ذوب کنید. این کار معمولاً با مایکروویو انجام میشود، اما میتوان از شعله چراغ بونزن نیز استفاده کرد. هر ۳۰ ثانیه یکبار فلاسک را خارج کرده، محتویات را بچرخانید تا خوب مخلوط شود. این فرآیند را ادامه دهید تا آگارز کاملاً حل شود.
در مرحله بعد، اتیدیوم بروماید (EtBr) را به مخلوط اضافه کنید تا غلظت نهایی ۰.۵ میکروگرم بر میلیلیتر حاصل شود. بهجای این کار، میتوان ژل را پس از الکتروفورز نیز در بافر حاوی همین غلظت EtBr به مدت ۱۵ تا ۳۰ دقیقه رنگآمیزی کرد و سپس به مدت مساوی در بافر تمیز بیرنگسازی کرد.
نکته مهم: اتیدیوم بروماید یک ماده مشکوک به سرطانزایی است و باید طبق دستورالعملهای مؤسسه یا آزمایشگاه بهدرستی دفع شود. هنگام کار با ژل حاوی EtBr حتماً دستکش بپوشید. البته رنگهای جایگزین برای رنگآمیزی DNA وجود دارند، اما به دلیل حساسیت بالا و هزینه پایین، EtBr همچنان رایجترین گزینه است.
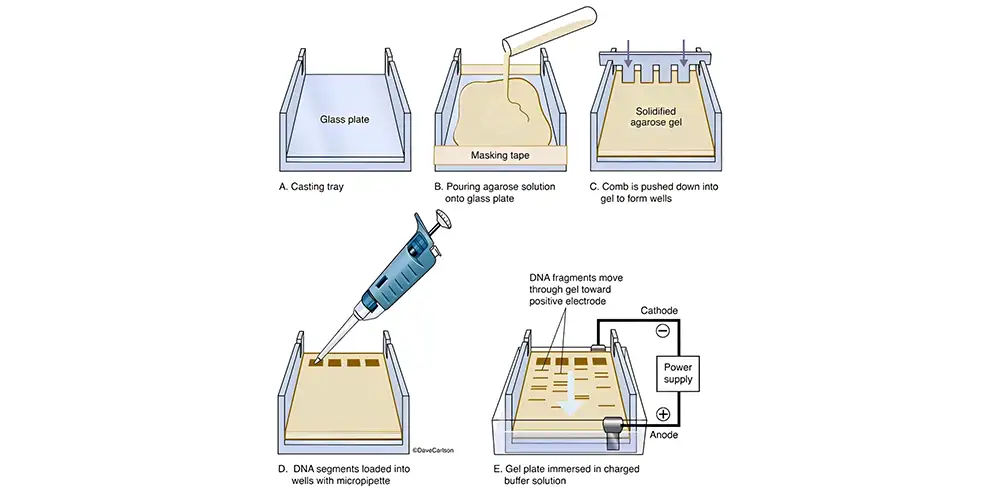
اجازه دهید ژل آگارز خنک شود؛ این کار را میتوان روی میز یا در حمام آب ۶۵ درجه سانتیگراد انجام داد. در صورت عدم خنکسازی مناسب، سینی ژل ممکن است دچار پیچخوردگی شود.
اکنون سینی ژل را داخل دستگاه قالبگیری ژل قرار دهید. بهجای آن میتوان لبههای باز سینی را با نوارچسب پوشاند تا قالبی برای ژل ایجاد شود. سپس یک شانه (comb) مناسب درون قالب ژل قرار دهید تا چاهکها برای نمونهها شکل گیرند.
ژل ذوبشده را بهآرامی درون قالب بریزید و اجازه دهید در دمای اتاق ببندد. پس از بستهشدن ژل، شانه را خارج کرده و ژل را درون مخزن الکتروفورز (gel box) قرار دهید. همچنین میتوان ژل را با پلاستیک بپیچید و تا زمان استفاده در دمای ۴ درجه سانتیگراد نگهداری کرد.
2. راهاندازی دستگاه ژل و جداسازی قطعات DNA
-
به نمونههای DNA موردنظر رنگ بارگیری (loading dye) اضافه کنید. این رنگ معمولاً به صورت غلظت 6X تهیه میشود (حاوی ۰.۲۵٪ برومفنول بلو، ۰.۲۵٪ زایلن سیانول و ۳۰٪ گلیسیرول). رنگ بارگیری به شما کمک میکند تا مسافت حرکت نمونهها را دنبال کنید و همچنین باعث میشود نمونه به کف چاهک فرو برود. رنگ (dye) به نمونهی DNA اضافه میشود تا ویسکوزیته (چسبندگی) نمونه را افزایش دهد. این کار مانع از بیرون رفتن نمونه از چاهکها شده و حرکت نمونه درون ژل را قابل مشاهده میکند.
-
منبع تغذیه را روی ولتاژ دلخواه تنظیم کنید (۱ تا ۵ ولت بر سانتیمتر بین الکترودها).
مقدار کافی از بافر رانینگ را درون مخزن بریزید بهطوری که سطح ژل را کاملاً بپوشاند. حتماً از همان بافری استفاده کنید که ژل را با آن تهیه کردهاید.
سیمهای دستگاه را به منبع تغذیه وصل کرده و مطمئن شوید که دستگاه و منبع بهدرستی کار میکنند.
-
درپوش را بردارید و نمونههای DNA را بهآرامی و با دقت در چاهکها بارگذاری کنید. حتماً یک مارکر سایز DNA (DNA ladder) را نیز همراه با نمونهها بارگذاری کنید تا امکان تخمین اندازه قطعات فراهم شود.
درپوش را دوباره روی دستگاه قرار دهید. توجه کنید که کاتد (سیم سیاه) باید نزدیک به چاهکها قرار گیرد و آند (سیم قرمز) در سمت دیگر باشد. دوباره بررسی کنید که سیمها به درستی به منبع متصل شده باشند.
-
منبع تغذیه را روشن کنید و اجازه دهید ژل تا زمانی که رنگ به مسافت مناسب برسد ادامه یابد.
3. مشاهده قطعات DNA جداشده
پس از پایان الکتروفورز، منبع تغذیه را خاموش کرده و درپوش دستگاه را بردارید.
ژل را از مخزن خارج کرده و بافر اضافی روی سطح آن را تخلیه کنید. سینی ژل را روی دستمال کاغذی قرار دهید تا باقیمانده بافر جذب شود.
سپس ژل را از سینی جدا کرده و آن را در معرض نور فرابنفش (UV) قرار دهید. این کار معمولاً با استفاده از سیستم مستندسازی ژل( ultraviolet transilluminator ) انجام میشود. باندهای DNA بهصورت نوارهای درخشان نارنجیرنگ ظاهر میشوند. از ژل عکس بگیرید.
در پایان، ژل و بافر استفادهشده را مطابق با دستورالعملهای مؤسسه یا آزمایشگاه دفع کنید.
4. نتایج نمایشی
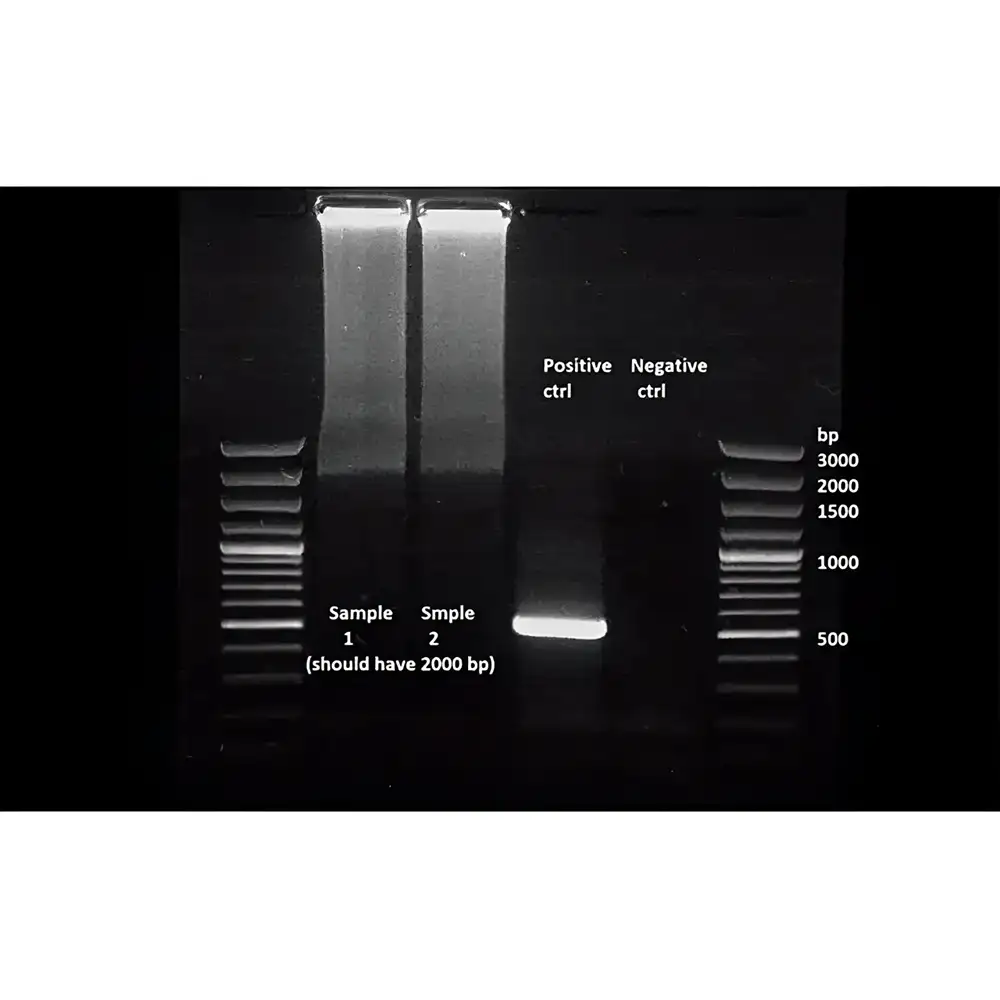
شکل زیر یک نتیجه معمول پس از الکتروفورز ژل آگارز برای محصولات PCR را نشان میدهد. پس از جداسازی، قطعات DNA به صورت نوارهایی مشخص و واضح مشاهده میشوند. استاندارد DNA یا DNA ladder نیز بهخوبی از هم جدا شده تا بتوان اندازه باندهای نمونهها را تخمین زد.
در مثال نمایشدادهشده، قطعات DNA با اندازههای 765 جفتباز، 880 جفتباز و 1022 جفتباز روی ژل آگارز 1.5٪ در کنار نردبان 2-log بهخوبی از هم جدا شدهاند.

شکل1. یک ژل آگارز سفتشده پس از خارج کردن شانه (Comb)

شکل 2 .افزودن رنگ بارگذاری (Loading Dye) به نمونههای DNA

شکل 3 .بارگذاری نمونه DNA در یکی از چاهکهای ژل.

شکل 4. یک نمونه از سیستم مستندسازی ژل.
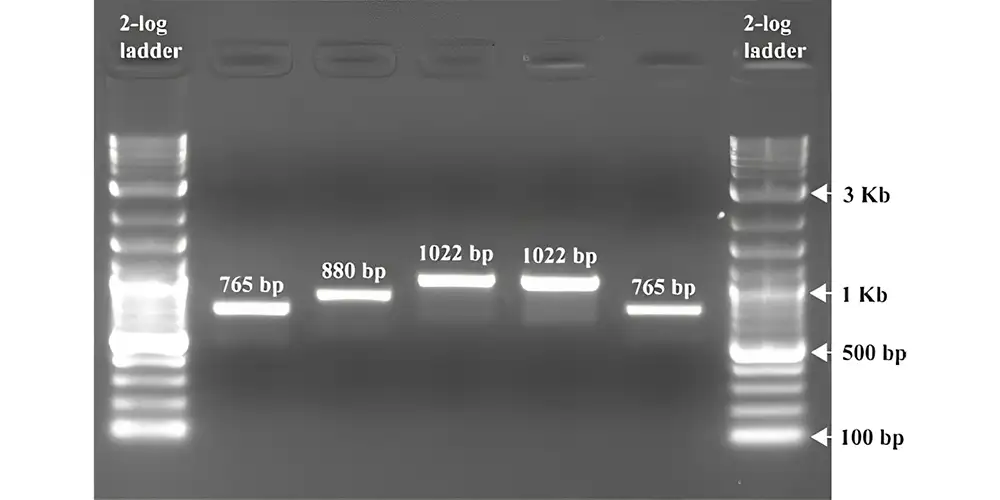
شکل 5. تصویری از یک ژل پس از انجام الکتروفورز.
اتیدیوم بروماید (EtBr) قبل از انجام الکتروفورز به ژل اضافه شد تا به غلظت نهایی ۰٫۵ میکروگرم بر میلیلیتر برسد، سپس فرآیند جداسازی در ولتاژ ۱۰۰ ولت به مدت ۱ ساعت انجام شد.
ژل پس از آن در معرض نور فرابنفش (UV) قرار گرفت و تصویر آن با استفاده از یک سیستم مستندسازی ژل گرفته شد.
بحث
الکتروفورز ژل آگارز، یک روش کارآمد و موثر برای جداسازی اسیدهای نوکلئیک (مثل DNA و RNA) است. ژل آگارز به دلیل استحکام بالایی که دارد، اجازه میدهد از ژلهایی با درصد پایین برای جداسازی قطعات بزرگ DNA استفاده شود.
مکانیزم جداسازی بر اساس "غربال مولکولی" است که توسط اندازه منافذی که در ماتریکس ژل از تجمع رشتههای آگارز ایجاد میشود، مشخص میشود. در کل، هرچه غلظت آگارز بیشتر باشد، اندازه منافذ کوچکتر میشود.
ژلهای آگارز معمولی برای جداسازی قطعات DNA بین 100 جفتباز تا 25 کیلوباز بسیار مناسب هستند. برای جداسازی قطعات بزرگتر از 25 کیلوباز، باید از روش خاصی به نام الکتروفورز پالس فیلد (Pulse Field Gel Electrophoresis) استفاده کرد. در این روش، جریان برق از دو جهت مختلف به صورت متناوب اعمال میشود، که باعث جداسازی قطعات بزرگتر بر اساس سرعت تغییر جهت آنها میشود.
برای جداسازی قطعات DNA کوچکتر از 100 جفتباز، روش مناسبتر الکتروفورز ژل پلیآکریلآمید (PAGE) است. برخلاف ژل آگارز که به صورت فیزیکی ساخته میشود، ژل پلیآکریلآمید از طریق واکنش شیمیایی با رادیکال آزاد تشکیل میشود. این ژلها نازکتر، غلیظتر و با وضوح بالاتری هستند و معمولاً به صورت عمودی اجرا میشوند.
در توالییابی مدرن DNA، از الکتروفورز مویینهای (Capillary Electrophoresis) استفاده میشود که در آن لولههایی باریک با ماتریکس ژل پر شدهاند و به دلیل قابلیت اعمال ولتاژ بالا، جداسازی DNA با سرعت بالا انجام میشود.
آگارز میتواند اصلاح شود تا به شکل "آگارز با نقطه ذوب پایین" درآید که این کار از طریق هیدروکسیاتیلدار کردن انجام میشود. این نوع آگارز زمانی استفاده میشود که بخواهیم قطعات DNA جدا شده را استخراج کنیم. هیدروکسیاتیلدار شدن، چگالی بستهبندی رشتههای آگارز را کاهش داده و منافذ را کوچکتر میکند، در نتیجه قطعهای با همان اندازه، کندتر در ژل آگارز با نقطه ذوب پایین حرکت میکند. از آنجا که این رشتهها با پیوندهای غیرکووالانسی به هم متصلاند، میتوان ژل را بعد از سفت شدن دوباره ذوب کرد.
اتیدیوم بروماید (EtBr) رایجترین ماده برای رنگآمیزی DNA در ژلهای آگارز است. هنگامی که EtBr در معرض نور UV قرار میگیرد، الکترونهای موجود در حلقههای آروماتیک آن فعال شده و با بازگشت به حالت پایه، انرژی به صورت نور آزاد میکنند. EtBr با درج خود بین بازهای DNA به صورت وابسته به غلظت عمل میکند. این ویژگی امکان تخمین میزان DNA موجود در هر باند را بر اساس شدت نور آن فراهم میکند.
به دلیل بار مثبت EtBr، سرعت مهاجرت DNA در ژل را حدود ۱۵٪ کاهش میدهد. همچنین EtBr یک ماده مشکوک به سرطانزایی و جهشزایی است؛ بنابراین هنگام کار با ژلهای حاوی آن باید احتیاط کرد و طبق قوانین، به عنوان پسماند خطرناک دفع شود.
رنگهای جایگزین برای رنگآمیزی DNA در ژل آگارز شامل:
-
SYBR Gold
-
SYBR Green
-
Crystal Violet
-
Methyl Blue
از میان آنها، Crystal Violet و Methyl Blue نیازی به نور UV ندارند و برای کاهش احتمال جهش در صورت نیاز به استخراج DNA از ژل مناسبتر هستند، ولی حساسیت آنها کمتر از EtBr است.
SYBR Gold و SYBR Green رنگهایی بسیار حساس هستند و با نور UV کار میکنند، اما سمیت پایینتری نسبت به EtBr دارند. البته این رنگها قیمت بالایی دارند و برخلاف EtBr، نمیتوانند مستقیماً به ژل اضافه شوند و باید بعد از الکتروفورز به ژل اضافه شوند.
با وجود گزینههای جایگزین، به دلایلی چون ارزان بودن، راحتی استفاده و حساسیت بالا، EtBr هنوز پرکاربردترین رنگ در میان پژوهشگران است. اما در شرایطی مثل آزمایشهای آموزشی برای دانشآموزان یا مشکل بودن دفع زباله خطرناک، ممکن است رنگهای کمخطر ترجیح داده شوند.
رنگهای بارگذاری (Loading Dye) در الکتروفورز ژل سه عملکرد مهم دارند:
-
افزایش چگالی نمونه تا داخل ژل فرو رود.
-
ایجاد رنگ برای تسهیل فرآیند بارگذاری.
-
حرکت با سرعتهای استاندارد در ژل، برای تخمین میزان پیشرفت مهاجرت DNA در طول الکتروفورز.
اندازه دقیق قطعات DNA جدا شده را میتوان با رسم لگاریتم وزن مولکولی باندهای نشانگر DNA در برابر فاصله طی شده آنها تعیین کرد. نشانگر یا DNA Ladder شامل مخلوطی از قطعات با اندازه مشخص است که برای مقایسه با نمونههای ناشناخته استفاده میشود.
نکته مهم: انواع مختلف DNA با سرعتهای متفاوتی از ژل عبور میکنند. مثلاً:
-
DNA سوپرکویل (Supercoiled) به دلیل ساختار فشرده، سریعترین حرکت را دارد.
-
DNA خطی در رتبه بعدی قرار دارد.
-
DNA حلقوی باز (Open Circular) کندترین سرعت مهاجرت را دارد.
الکتروفورز (Electrophoresis)
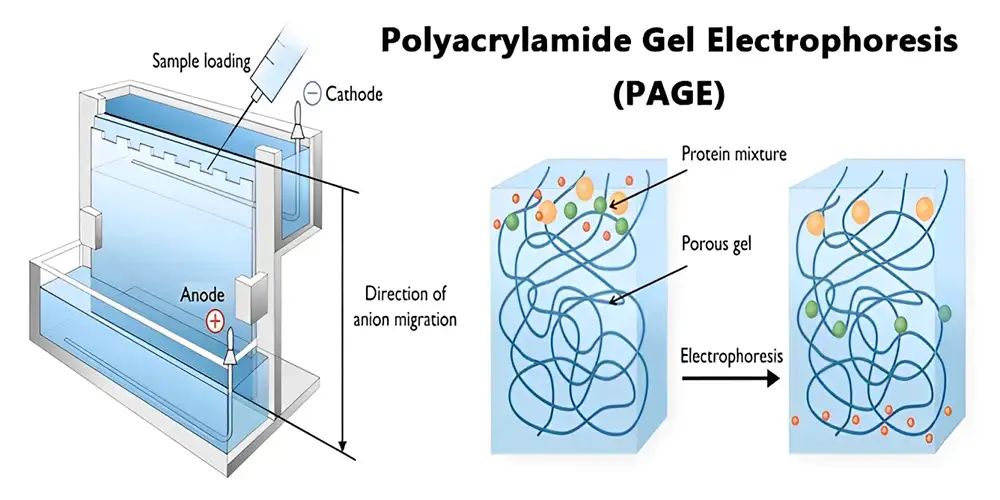
الکتروفورز یکی از تکنیکهای آنالیتیکی قدرتمند در جداسازی و آنالیز دامنه وسیعی از آنالیتها محسوب میگردد. آنالیتهایی که بطور ویژه مورد توجه قرار میگیرند عبارتند از: پروتئینها، آمینواسیدها، اسیدهای نوکلئیک و الیگو نوکلئوتیدها، قندها، داروهای موجود در مایعات و بافتهای بدن. اصطلاح الکتروفورز اشاره به حرکت همه ترکیبات یا ذرات باردار در یک محلول (محیط مایع) تحت تأثیر جریان الکتریکی دارد.
ترکیبات شیمیایی دارای بار الکتریکی به سمت قطب آند و یا کاتد (با توجه به نوع بار الکتریکی) حرکت مینمایند. آمفولیتها (Ampholytes) ترکیباتی هستند که بسته به pH محیط (قلیایی بودن یا اسیدی بودن) دارای بار منفی یا بار مثبت میباشند. برای مثال آمینواسیدها که پروتونهایی حاوی گروههای -NH₂ و -COOH میباشند، و نیز بارهای موجود در اسیدهای نوکلئیک به صورت مثبت یا منفی باشند، در محلولها دارای رفتاری مشابه رفتار آمفولیتها میباشند.
سرعت حرکت ترکیبات موجود در یک نمونه در الکتروفورز به عوامل زیر وابسته است:
-
بار الکتریکی خالص یون
-
اندازه و شکل یون
-
شدت میدان الکتریکی
-
خواص محیط پایه (Support medium)
-
دمای محیط الکتروفورزی
حرکت الکتروفورزی (μ) :
برحسب تعریف عبارت است از میزان حرکت ذرات برحسب cm/s در واحد میدان الکتریکی برحسب Volt/cm که با μ نشان داده میشود و برحسب cm2/V.s بیان میگردد:
حرکت الکتروفورزی : μ
بار الکتریکی خالص یون : Q

شعاع یون : r
ویسکوزیته محیط(بافر) : η
بطورکلی نیروهای تاثیر گذارنده بر حرکت الکتروفورزی را میتوان به دو گروه تقسیم نمود:
نیروی رانشی یا جلوبرنده (Driving force) : که مرتبط با میدان الکتریکی یون مربوطه میباشد.
نیروی بازدارنده (Retarding force) : که مربوط به مقاومت محیط نگهدارنده میباشد.
با توجه به معادله بالا مشخص میگردد که حرکت الکتروفورزی ارتباط مستقیم با بار خالص یون(Q) و ارتباط معکوس با اندازه ملکول (r) و ویسکوزیته محیط الکتروفورزی (η) دارد. هنگامی که الکتروفورز در حال انجام میباشد به مرور دمای محیط پایه و بافرها افزایش مییابد که منجر به تبخیر حلال میگردد, این اثر (خشک کنندگی) سبب صعود بافر از هردو بخش بافری(درون دو تانک بافری) به درون محیط پایه میگردد, این جریان دوطرفه بر حرکت یونها تاثیر میگذارد (Wick flow).
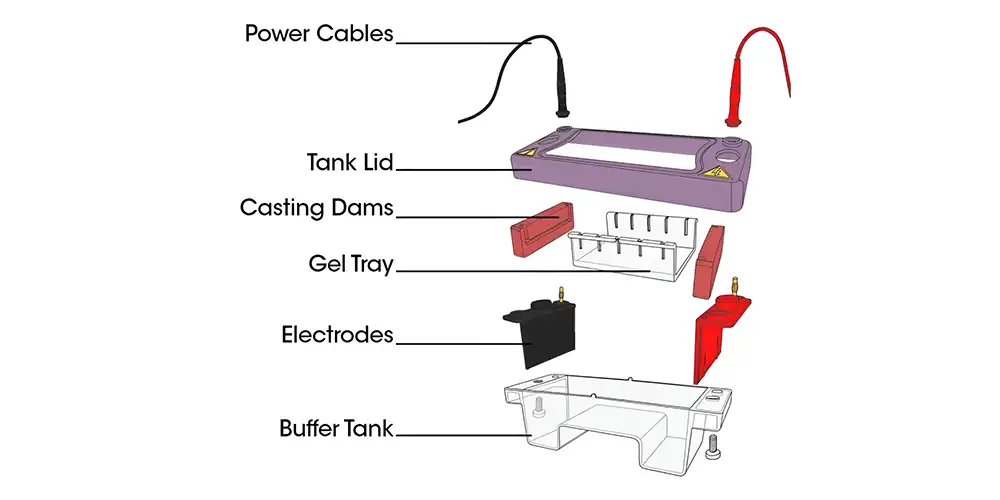
وسایل و مواد مورد نیاز:
🧪 مواد مورد نیاز:
-
پودر آگارز (Agarose powder):
برای تهیه ماتریس ژل که DNA در آن حرکت میکند. -
بافر الکتروفورز (Electrophoresis buffer):
مانند TAE (Tris-Acetate-EDTA) یا TBE (Tris-Borate-EDTA) برای هدایت جریان الکتریکی و حفظ pH. -
نمونه DNA:
نمونههایی که قرار است جداسازی شوند. -
DNA مارکر / DNA Ladder:
قطعات DNA با اندازههای مشخص برای مقایسه و تخمین اندازه نمونهها. -
رنگ بارگذاری (Loading dye):
برای افزایش چگالی نمونه و مشاهده حرکت DNA در طول الکتروفورز. -
رنگ فلورسنت برای آشکارسازی DNA:
مانند اتیدیوم بروماید (EtBr)، SYBR Safe یا GelRed.-
EtBr به DNA متصل میشود و در نور UV میدرخشد.
-
🧰 وسایل مورد نیاز:
-
مخزن الکتروفورز (Electrophoresis tank):
مخزنی برای نگهداری ژل و بافر و اعمال جریان الکتریکی. -
منبع تغذیه الکتریکی (Power supply):
برای اعمال ولتاژ مشخص بین الکترودها. -
سینی ریختن ژل (Casting tray):
برای ریختن و شکلگیری ژل. -
شانه یا شانه ژل (Comb):
برای ایجاد چاهکها (wells) در ژل که نمونهها در آنها قرار میگیرند. -
پمپ حرارتی یا مایکروویو:
برای حل کردن پودر آگارز در بافر. -
سمپلر (Micropipette) و نوک (Tips):
برای انتقال دقیق حجم کمی از مایع مانند DNA و رنگ. -
دستکش و عینک ایمنی:
برای محافظت هنگام کار با مواد شیمیایی مانند EtBr. -
ترانسایلومیناتور UV یا دستگاه تصویربرداری ژل (Gel Documentation System):
برای مشاهده و ثبت تصویر نوارهای DNA پس از رنگآمیزی و جداسازی.
انواع ژل برای الکتروفورز و تفاوت انها
در الکتروفورز، بسته به نوع مولکولی که قرار است جداسازی شود (DNA، RNA یا پروتئین)، از انواع مختلف ژل استفاده میشود. دو نوع اصلی ژل که بیشتر در آزمایشگاههای زیستمولکولی کاربرد دارند عبارتاند از:
ژل آگارز (Agarose)
آگارز یک پلیساکارید طبیعی و خنثی است که از دیواره سلولی برخی جلبکهای قرمز (نظیر Gelidium و Gracilaria) استخراج میشود. این پلیمر، جزء اصلی تشکیلدهنده آگار میباشد، اما در واقع آگارز، بخشی از آگار است که با حذف ترکیبات باردار از جمله آگاروپکتینها و گروههای سولفاته، خالصسازی شده است. بنابراین میتوان گفت آگارز شکلی تصفیهشده و بدون گروههای سولفاته آگار است.
حذف این ناخالصیها باعث میشود تا ژل حاصل از آگارز دارای زمینهای الکتریکی خنثی، شفافتر و یکنواختتر باشد. این ویژگیها باعث میشوند آگارز نسبت به آگار یا ترکیبات خامتر آن، گزینهای ایدهآل برای کاربردهای الکتروفورزی، بهویژه جداسازی اسیدهای نوکلئیک (DNA و RNA)، باشد.
یکی از مهمترین مزایای ژل آگارز، توانایی کنترل اندازه حفرههای شبکه ژلی است که از طریق تغییر غلظت آگارز در محلول بافر حاصل میشود. به طور معمول، غلظتهایی بین 0.5 تا 1 گرم در دسیلیتر (g/dL) مورد استفاده قرار میگیرند که برای جداسازی قطعات DNA در بازه اندازه 500 جفت باز (bp) تا حدود 20,000 جفت باز مناسب است.
با افزایش غلظت آگارز، اندازه منافذ ژل کاهش یافته و برای جداسازی قطعات کوچکتر DNA مناسب میگردد. در مقابل، کاهش غلظت باعث ایجاد منافذ بزرگتر برای جداسازی قطعات بزرگتر میشود.
در الکتروفورز با ژل آگارز، باندهای مشاهدهشده بر روی ژل معمولاً پهنتر از سایر محیطها مانند استات سلولز هستند. علت آن نفوذپذیری بالاتر ژل و همچنین عدم وجود الکترواندازهگیری دقیقتر مانند آنچه در ژل پلیآکریلامید صورت میگیرد، است. لازم به ذکر است که ژل آگارز عمدتاً در جداسازی اسیدهای نوکلئیک استفاده میشود و برای پروتئینها، به دلیل اندازه کوچکتر آنها، مناسب نیست مگر در حالت خاص مانند آگارز-ایمبدینگ الکتروفورز.

کاغذ استات سلولز (Cellulose Acetate)
استات سلولز یک بستر الکتروفورزی نازک و انعطافپذیر است که بهویژه برای جداسازی ترکیبات با وزن مولکولی پایینتر و کاربردهایی نظیر آنالیز پروتئینهای سرم، لیپوپروتئینها و هموگلوبینها استفاده میشود.
استات سلولز با استیله کردن کاغذ سلولز در حضور انیدرید استیک تولید میشود. در این واکنش، گروههای هیدروکسیل موجود بر روی حلقههای قندی سلولز با گروههای استیل جایگزین میشوند و در نتیجه خواص مکانیکی و شیمیایی بستر تغییر میکند.
مزیت اصلی کاغذ استات سلولز، نازکی آن است که موجب بهبود انتقال گرما، وضوح بالای لکهها (spots) و حساسیت بالا در تشخیص میگردد. از طرفی، چون مقدار کمی نمونه برای آشکارسازی لازم است، این بستر برای آزمایشهای بالینی بسیار مفید است.
این محیط برخلاف ژلهای سهبعدی مانند آگارز یا پلیآکریلامید، به صورت دوبعدی عمل میکند و قدرت تفکیک آن در برخی موارد کمتر است، اما در آنالیز سریع و ساده گزینهای مناسب و اقتصادی است.

ژل پلیآکریلامید (Polyacrylamide Gel)
ژل پلیآکریلامید یکی از دقیقترین و پرکاربردترین محیطهای جداسازی پروتئینها و قطعات DNA با دقت بالا است. این ژل از پلیمریزاسیون مونومر آکریلامید در حضور ماده کراسلینککننده (معمولاً N,N'-Methylenebisacrylamide) ساخته میشود که باعث تشکیل شبکهای سهبعدی و پایدار میگردد.
این واکنش پلیمریزاسیون از نوع رادیکالی است و با استفاده از یک آغازگر مانند APS (آمونیوم پرسولفات) و یک کاتالیزور مانند TEMED انجام میشود. واکنش ممکن است با حرارت یا نور نیز آغاز گردد.
ژلهای پلیآکریلامید میتوانند به صورت ناخطی (non-denaturing) یا دناتوره (denaturing) تهیه شوند. در حالت دناتوره، مانند SDS-PAGE، پروتئینها براساس اندازه (وزن مولکولی) جداسازی میشوند، زیرا ساختار سوم آنها توسط SDS (سدیم دودسیل سولفات) از بین میرود و همه پروتئینها بار منفی یکسان پیدا میکنند.
از مزایای مهم ژل پلیآکریلامید میتوان به موارد زیر اشاره کرد:
-
شفافیت بالا برای تصویربرداری دقیق
-
منافذ قابل کنترل با تنظیم غلظت مونومر و کراسلینککننده
-
استحکام مکانیکی مناسب
-
عدم تداخل بار الکتریکی در ماتریس ژل (بر خلاف آگارز یا آگار)
البته باید توجه داشت که آکریلامید مونومر سمی و سرطانزا (کارسینوژنیک) است، بنابراین هنگام کار با آن باید از تماس مستقیم با پوست و استنشاق بخارها جلوگیری کرد.
غلظت معمول ژلهای پلیآکریلامید برای جداسازی پروتئینها در محدوده 6% تا 15% متغیر است. ژلهای با درصد پایین برای پروتئینهای بزرگ و درصد بالا برای پروتئینهای کوچکتر مناسب هستند.
بافر ژل الکتروفورز
در تکنیک الکتروفورز ژل، انتخاب بافر نقشی حیاتی در کیفیت جداسازی مولکولها و پایداری فرآیند دارد. یک بافر ایدهآل باید ویژگیهایی مانند هدایت الکتریکی مطلوب، تولید حداقل گرما، و حفظ pH ثابت در طول الکتروفورز داشته باشد. در زمینه جداسازی اسیدهای نوکلئیک (DNA و RNA) در ژل آگارز، بافرهای پرکاربرد شامل تریس/استات/EDTA (TAE) و تریس/بورات/EDTA (TBE) هستند.
ویژگیهای کلیدی بافرهای رایج:
-
TAE (Tris-Acetate-EDTA):
-
وضوح بالا بهویژه برای قطعات DNA بزرگتر از 10 kb.
-
ظرفیت بافری پایینتر نسبت به TBE، در نتیجه تمایل بیشتری به تغییر pH در زمان طولانی دارد.
-
جریان الکتریکی بالاتر، گرمای بیشتر، اما مناسب برای استخراج باند و مراحل بعدی مانند کلونینگ یا PCR.
-
-
TBE (Tris-Borate-EDTA):
-
ظرفیت بافری بالاتر و در نتیجه ثبات بیشتر pH در طول فرآیند.
-
مناسب برای جداسازی DNA با اندازههای کوچکتر (کمتر از 1 kb) با دقت بالا.
-
ممکن است با RNA تداخل ایجاد کند، چون یون بورات میتواند با دیولهای سیس موجود در RNA واکنش دهد.
-
-
بافر لیتیوم بورات (Lithium Borate - LB):
-
هدایت الکتریکی پایین، مناسب برای اعمال ولتاژهای بالا (تا 35 ولت بر سانتیمتر).
-
گرمای کمتری تولید میکند و مدت زمان اجرای الکتروفورز را کاهش میدهد.
-
برای قطعات DNA بزرگتر از 5 kb مناسب نیست.
-
-
بافر Tris-Phosphate:
-
ظرفیت بافری بسیار بالا.
-
استفاده از آن در واکنشهایی که به فسفات حساساند (مانند آنزیمهای محدودکننده خاص) توصیه نمیشود.
-
-
بافرهای خاص مانند Tris-Barbiturate و Sodium Barbiturate:
-
بیشتر در الکتروفورز پروتئینها استفاده میشوند.
-
در مطالعات بیماریهای مرتبط با اختلال در توزیع ایزوفورمهای پروتئینی (مانند گاماگلوبولینها) کاربرد دارند.
-
رنگآمیزی ژل الکتروفورز
رنگهای رایج برای DNA/RNA:
-
اتیدیوم بروماید (EtBr):
-
رایجترین ماده فلورسانس برای DNA است.
-
به داخل شیارهای بزرگ DNA بین پایگاهها قرار میگیرد و هنگام تابش اشعه UV نور فلورسانس نارنجی ساطع میکند.
-
جهشزا است و هنگام کار با آن باید از دستکش، عینک و تهویه مناسب استفاده کرد.
-
قابل استفاده هم در هنگام ریختن ژل و هم برای رنگآمیزی بعد از اتمام الکتروفورز.
-
-
SYBR Green و GelGreen:
-
حساسیت بالا، گزینهای ایمنتر نسبت به EtBr.
-
نیازمند منبع نور آبی برای تحریک هستند.
-
SYBR Green برای Real-Time PCR نیز استفاده میشود.
-
-
GelRed و GelGreen:
-
مولکولهای دو ظرفیتی که قابلیت عبور از غشای سلولی را ندارند و در نتیجه ایمنتر در نظر گرفته میشوند.
-
مناسب برای مطالعات آموزشی.
-
-
Crystal Violet و Methylene Blue:
-
امکان مشاهده DNA بدون نیاز به UV.
-
حساسیت پایینتر نسبت به رنگهای فلورسنت اما مناسب برای کاربردهای سریع و غیرحساس.
-
اثرات UV بر DNA:
طول موجهای رایج برای تحریک فلورسانس EtBr در محدوده 302 تا 312 نانومتر (UV-B) هستند. این طول موجها میتوانند آسیبهای شدیدی به DNA وارد کنند، از جمله شکستن زنجیره یا آسیب به نوکلئوتیدها که بر عملکرد واکنشهای بعدی مانند PCR، کلونینگ یا رونویسی in vitro تأثیر میگذارد. استفاده از فیلترهای UV-A (365 نانومتر) آسیب کمتری وارد میکند اما سیگنال فلورسانس ضعیفتری دارد.
توصیه عملی:
-
برای تصویربرداری سریع: استفاده از UV-B (302 نانومتر).
-
برای کار با باند در مدت طولانی (مانند برش ژل): استفاده از UV-A یا نور آبی.
دستگاههای تصویربرداری ژل
Gel Documentation Systems (ژلداک):
سیستمهای مستندسازی ژل یا ژلداک دستگاههایی هستند که برای ثبت، آنالیز و ذخیرهسازی تصاویر ژلهای رنگآمیزی شده طراحی شدهاند.
اجزای اصلی ژلداک:
-
منبع نور UV یا نور آبی (Blue LED): برای تحریک رنگ فلورسنت.
-
دوربین دیجیتال (معمولاً CMOS یا CCD): ثبت تصویر ژل.
-
کاپوت تاریک: محافظت در برابر نور محیط و اشعه UV.
-
نرمافزار کنترل و آنالیز: برای اندازهگیری شدت باندها و تعیین غلظت تقریبی DNA/RNA.
برندهای معتبر:
-
Bio-Rad
-
Azure Biosystems
-
Syngene
-
Vilber Lourmat
-
UVItec
-
Cleaver Scientific
برخی مدلها دارای دوربینهای خنکشونده با قابلیت تصویربرداری با حساسیت بالا در نور کم هستند و به امکاناتی مانند اتصال WiFi و چاپ مستقیم نیز مجهز میباشند.

ترانسلومیناتور (Transilluminator)
ترانسلومیناتور دستگاهی است با پنجره نور UV که برای مشاهده باندهای DNA یا RNA رنگشده به کار میرود. برخلاف ژلداک، این دستگاه برای تصویربرداری طراحی نشده بلکه برای مشاهده سریع و معمولاً برش دقیق باند مورد نظر جهت تخلیص DNA استفاده میشود.
نکات ایمنی هنگام استفاده:
-
حتماً از عینک UV، ماسک و دستکش استفاده شود.
-
تماس طولانی با نور UV حتی از نوع A نیز برای پوست و چشم مضر است.

نکته مهم در استفاده از ژل برای استخراج DNA
برای کاربردهایی مانند استخراج DNA برای توالییابی یا کلونینگ، بهتر است از ژل آگارز با نقطه ذوب پایین (Low Melting Point Agarose) استفاده شود. این نوع ژل به دلیل عدم نیاز به دمای بالا برای ذوب، آسیبی به ساختار DNA نمیزند و واکنشهای آنزیمی حساس مانند لیگاسیون یا PCR را مختل نمیکند.