ژنومیکس چیست
۱. مقدمهای بر ژنومیکس
1.1. تعریف و دامنه
1.2. تاریخچه توسعه (از مندل تا اُمیکسهای امروز)
1.3. چرا ژنومیکس اهمیت دارد – کاربردها در سلامت، بیوتکنولوژی، تکامل
۲. پایههای مولکولی
2.1. DNA، ژنها، کروموزومها، ژنوم
2.2. ساختار ژنوم در پروکاریوتها و یوکاریوتها
2.3. DNA غیرکدکننده، عناصر تکراری، اصلاحات اپیژنتیکی
۳. فناوریهای توالییابی ژنوم
3.1. نسل اول: توالییابی سانگر
3.2. نسل دوم (NGS): Illumina، Ion Torrent و دیگر فناوریها
3.3. نسل سوم/خوانش بلند: PacBio، Oxford Nanopore
3.4. فناوریهای نوین: تکسلولی، خوانشهای پیوندی، Hi‑C
۴. مونتاژ و حاشیهنویسی ژنومی
4.1. همترازی خوانشها و روشهای مونتاژ ژنوم (de novo و مرجعمحور)
4.2. پایپلاینهای حاشیهنویسی (مدلهای ژنی، تکرارها، RNAهای غیرکدکننده)
4.3. ارزیابی کیفیت و استانداردها
۵. ژنومیکس مقایسهای
5.1. تطبیق ژنوم و سینتنی
5.2. پانژنومها و ژنومهای هستهای
5.3. تکامل خانوادههای ژنی، تحلیل ارتولوژی و پارالوژی
۶. ژنومیکس عملکردی
6.1. ترنسکریپتومیکس (RNA-seq، تکسلولی)
6.2. اپیژنومیکس، تعاملات کروماتین، عناصر تنظیمی
6.3. پروتئومیکس، متابولومیکس، شبکههای تنظیمی ژنی
۷. ژنومیکس جمعیتی و تنوع ژنتیکی
7.1. شناسایی SNP و تغییرات ساختاری
7.2. ساختار جمعیتی، مطالعات GWAS، استنباط جمعیتی
7.3. بررسی انتخاب طبیعی و سازگاری
۸. ژنومیکس پزشکی و بالینی
8.1. ژنومیکس سرطان و تکامل سوماتیکی
8.2. بیماریهای نادر، توالییابی تشخیصی
8.3. فارماکوژنومیکس و پزشکی شخصی
8.4. ژنومیکس میکروبیوم
۹. ژنومیکس میکروبی و ویروسی
9.1. آنالیز ژنوم باکتریها و آرکیها
9.2. تکامل ویروسی، متاژنومیکس، ردیابی شیوع
۱۰. ابعاد اخلاقی، حقوقی و اجتماعی (ELSI)
10.1. حریم خصوصی، رضایت، بهاشتراکگذاری داده
10.2. استفاده بالینی و قوانین مربوط به داده ژنومی
10.3. عدالت، تبعیض و دسترسی
۱۱. ابزارهای محاسباتی و بیوانفورماتیک
11.1. پایپلاینهای تحلیلی و ابزارهای استاندارد
11.2. رایانش ابری، سیستمهای کاری، استاندارد دادهها
11.3. پایگاههای داده و ابزارهای تصویری (ENSEMBL، UCSC، IGV)
۱۲. مرزهای نوین در ژنومیکس
12.1. خوانش بلند، ژنومیکس تکسلولی و فضایی
12.2. ژنومسازی مصنوعی، ویرایش ژنوم (CRISPR)
12.3. ادغام چند-اُمیکس و ژنومیکس سیستمی
۱۳. کاربردها در زیستشناسی و بیوتکنولوژی
13.1. ژنومیکس کشاورزی، حفاظت زیستی
13.2. بیوتکنولوژی صنعتی، زیستشناسی مصنوعی
13.3. زیستشناسی تکاملی و فیلوژنی مقایسهای
۱۴. مطالعات موردی و ژنومهای مرجع
14.1. پروژه ژنوم انسان، ژنومهای گیاهی و مدلهای آزمایشگاهی
14.2. کمپینهای توالییابی کووید-۱۹، پروژههای ژنوم سرطان
۱۵. محدودیتها، چالشها و بهترین روشها
15.1. کیفیت داده، اثرات دستهای، چالش در تفسیر واریانتها
15.2. بازتولیدپذیری، دقت آماری، اخلاق علمی
۱۶. چشمانداز آینده و چالشهای پیشرو
16.1. مقیاسپذیری، توالییابی جمعیتی، هوش مصنوعی در ژنومیکس
16.2. سلامت جهانی، پایداری، مسئولیت اخلاقی در استفاده از داده ژنومی
بخش ۱: مقدمهای بر ژنومیکس
ژنومیکس چیست؟
ژنومیکس مطالعهی جامع کل ژنوم یک موجود زنده است. برخلاف ژنتیک که اغلب بر روی ژنهای منفرد و نقش آنها در وراثت و عملکرد تمرکز دارد، ژنومیکس ساختار، عملکرد، تکامل، نقشهبرداری و ویرایش تمام مواد ژنتیکی موجودات زنده را بررسی میکند. هدف آن این است که درک کند چگونه همهی ژنهای یک ارگانیسم با یکدیگر و با محیط تعامل میکنند و بر ویژگیها، رفتارها و میزان آسیبپذیری نسبت به بیماریها اثر میگذارند.
ژنوم مجموعهی کامل DNA است که شامل تمام ژنها و توالیهای غیرکدکننده میباشد. ژنومیکس این نقشهی زیستی را در سطح سامانهای بررسی میکند تا روابط بین ژنها را کشف کند، جهشها را شناسایی کند، الگوهای بیان ژن را تحلیل کند و تصویری جامع از زیستشناسی ایجاد نماید.
چرا ژنومیکس مهم است؟
رشد سریع ژنومیکس در چند دههی گذشته انقلابی در زیستشناسی و پزشکی ایجاد کرده است. تأثیر آن گسترده و ژرف است:
-
پزشکی شخصیسازیشده: ژنومیکس امکان درمانهای متناسب با ویژگیهای ژنتیکی هر فرد را فراهم کرده است.
-
ژنومیکس کشاورزی: بهبود گونههای زراعی و مقاومت در برابر بیماریها.
-
کنترل بیماریهای عفونی: ردیابی لحظهای پاتوژنها مانند SARS-CoV-2.
-
درک تکامل: ژنومیکس تطبیقی به شناسایی روابط تکاملی بین گونهها کمک میکند.
-
زیستفناوری و زیستشناسی ساختاری: مهندسی ژنوم منجر به درمانهای نوآورانه و محصولات زیستی جدید شده است.
دامنه ژنومیکس
ژنومیکس شامل زیرشاخههای مختلفی است که هرکدام به درک عمیقتر حیات کمک میکنند:
-
ژنومیکس ساختاری: تمرکز بر ساختار ژنوم شامل توالییابی، مونتاژ و نقشهبرداری.
-
ژنومیکس عملکردی: بررسی عملکرد ژنها و تعامل آنها با استفاده از ابزارهایی مانند ترنسکریپتومیکس و پروتئومیکس.
-
ژنومیکس تطبیقی: مقایسه شباهتها و تفاوتها در بین گونهها برای دنبال کردن مسیرهای تکاملی.
-
اپیژنومیکس: بررسی تغییرات شیمیایی DNA و هیستونها که بر بیان ژن تأثیر میگذارند.
-
متاژنومیکس: مطالعه مواد ژنتیکی از نمونههای محیطی برای آشکارسازی تنوع میکروبی.
-
فارماکوژنومیکس: بررسی تأثیر تفاوتهای ژنتیکی بر پاسخ به داروها.
تاریخچهای مختصر از ژنومیکس
داستان ژنومیکس با کشف ساختار DNA در سال ۱۹۵۳ آغاز شد. نقاط عطف کلیدی شامل:
-
۱۹۵۳ – واتسون و کریک ساختار مارپیچ دوتایی DNA را توصیف کردند.
-
۱۹۷۷ – توسعه روش توالییابی سنگر (Sanger sequencing)، که امکان توالییابی ژنومهای کوچک را فراهم کرد.
-
۱۹۹۰ تا ۲۰۰۳ – پروژه ژنوم انسان، اولین ژنوم انسانی کامل را توالییابی کرد.
-
۲۰۰۵ به بعد – نسل جدید توالییابی (NGS) باعث انقلابی در تحلیلهای ژنومی شد؛ سریعتر و ارزانتر.
-
۲۰۱۲ – بهرهبرداری از سیستم ویرایش ژنوم CRISPR-Cas9.
-
دهه ۲۰۲۰ – پیشرفت در ژنومیکس تکسلولی، ترنسکریپتومیکس فضایی و ژنومیکس مبتنی بر هوش مصنوعی.
تفاوت ژنومیکس و ژنتیک
اگرچه این دو واژه گاهی به جای هم به کار میروند، اما ژنومیکس و ژنتیک رشتههایی متمایز هستند:
|
جنبه |
ژنتیک |
ژنومیکس |
|---|---|---|
|
تمرکز |
ژنهای منفرد |
کل ژنوم |
|
رویکرد |
تحلیل تکژنی |
تحلیل سامانهای و با توان بالا |
|
روشها |
آنالیز مندلین، PCR |
توالییابی، بیوانفورماتیک |
|
کاربرد |
بیماریهای ارثی، صفات |
بیماریهای پیچیده، تنوع جمعیتی |
|
مقیاس |
محدود |
گسترده |
در اصل، ژنتیک علم وراثت است، در حالی که ژنومیکس علم مطالعه کل ژنوم در بستر زیستی است.
مفاهیم کلیدی در ژنومیکس
برای درک ژنومیکس، باید با مفاهیم پایهای آن آشنا شد:
-
ژنوم
مجموعهای از تمام DNA یک ارگانیسم است – شامل توالیهای کدکننده (ژنها) و غیرکدکننده. در انسان، شامل حدود ۳.۲ میلیارد جفت باز است. -
ژنها و DNA غیرکدکننده
فقط حدود ۱.۵٪ از ژنوم انسان برای ساخت پروتئینها کد میکند. بقیه شامل:-
عناصر تنظیمی
-
اینترونها
-
توالیهای تکراری
-
RNAهای غیرکدکننده
که همه در تنظیم ژن و ساختار کروماتین نقش دارند.
-
-
تنوع ژنومی
هیچ دو ژنومی دقیقاً یکسان نیستند. انواع تنوع ژنتیکی شامل:-
SNPs (تکنوکلئوتید پلیمورفیسمها)
-
Indels (درج و حذفها)
-
CNVs (تغییرات در تعداد نسخه ژن)
-
جهشهای ساختاری و وارونگیها
این تنوعها پایههای تفاوتهای فنوتیپی و حساسیت به بیماریها را تشکیل میدهند.
-
-
بیان ژن و تنظیم آن
فعالیت ژنها پویا است. ژنومیکس بررسی میکند:-
کدام ژنها رونویسی میشوند
-
چه زمانی و در کدام بافتها فعالاند
-
چگونه بیان آنها با اپیژنتیک و فاکتورهای رونویسی تنظیم میشود
-
-
اپیژنومیکس
تغییرات شیمیایی مانند متیلاسیون DNA و استیلاسیون هیستونها که بدون تغییر توالی DNA، بر فعالیت ژن اثر میگذارند.
پروژهها و پایگاههای داده مهم ژنومیکس
چندین پروژه برجسته و پایگاه داده باز، پیشرفتهای بزرگی در ژنومیکس رقم زدهاند:
-
پروژه ژنوم انسان (HGP)
در سال ۲۰۰۳ تکمیل شد و اولین ژنوم مرجع انسانی را ارائه داد. این پروژه رشد ژنومیکس شخصی، تحقیقات زیستپزشکی و بیوانفورماتیک را تسریع کرد. -
پروژه 1000 ژنوم
تنوع ژنتیکی بیش از ۱۰۰۰ نفر را بررسی کرد تا درک بهتری از تنوع انسانی و تکامل حاصل شود. -
اطلس ژنوم سرطان (TCGA)
پایههای مولکولی بیش از ۳۰ نوع سرطان را با استفاده از دادههای ژنومیکس، ترنسکریپتومیکس و اپیژنومیکس شناسایی کرد. -
پروژه ENCODE
دایرةالمعارف عناصر DNA عملکردی است که نشان داد بخش زیادی از DNA غیرکدکننده نقشهای تنظیمی دارد. -
پروژه GTEx
بررسی میکند چگونه تفاوتهای ژنتیکی بر بیان ژن در بافتهای مختلف انسانی اثر میگذارند.
ابزارها و فناوریهای ژنومیکس
ژنومیکس با مجموعهای از ابزارهای آزمایشگاهی و محاسباتی قدرتمند انجام میشود:
توالییابی
-
توالییابی سنگر – استاندارد طلایی برای توالییابیهای کوچک.
-
NGS (مثل Illumina) – توالییابی با توان بالا و خوانشهای کوتاه.
-
نسل سوم (مثل Oxford Nanopore، PacBio) – خوانشهای بلند و توالییابی بلادرنگ.
مونتاژ و تفسیر ژنوم
دادههای خام باید مونتاژ شوند و با استفاده از روشهای بیوانفورماتیکی ژنها، اگزونها و عناصر تنظیمی شناسایی شوند.
بیوانفورماتیک
پردازش دادههای عظیم ژنومی با الگوریتمهایی مانند:
-
همترازی (مثل BWA، Bowtie)
-
تشخیص جهش (مثل GATK)
-
بیان ژن (مثل STAR، HISAT2)
-
تصویرسازی (مثل IGV، UCSC Genome Browser)
ژنومیکس در زندگی روزمره
ژنومیکس بسیاری از جنبههای زندگی و سلامت ما را متحول کرده است:
-
آزمایشهای ژنتیکی برای مصرفکننده: مانند 23andMe که بینشهایی دربارهی اجداد و سلامت از طریق ژنوم شما ارائه میدهد.
-
درمان شخصی سرطان: انتخاب داروها بر اساس ژنوم تومور.
-
کنترل بیماریهای عفونی: توالییابی ژنومی بلادرنگ ویروسها و باکتریها برای مدیریت شیوع بیماری.
-
نوآوری کشاورزی: کمک به تولید محصولات مقاوم در برابر بیماری، خشکسالی و آفات.
آینده ژنومیکس
ما در آستانهی عصر جدیدی از ژنومیکس دقیق (Precision Genomics) هستیم که با ادغام ژنومیکس با هوش مصنوعی، زیستشناسی سامانهای و دادههای چنداُمیکی (multi-omics) همراه است و خواهد توانست:
-
پیشبینی دقیقتر بیماریها
-
تشخیص زودهنگامتر
-
پیشگیری و درمان شخصیسازیشده
-
پایداری زیستمحیطی و کشاورزی
چالشهای باقیمانده:
-
تفسیر مناطق وسیع غیرکدکننده در ژنوم
-
حفظ حریم خصوصی دادهها
-
کاهش نابرابری در دسترسی به ژنومیکس
جمعبندی: انقلاب ژنومی
ژنومیکس تنها یک رشته علمی نیست، بلکه یک انقلاب فناورانه و اجتماعی است. این علم نحوه درک ما از خود، سلامتمان و جایگاهمان در طبیعت را تغییر داده است. با ارزانتر و سریعتر شدن توالییابی، تحقق وعدههای ژنومیکس – از درمان بیماریها تا تأمین غذای جمعیت در حال رشد – بیش از هر زمان دیگری در دسترس قرار گرفته است.
در مسیر ادامهی کشف نقشهی زندگی، ژنومیکس نقش محوری در رمزگشایی از اسرار زیستشناسی و ایجاد نوآوری در تمام حوزههای علم و پزشکی ایفا خواهد کرد.
بخش ۲: بنیانهای مولکولی ژنومیکس
درک نقشهی مولکولیِ حیات
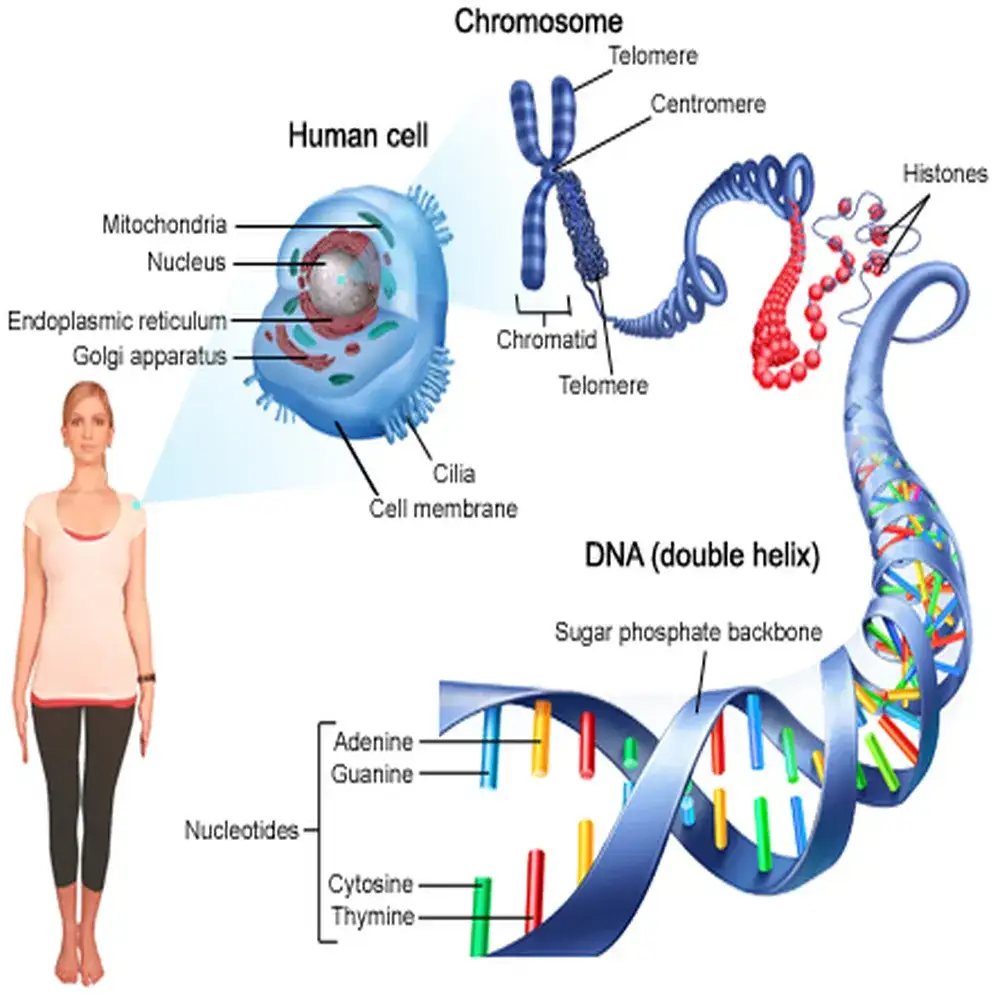
در هستهی علم ژنومیکس، یک معماری مولکولی پیچیده و دقیق نهفته است که هویت، رشد، فیزیولوژی و رفتار هر موجود زنده را تعیین میکند. برای درک عمیق این علم، باید از مولکولهای بنیادی تشکیلدهنده ژنوم شروع کنیم. مهمترین آنها DNA یا اسید دئوکسیریبونوکلئیک است؛ مادهای وراثتی که خودِ زندگی را رمزگذاری میکند. ژنوم به طور مشخص، به کل DNA یک موجود زنده اشاره دارد؛ شامل ژنها و بخشهای غیرکدکننده که حتی اگر بنا بر تاریخ سادهانگارانه فراموش شده باشند، امروزه شناخته شدهاند که نقشهای اساسی در تنظیم فعالیت ژنها و ساختار کروماتین دارند.
DNA: حامل اطلاعات ژنتیکی
DNA یک پلیمر دوتارِ طولانی است که شامل تعداد زیادی واحد تکرارشونده به نام نوکلئوتید میباشد. هر نوکلئوتید شامل این سه بخش است:
-
یک گروه فسفات
-
یک قند پنجکربنی به نام دئوکسیریبوز
-
یکی از چهار باز نیتروژنی: آدنین (A)، تیمین (T)، گوانین (G)، یا سیتوزین (C)
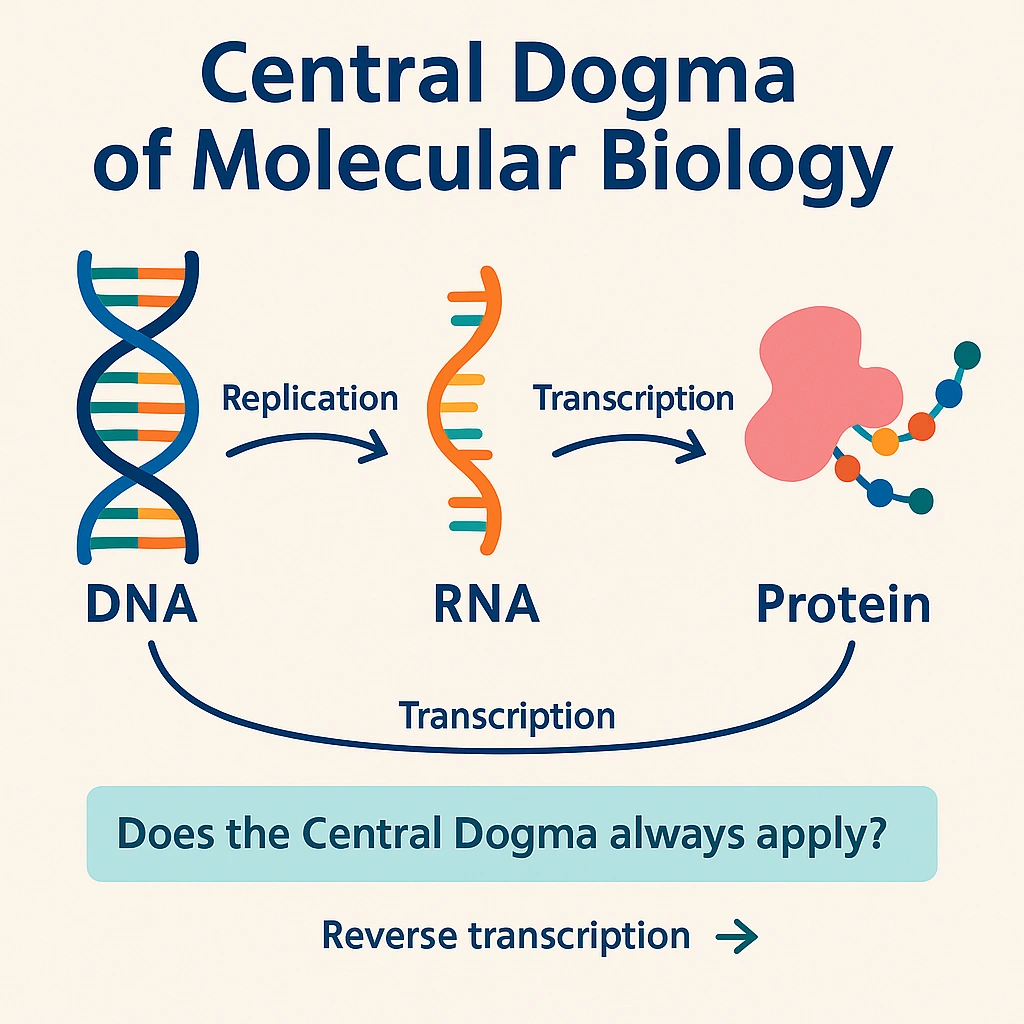
این نوکلئوتیدها در یک توالی خطی کنار هم قرار گرفته و خود DNA در ساختار مارپیچ دوتایی قرار دارد، ساختاری که در سال ۱۹۵۳ توسط واتسون و کریک توصیف شد. ترتیب این بازها (توالی نوکلئوتیدی)، کد اصلی دستورات ژنتیکی را در خود جای داده است. دو رشتهی مکمل DNA با پیوندهای هیدروژنی بین بازهای A-T و G-C به هم متصلاند که امکان تکثیر دقیق و تعمیر DNA در تقسیم سلولی را فراهم میکند و نیز پایهای برای رونویسی (Transcription) و ترجمه (Translation) است که الگوی بیان ژن را کنترل میکنند.
ژنها: واحدهای عملکردی ژنوم
به صورت سنتی، ژن به بخشی از DNA گفته میشود که پروتئین یا RNA کاربردی را کُد میکند. با این حال، ژنومیکس نوین نشان داده که ژنهایی نیز وجود دارند که RNAهای غیرکدکننده تولید میکنند؛ مانند microRNA، lncRNA و rRNA که نقشهای تنظیمی و ساختاری مهمی در سلول ایفا میکنند.
ژن معمولاً شامل عناصر متعددی است:
-
اگزونها (بخش کدکننده)
-
اینترونها (بخش غیرکدکننده بین اگزونها)
-
پروموتر، انهانسر، نواحی UTR (۵′ و ۳′) و دیگر عناصر تنظیمی سیس که رونویسی ژنی را کنترل میکنند.
ژنوم انسان تقریباً شامل ۲۰–۲۵ هزار ژن کدکننده پروتئین است. این تعداد اغلب از دید بسیاری از دانشمندان چندان زیاد به نظر نمیرسید؛ اما بعدها مشخص شد فرآیندهایی مانند اسپلایسینگ جایگزین (Alternative Splicing)، تنظیم پساترنسکریپشن و عناصر تنظیمی گسترده، نقش کلیدی در افزایش تنوع عملکردی از ژنوم محدود دارند؛ پدیدهای که آن را «معمای تعداد ژن» خواندهاند.
کروموزومها: ساختارهای سازمانیافته ژنوم
در سلولهای یوکاریوتی، DNA مستقل و آزاد نیست؛ بلکه به پروتئینهایی بنام هیستون متصل شده و ساختارهای خطی به نام کروموزوم را ایجاد میکند. این ترکیب DNA–هیستون را کروماتین مینامند که به فشرده شدن مترها DNA در فضای چند میکرومتری کمک میکند.
نوع کروماتین نیز متفاوت است:
-
یوکروماتین: باز و فعال در رونویسی
-
هتروکروماتین: متراکم و عموماً خاموش
این وضعیت بسته یا باز کروماتین به واسطه تغییرات شیمیایی هیستونها مانند متیلاسیون و استیلاسیون تنظیم میشود که منشاء اصول اپیژنتیک هستند. انسان دارای ۴۶ کروموزوم است (۲۳ جفت)، شامل ۲۲ جفت اتوزوم و یک جفت کروموزوم جنسی (XX یا XY). هر کروموزوم هزاران ژن را دربردارد و همچنین بخشهای گستردهای از DNA غیرکدکننده که به رغم عدم تولید پروتئین، در تنظیم ژن، پایداری کروموزومی و تکامل نقش دارند.
معماری ژنوم: فراتر از توالی خطی
ژنومیکس نه تنها به خواندن توالی DNA میپردازد، بلکه به ساختار سهبعدی آن در هسته سلول نیز توجه دارد؛ حوزهای که با عنوان ژنومیکس فضایی (spatial genomics) شناخته میشود. تکنیکهایی مانند Hi-C، ChIA‑PET و DNA‑FISH نشان دادهاند که ساختار ژنوم در قالب دامنههایی موسوم به TADs، کمپارتمنتها و حلقههای کروماتینی سازمانیافته است.
Enhancerها که اغلب صدها کیلوبایت دور از ژن هدف هستند، به کمک ساختار حلقهای کروماتین به پروموترها نزدیک میشوند. این فرایند با دخالت پروتئینهایی مانند CTCF و کمپلکس Cohesin انجام میشود تا ژنی تنها در زمان، مکان و نوع سلول مناسب فعال شود.
عناصر تنظیمی و DNA غیرکدکننده
ایدهی قدیمی "DNA زائد" برای بخشهای غیرکدکننده کاملاً رد شده است. پروژههایی مانند ENCODE نشان دادهاند که بخش بزرگی از این قلمرو دارای فعالیت بیوشیمیایی از جمله رونویسی، تغییرات کروماتینی و اتصال فاکتورهای رونویسی هستند.
عناصر تنظیمی مهم عبارتند از:
-
پروموتر: شروع رونویسی
-
Enhancer / Silencer: تقویت یا سرکوب بیان ژن
-
Insulator: جلوگیری از تداخل میان ژنهای مجاور
-
Locus control regions: تنظیم همزمان خوشهای از ژنها
علاوه بر آن، RNAهای غیرکدکننده نقشهای حیاتی دارند:
-
miRNAها با اتصال به mRNA، پایداری و ترجمه آن را کنترل میکنند.
-
lncRNAها میتوانند پروتئینها را هدایت یا ساختار کروماتین را دستکاری کنند تا رونویسی را تحت تأثیر قرار دهند.
تکرارهای ژنومی و عناصر متحرک
ویژگی برجسته ژنومهای یوکاریوتی، بهویژه ژنوم انسان، وجود تعداد زیادی تکرار و عناصر متحرک ژنی است که بیش از ۵۰٪ ژنوم را تشکیل میدهند. این عناصر عبارتند از:
-
DNA ماهوارهای در سانترومرها و تلومرها
-
SINEها مانند Alu
-
LINEها مانند LINE‑1
-
ترانسپوزونهای DNA با ساختار "برش و چسباندن"
-
رتروترانسپوزونها که از طریق RNA تکثیر میشوند
اگرچه روزگاری این عناصر را انگل مینامیدند، اما امروزه مشخص شدهاند که میتوانند تنظیم ژن، انعطافپذیری ژنوم و تنوع ساختاری را تحت تأثیر قرار دهند. برخی ترانسپوزونها حتی برای استفاده میزبان تطبیق داده شدهاند تا نقشهای تنظیمی یا ساختاری ایفا کنند.
ژنوم میتوکندری و زنجیرههای اندامکی
علاوه بر ژنوم اصلی هستهای، سلولهای یوکاریوتی دارای ژنومهای جداگانه در میتوکندری و در گیاهان، در کلروپلاستها هستند. این ژنومها یادگار روابط همزیستیاند و حاوی ژنهایی برای عملکرد مخصوص آن اندامکها هستند؛ مانند تولید ATP در میتوکندری یا فتوسنتز در کلروپلاست.
ژنوم میتوکندری انسان:
-
دایرهای و تقریباً ۱۶۵۶۹ جفت باز
-
شامل ۳۷ ژن ضروری برای تنفس سلولی و تولید انرژی
-
بهصورت مادرزادی به ارث میرسد
-
کاربرد گسترده در مطالعات تکامل، جمعیتشناسی و ژنتیک قانونی دارد
نتیجهگیری: شبکه مولکولی ژنومیکس
بنیان مولکولی ژنومیکس از توالی DNA تا ساختار پیچیده کروماتین و تنظیم RNAهای غیرکدکننده شکل گرفته است؛ یک شبکه چندبعدی که زندگی را در اساسیترین سطح تنظیم میکند. هر جزء ساختار ژنومی هدفمند است، و بسیاری از آنها هنوز کاملاً شناخته نشدهاند. با پیشرفت به عصر چنداُمیکس و زیستشناسی دقیق (پرسیژن)، این دانش عمیق مولکولی کلید تحولات بنیادین در سلامت، کشاورزی، تکامل و بیولوژی سیستمها خواهد بود.
بخش ۳: ابزارها و فناوریها در ژنومیکس
مقدمه: پیشرفت ژنومیکس با نوآوری فناورانه
رشتهی ژنومیکس بهطور اساسی تحت تأثیر پیشرفتهای سریع در زیستشناسی مولکولی، علوم رایانه و مهندسی قرار گرفته است. از روزهای اولیهی تعیین توالی DNA گرفته تا پلتفرمهای پیشرفتهی امروزی که میتوانند در عرض چند ساعت کل یک ژنوم را رمزگشایی کنند، ابزارها و فناوریهای قدرتمند در قلب هر جهش بزرگ علمی در این حوزه قرار داشتهاند.
این نوآوریها باعث شدهاند پژوهشهای ژنومی سریعتر، مقرونبهصرفهتر و در مقیاس وسیعتر انجام شوند و در عین حال، افقهای کاملاً جدیدی در علم زیستشناسی بگشایند. پژوهشگران اکنون میتوانند ژنوم را با وضوح، پیچیدگی و یکپارچگی بیسابقه بررسی کنند و آن را با سایر سیستمهای زیستی ترکیب نمایند.
در این بخش، به بررسی فناوریهای کلیدی میپردازیم که پایه و اساس ژنومیکس مدرن را شکل میدهند، از جمله:
-
پلتفرمهای تعیین توالی (Sequencing)
-
ابزارهای ویرایش ژن (مانند CRISPR)
-
میکروآریها
-
نرمافزارهای بیوانفورماتیکی
-
و فناوریهای نوظهوری مثل ژنومیکس تکسلولی و فضایی
این فناوریها زیربنای تحقیقات مدرن، تشخیص بیماریها و پزشکی شخصیشده هستند و به ما این امکان را میدهند که نقشهی حیات را بخوانیم، تفسیر کنیم و بازنویسی نماییم.
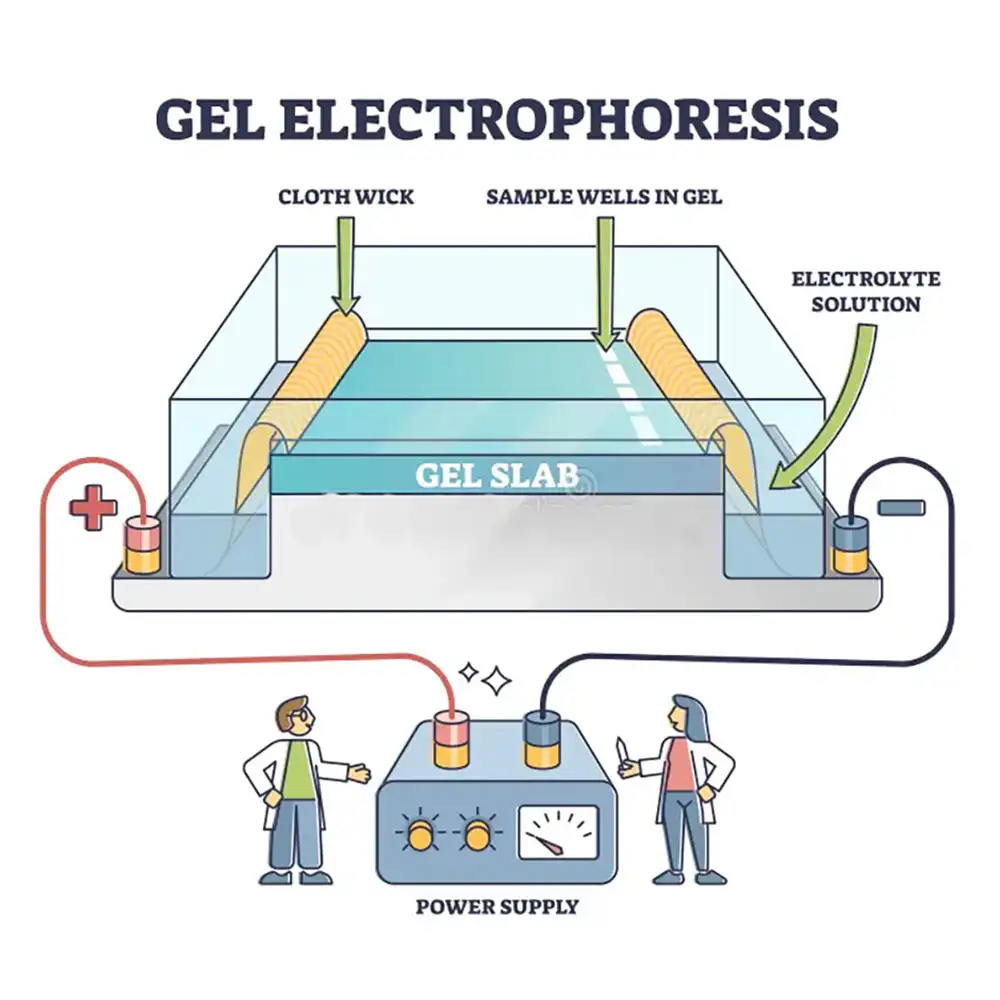
۳.۱ تعیین توالی DNA: از سنگر تا نسل جدید
تعیین توالی سنگر (Sanger): اولین جهش بزرگ
روش سنگر که توسط فردریک سنگر در دهه ۱۹۷۰ توسعه یافت، انقلابی در زیستشناسی مولکولی ایجاد کرد. این روش به دانشمندان اجازه داد ترتیب دقیق نوکلئوتیدها در مولکول DNA را شناسایی کنند. این کار با وارد کردن دیدئوکسینوکلئوتیدها (ddNTPs) در فرایند سنتز DNA انجام میشود. این نوکلئوتیدها در نقاط خاصی زنجیره را قطع کرده و قطعات با طولهای متفاوت تولید میکنند. سپس این قطعات با الکتروفورز ژلی یا موئینهای جدا شده و توالی DNA مشخص میشود.
با وجود دقت بالا، این روش مقیاسپذیری پایینی دارد و کند و پرهزینه است. امروزه هنوز در کاربردهایی مانند توالییابی هدفمند یا تأیید کلینیکی استفاده میشود، اما راه را برای فناوریهای پیشرفتهتر باز کرد.
توالییابی نسل جدید (NGS): جهشی کوانتومی
ظهور پلتفرمهای نسل جدید در اوایل دهه ۲۰۰۰، توانمندی ژنومیکس را دگرگون کرد. پلتفرمهایی مانند Illumina (با فناوری سنتز) و Ion Torrent (با سنجش تغییر pH) اجازه میدهند میلیونها قطعه DNA بهصورت موازی توالییابی شوند.
مزایای NGS:
-
کاهش چشمگیر در هزینه و زمان توالییابی کل ژنوم
-
امکان انجام مطالعات ترانسکریپتوم (RNA-seq)، اپیژنوم، و توالییابی اگزوم
مراحل اصلی در NGS شامل:
-
آمادهسازی کتابخانه: شکستن DNA/RNA و اتصال آداپتورها
-
تقویت و ایجاد خوشه (cluster)
-
توالییابی: شناسایی نوکلئوتیدها از طریق تغییرات فلورسانس یا pH
-
تحلیل دادهها: کنترل کیفیت، همترازی، شناسایی و تفسیر واریانتها
توالییابی نسل سوم و خوانشهای بلند (Long-Read)
برای غلبه بر محدودیتهای خوانش کوتاه (مثل ناتوانی در بررسی نواحی تکراری یا واریانتهای ساختاری)، فناوریهایی مانند PacBio و Oxford Nanopore توسعه یافتهاند که میتوانند قطعات بسیار بلند DNA را در زمان واقعی بخوانند.
ویژگیها:
-
PacBio HiFi: دقت بالا با طول خوانش بلند
-
Nanopore: دستگاههای قابل حمل با نیاز کم به آمادهسازی نمونه
کاربردها:
-
مونتاژ ژنوم از صفر (De novo)
-
شناسایی واریانتهای ساختاری
-
فازبندی هاپلوتایپها
-
بررسی کامل RNAها (Full-length transcript)
۳.۲ واکنش زنجیرهای پلیمراز (PCR): تقویت نقشهی حیات
ابزاری حیاتی در ژنومیکس، PCR است که در دهه ۱۹۸۰ توسط کاری مولیس ابداع شد. PCR امکان تقویت نمایی بخش خاصی از DNA را فراهم میکند، حتی اگر تنها مقدار کمی از آن وجود داشته باشد.
انواع مهم PCR:
-
qPCR: برای اندازهگیری بیان ژن
-
dPCR: برای تعیین دقیق واریانتهای نادر
-
RT-PCR: تبدیل RNA به DNA جهت آنالیز
PCR در کنار توالییابی، ژنوتیپسازی، تحلیل قانونی و تشخیص پاتوژنها کاربرد گسترده دارد.
۳.۳ میکروآریها: پیشگامان تحلیل ژنوم
پیش از رایج شدن NGS، میکروآریها ابزار اصلی برای تحلیل ژنوم بودند. این تراشهها شامل هزاران پروب DNA تثبیتشده هستند که با نمونههای نشاندارشده فلورسانس هیبرید میشوند. الگوی فلورسانس حاصل، اطلاعاتی درباره بیان ژن، SNPها یا CNVها ارائه میدهد.
با وجود جایگزینی در بسیاری از موارد، هنوز هم در تشخیصهای کلینیکی پرکاربردند، مانند:
-
غربالگری ژنتیکی (مثلاً در بارداری)
-
پروفایلگیری بیان ژن
-
هیبریداسیون تطبیقی ژنومی
۳.۴ CRISPR-Cas و ویرایش ژنوم
یکی از انقلابیترین فناوریها در زیستشناسی مولکولی، CRISPR-Cas9 است. این ابزار از سیستم ایمنی باکتریها الهام گرفته شده و امکان برش هدفمند DNA در موقعیت خاص را فراهم میکند، به کمک آنزیم Cas9 و RNA راهنما.
کاربردهای CRISPR:
-
خاموش کردن یا جایگزینی ژنها
-
غربالگری عملکردی ژنها
-
اصلاح جهشهای بیماریزا
-
ویرایش اپیژنوم با dCas9 غیرکاتالیزگر
ابزارهای جدیدتر مانند:
-
Base Editing: تغییر بازهای منفرد بدون ایجاد برش دو رشتهای
-
Prime Editing: ایجاد ویرایشهای دقیقتر با دامنه وسیعتر
این فناوریها افقهای تازهای برای درمان و تحقیق گشودهاند.
۳.۵ بیوانفورماتیک: موتور تفسیر دادههای ژنومیک
حجم عظیم دادههای تولیدشده توسط فناوریهای ژنومیکس، بدون بیوانفورماتیک غیرقابل درک است. این رشته ترکیبی از زیستشناسی، علوم رایانه و آمار است و به تحلیل و تفسیر دادههای ژنومی میپردازد.
ابزارهای کلیدی:
-
ابزارهای همترازی توالی: مانند BLAST، BWA، Bowtie
-
پایپلاینهای شناسایی واریانت: مثل GATK
-
تحلیل بیان ژن: با DESeq2، edgeR
-
تحلیل مسیرهای زیستی و شبکههای ژنی
همچنین:
-
مرورگرهای ژنومی مانند UCSC و Ensembl
-
رایانش ابری و یادگیری ماشین برای تحلیل در مقیاس جمعیت و کشف الگوهای بیماری
۳.۶ فناوریهای نوظهور: تکسلولی، فضایی و چند-اُمیک
ژنومیکس تکسلولی
امکان مطالعهی ژنوم در سطح تکسلول یکی از هیجانانگیزترین دستاوردهای اخیر است. برخلاف روشهای سنتی که میانگین دادههای هزاران سلول را ارائه میدهند، این روشها ناهمگونی سلولی، مسیرهای تمایز و تبار سلولی را آشکار میسازند.
روشها:
-
scRNA-seq: پروفایلگیری بیان ژن در سلولهای منفرد
-
scATAC-seq: بررسی دسترسی کروماتین
-
Multi-omics تکسلولی: ترکیب ترانسکریپتوم، اپیژنوم، پروتئوم
ژنومیکس فضایی
در این حوزه، موقعیت مکانی بیان ژن و ساختار کروماتین در بافت حفظ میشود. فناوریهایی مانند MERFISH، SeqFISH، و Visium از 10x Genomics امکان مشاهده فعالیت ژنها در مقطع بافتی را فراهم میکنند.
کاربردها:
-
بررسی میکرو محیطهای بافتی
-
درک ناهمگونی تومور
-
مطالعه رشد و تکوین اندامها
یکپارچهسازی اُمیکسها (Multi-Omics)
زیستشناسی بهطور ذاتی پیچیده و درهمتنیده است. به همین دلیل، دانشمندان بهطور فزایندهای از رویکرد چند-اُمیک استفاده میکنند که شامل:
-
ژنومیکس
-
ترانسکریپتومیکس
-
اپیژنومیکس
-
پروتئومیکس
-
متابولومیکس
این ترکیب چندلایه با کمک هوش مصنوعی و مدلهای یادگیری ماشین منجر به درک سیستمی از سلامت، بیماری و رشد میشود؛ الگویی فراتر از تحلیل تکبعدی.
۳.۷ اتوماسیون، رباتیک و پلتفرمهای پرتوان
در دوران کلانداده و پزشکی دقیق، ژنومیکس به یک علم در مقیاس بالا تبدیل شده است. ابزارهایی مانند:
-
رباتهای جابهجایی مایعات
-
سیستمهای خودکار آمادهسازی کتابخانه
-
توالییابهای پرتوان
امکان پردازش هزاران نمونه بهصورت همزمان و با خطای اندک انسانی را فراهم کردهاند.
فناوریهایی مانند:
-
آزمایشگاه روی تراشه (Lab-on-a-chip)
-
سنسورهای نانوپور
-
میکروفلوئید دیجیتال
باعث کاهش هزینه و افزایش دسترسی به ژنومیکس در مراکز درمانی یا میدانی شدهاند.
جمعبندی: اکوسیستم فناورانه در خدمت کشف علمی
ابزارها و فناوریهایی که در این بخش بررسی شد، زیربنای یک اکوسیستم زنده، پویا و در حال تحول سریع هستند که مرزهای ممکن در ژنومیکس را بهطور مداوم جابجا میکنند.
از ابزارهای پایهای مانند PCR و میکروآریها گرفته تا روشهای پیشرفته مانند CRISPR و توالییابی تکسلولی، هر نوآوری به ما امکان میدهد که ژنوم را بخوانیم، بازنویسی کنیم و مهندسی مجدد نماییم.
این فناوریها نهتنها شگفتیهای فناورانه هستند، بلکه محرکهای واقعی کشف علمی نیز به شمار میروند و ما را به سمت آیندهای سوق میدهند که در آن:
-
پزشکی شخصی، پیشبینیپذیر و پیشگیرانه محقق شود
-
سلامت و درمانها دقیقتر، سریعتر و مؤثرتر باشند
در عصر ژنوم، همافزایی فناوری، رایانش و زیستشناسی، موتور اصلی تحول علم و زندگی خواهد بود.
بخش ۴: تحلیل دادههای ژنومی و بیوانفورماتیک
مقدمه: از توالی خام تا بینشهای زیستی
توالییابی DNA—چه از یک ژن خاص، یک ژنوم کامل یا هزاران سلول منفرد—تنها آغاز کار است. زمانی که دادههای خام توسط دستگاههای توالییابی تولید میشوند، باید مراحل تحلیلی مختلفی را طی کنند تا به اطلاعات زیستی معنادار تبدیل شوند. این تبدیل در حوزهی بیوانفورماتیک انجام میشود؛ رشتهای میانرشتهای در تقاطع زیستشناسی، علوم کامپیوتر، ریاضیات و آمار.
بیوانفورماتیک صرفاً یک ابزار کمکی در ژنومیک نیست؛ بلکه موتور محرک اصلی هر کشف زیستی است. چه در شناسایی جهشهای بیماریزا، بازسازی شجرههای تکاملی، پیشبینی عملکرد ژنها یا مدلسازی شبکههای تنظیمی، تحلیل ژنومی وابسته به ابزارهای محاسباتی قدرتمند، الگوریتمهای پیشرفته و تفسیر دقیق زیستی است.
در این بخش، اجزای اصلی تحلیل دادههای ژنومی، انواع دادههای تولید شده، ابزارهای تفسیر آنها و چالشهای عملی در مدیریت و درک این حجم عظیم از اطلاعات ژنومی را بررسی خواهیم کرد.
۴.۱ انواع دادههای ژنومی: مواد اولیهی کشف
انواع مختلف آزمایشهای ژنومی دادههای متفاوتی تولید میکنند که هرکدام ساختار، چالش و کاربرد خاص خود را دارند.
۱. دادههای توالی DNA:
-
توالییابی ژنوم کامل (WGS): توالی تمام DNA یک موجود زنده.
-
توالییابی اگزوم کامل (WES): توالی تمام نواحی کدکنندهی پروتئین.
-
توالییابی پنل هدفمند: زیرمجموعهای از ژنها یا نواحی خاص.
خروجی: فایلهای FASTQ شامل توالیهای کوتاه DNA و نمرات کیفیت.
۲. دادههای RNA-seq:
بیان ژن را در سراسر ترنسکریپتوم اندازهگیری میکند.
خروجی شامل توالیهای خام و مقادیر بیان ژن (مانند TPM و FPKM).
۳. دادههای اپیژنومیک:
شامل الگوهای متیلاسیون، دسترسی کروماتین (ATAC-seq)، تغییرات هیستونی (ChIP-seq) و غیره.
۴. دادههای واریانت:
شامل SNPها، ایندلها، واریانتهای ساختاری و تغییرات تعداد نسخه.
در قالب VCF ذخیره میشوند و دارای اطلاعات مکان ژن و پاتوژنیسیته هستند.
۵. ارتباط ژنوتیپ و فنوتیپ:
از مطالعات همبستگی ژنومی (GWAS) بهدست میآید که تغییرات ژنتیکی را با صفات یا بیماریها مرتبط میکند.
۴.۲ مسیر بیوانفورماتیکی: از دستگاه تا بینش
یک جریان کاری معمول در بیوانفورماتیک مراحل زیر را طی میکند:
مرحله ۱: کنترل کیفیت (QC)
پس از توالییابی، ارزیابی کیفیت دادههای خام:
-
FastQC: گزارشهایی از کیفیت بازها، میزان GC، آلودگی آداپتورها
-
MultiQC: ترکیب گزارشهای QC برای چند نمونه
ابزارهای حذف نویز و بازهای بیکیفیت:
-
Trimmomatic
-
Cutadapt
مرحله ۲: همترازی توالیها (Alignment)
نقشهبرداری توالیها روی ژنوم مرجع:
-
BWA برای دادههای DNA
-
STAR برای RNA-seq
خروجی: فایلهای SAM/BAM نشاندهنده موقعیت بازها روی ژنوم
مرحله ۳: فراخوانی واریانتها (Variant Calling)
شناسایی تفاوتهای نمونه با ژنوم مرجع:
-
GATK: استاندارد طلایی برای شناسایی واریانتها
-
FreeBayes، Samtools، DeepVariant
خروجی: فایل VCF با موقعیت SNPها، ایندلها و واریانتها
مرحله ۴: حاشیهنویسی عملکردی (Annotation)
تفسیر واریانتها در زمینه زیستی:
-
تأثیر بر ژنها
-
تغییرات آمینواسیدی
-
شیوع جمعیتی
ابزارهای مهم:
-
ANNOVAR
-
SnpEff
-
VEP
۴.۳ تحلیل RNA-seq: درک ترنسکریپتوم
تحلیل دادههای RNA مسیر متفاوتی دارد:
۱. کمیسازی ترنسکریپتها:
-
HTSeq-count، featureCounts، Salmon، Kallisto
-
خروجی: ماتریس شمارش برای تحلیلهای بعدی
۲. نرمالسازی:
-
TPM یا روشهای مبتنی بر DESeq2 برای تحلیل افتراق بیان
۳. تحلیل بیان تفاضلی (DEA):
-
DESeq2، EdgeR، Limma-Voom
۴. غنیسازی عملکردی (Enrichment):
-
نگاشت ژنها به GO، KEGG و Reactome
-
ابزارها: Enrichr، DAVID، g:Profiler
۴.۴ تحلیل واریانتهای ساختاری و تعداد نسخه
-
CNVkit، Control-FREEC برای CNV
-
Manta، Lumpy برای جابهجاییها و وارونگیها
-
توالییابی بلندخوان دقت شناسایی این واریانتها را افزایش داده است.
کاربرد در بیماریهای نادر، سرطانها و اختلالات رشدی
۴.۵ تحلیل دادههای اپیژنومیک
-
Bisulfite sequencing برای متیلاسیون
-
ATAC-seq برای کروماتین باز
-
ChIP-seq برای اتصال پروتئین به DNA
ابزارها:
-
Bismark
-
MACS2
-
DiffBind
کاربرد در فهم تنظیم ژن و نقش ساختار کروماتین در سلامت و بیماری
۴.۶ مصورسازی و تفسیر دادهها
-
IGV: مشاهده بصری همترازی، واریانت و بیان
-
UCSC Genome Browser: مرورگر تحت وب برای بررسی ژنوم
-
Circos، Heatmap، Volcano Plot، PCA، UMAP
مصورسازی مؤثر پل ارتباطی بین دانشمندان داده و زیستشناسان است.
۴.۷ یادگیری ماشین و هوش مصنوعی در ژنومیک
-
مدلهای یادگیری عمیق مانند DeepSEA برای پیشبینی اثر جهشها
-
شناسایی زیرگروههای سرطان
-
مدلسازی شبکههای تنظیمی
-
طبقهبندی سلولها در دادههای تکسلولی
ابزارها: TensorFlow، PyTorch، scikit-learn، XGBoost
۴.۸ ذخیرهسازی، اشتراکگذاری و اخلاق دادهها
-
دادههای ژنومی حجیم هستند (ترابایتها)
-
زیرساخت ابری: AWS، Google Cloud، Azure
مخازن داده:
-
NCBI SRA، ENA، dbSNP، GEO
نگرانیهای مهم:
-
حفظ حریم خصوصی
-
مطابقت با قوانین مانند HIPAA (آمریکا)، GDPR (اروپا)
-
مدلهای دسترسی کنترلشده مانند GA4GH
-
مسائل اخلاقی: رضایت آگاهانه، سوءاستفاده بالقوه، خطر شناسایی مجدد
نتیجهگیری: درک جهان ژنومی
تحلیل دادههای ژنومی و بیوانفورماتیک هستهی تفسیر ژنوم مدرن هستند. بدون این ابزارها، دادههای حجیم بیمعنا و غیرقابل استفاده خواهند بود. اما به لطف این تکنولوژیها، پژوهشگران میتوانند ژنوم را با دقت، عمق و مقیاس بیسابقهای بررسی کنند.
با رشد روزافزون دادههای ژنومی و ظهور لایههای جدید اُمیک، نقش بیوانفورماتیک حیاتیتر خواهد شد. آیندهی این حوزه در گرو توسعه الگوریتمهای بهینهتر، ابزارهای کاربرپسندتر، ادغام بهتر بین دادهها و مهمتر از همه، کاربرد مؤثر این توان فناورانه در بهبود علم، تشخیص، و سلامت انسان است.
بخش ۵: کاربردهای ژنومیک در پزشکی و سلامت
مقدمه: یک انقلاب ژنومی در مراقبتهای سلامت
در دو دههی گذشته، ژنوم انسان از یک کد انتزاعی به ابزاری بالینی تبدیل شده است. ژنومیک دیگر محدود به آزمایشگاههای تحقیقاتی نیست؛ بلکه امروزه نقش فزایندهای در بیمارستانها، کلینیکها، مراکز تشخیص و راهبردهای سلامت عمومی دارد. با کشف پایهی مولکولی بیماریها، هدایت درمانهای شخصیسازیشده، پیشبینی خطرات سلامت آینده و شناسایی ناقلان بیماریهای وراثتی، ژنومیک در حال بازتعریف شیوهی اعمال پزشکی است—گذار از یک مدل واکنشی به مدلی پیشبینیکننده، پیشگیرانه و شخصیسازیشده.
در این بخش، کاربردهای اصلی بالینی ژنومیک را بررسی میکنیم، از جمله نقش آن در تشخیص، درمان، داروشناسی ژنتیکی، انکولوژی، بیماریهای نادر، بیماریهای عفونی و سلامت عمومی. همچنین چالشهای پیادهسازی پزشکی ژنومی در مقیاس وسیع و آیندهی احتمالی مراقبتهای سلامت مبتنی بر ژنوم را بررسی خواهیم کرد.
۵.۱ ژنومیک در تشخیص
۱. شناسایی ژنهای بیماریزا
توالییابی ژنومی امکان شناسایی جهشهای مسبب بیماری را فراهم کرده است، بهویژه در بیماریهای مونوزیگوت مانند:
-
فیبروز کیستیک (ژن CFTR)
-
بیماری هانتینگتون (ژن HTT)
-
دیستروفی عضلانی دوشن (ژن DMD)
-
کمخونی داسیشکل (ژن HBB)
برای بیمارانی با بیماریهای بدون تشخیص، بهویژه در کودکان، توالییابی اگزوم کامل (WES) یا ژنوم کامل (WGS) میتواند علت ژنتیکی را شناسایی کند، زمانی که روشهای سنتی تشخیصی ناکام میمانند.
۲. غربالگری ژنومی پیش از تولد و نوزادان
آزمایشهای ژنومی اکنون در سلامت باروری ادغام شدهاند:
-
غربالگری ناقلان: شناسایی خطر بیماریهای نهفته در والدین.
-
آزمایش غیرتهاجمی پیش از تولد (NIPT): تحلیل DNA جنین در خون مادر برای تشخیص ناهنجاریهای کروموزومی (مانند سندرم داون).
-
غربالگری ژنومی نوزادان: تشخیص زودهنگام بیماریهای نادر ولی قابل درمان.
با کاهش هزینهها و پیشرفت تکنولوژی، این آزمایشها ممکن است به استاندارد مراقبتی در بسیاری از نظامهای سلامت تبدیل شوند.
۵.۲ داروشناسی ژنتیکی: تطبیق دارو با ژن
داروشناسی ژنتیکی (Pharmacogenomics یا PGx) بررسی میکند که چگونه تغییرات ژنتیکی پاسخ افراد به داروها را تحت تأثیر قرار میدهد. این دانش امکان تجویز شخصیسازیشده را فراهم میکند—افزایش اثربخشی و کاهش عوارض جانبی.
نمونههای کلیدی:
-
خانواده ژنی CYP450: تغییرات در ژنهای CYP2C19، CYP2D6 و CYP3A5 بر سوختوساز داروهایی مانند ضدافسردگیها، داروهای روانپزشکی، استاتینها و داروهای ضد درد تأثیر میگذارند.
-
ژن TPMT: بر دوزدهی ایمن تیاوپورینها در درمان لوسمی مؤثر است.
-
آلل HLA-B*57:01: با حساسیت به داروی HIV به نام Abacavir مرتبط است.
-
ژنهای VKORC1 و CYP2C9: راهنمای دوزدهی وارفارین.
امروزه بسیاری از مراکز درمانی از پنلهای داروشناسی ژنتیکی در پروندههای سلامت الکترونیک (EHR) برای انتخاب بهتر دارو بر اساس ژنهای بیمار استفاده میکنند.
۵.۳ انکولوژی و ژنومیک سرطان
ژنومیک انکولوژی را متحول کرده و امکان درمان سرطان دقیق (Precision Medicine) را فراهم ساخته است. دیگر تنها بافت سرطان ملاک درمان نیست، بلکه امضای مولکولی آن نیز در نظر گرفته میشود.
کاربردها:
۱. پروفایلکردن جهشهای سوماتیک
توالییابی تومورها برای شناسایی:
-
جهشهای راننده (مانند KRAS، EGFR، BRAF)
-
ادغامهای ژنی (مانند ALK، ROS1)
-
تغییرات تعداد نسخه و ناپایداری میکروساتلایت (MSI)
این دادهها درمانهای هدفمند را هدایت میکنند (مانند مهارکنندههای EGFR در سرطان ریه، یا BRAF در ملانوما).
۲. آزمایشهای ژرملاین در سندرمهای سرطان ارثی
-
BRCA1/2: خطر سرطان پستان و تخمدان.
-
MLH1، MSH2، PMS2: سندرم لینچ (سرطان کولورکتال و آندومتر).
این آزمایشها با مشاوره ژنتیک همراه هستند تا خطر در اعضای خانواده مدیریت شود.
۳. بیوپسی مایع (Liquid Biopsy)
شناسایی DNA توموری در گردش (ctDNA) در خون به صورت غیرتهاجمی برای:
-
تشخیص سرطان
-
پایش پاسخ به درمان
-
شناسایی عود بیماری
۵.۴ ژنومیک در بیماریهای نادر و بدون تشخیص
بیماریهای نادر میلیونها نفر را در سراسر جهان تحت تأثیر قرار میدهند و بسیاری از آنها سالها بدون تشخیص باقی میمانند. توالییابی ژنومی ابزاری قدرتمند برای تشخیص بیماریهایی است که از نظر ژنتیکی ناهمگون یا از نظر بالینی مبهم هستند.
برنامهها و ابتکارات:
-
شبکه بیماریهای بدون تشخیص (UDN)
-
Solve-RD (اروپا)
-
پروژه ژنومهای نادر (مؤسسه Broad)
این پروژهها نشان دادهاند که استفاده از توالییابی تریویی (بیمار + والدین) و تحلیلهای ژنوم کامل منجر به نرخ بالای تشخیص میشود. در برخی موارد، یافتن علت ژنتیکی منجر به دسترسی به کارآزماییهای بالینی، بازاستفاده از داروها یا درمانهای هدفمند شده است.
۵.۵ ژنومیک و بیماریهای عفونی
ژنومیک در شناسایی، پیگیری و مبارزه با بیماریهای عفونی نقش کلیدی دارد.
۱. توالییابی پاتوژنها
توالییابی کامل ژنوم باکتریها، ویروسها و انگلها برای:
-
شناسایی دقیق
-
تعیین نوع سویه
-
تحلیل مقاومت دارویی
ابزارهایی مانند Nextstrain روند تکامل ویروسها را بهصورت زنده نمایش میدهند (مثلاً در دوران کووید-۱۹).
۲. پایش مقاومت آنتیبیوتیکی (AMR)
ژنومیک امکان پیشبینی ژنهای مقاومت (مانند β-lactamases، mcr-1) را فراهم میکند. بیمارستانها از این ابزارها برای ردیابی عفونتهای بیمارستانی و شیوعها استفاده میکنند.
۳. برهمکنش میزبان و پاتوژن
مطالعات ژنوم انسانی نشان دادهاند که چرا برخی افراد نسبت به عفونتها مقاومتر هستند (مثلاً جهش CCR5 و مقاومت به HIV).
۵.۶ ژنومیک سلامت عمومی
ژنومیک سلامت عمومی از علم ژنوم برای بهبود سلامت در سطح جمعیت استفاده میکند.
کاربردها:
-
پایش ژنومی بیماریهای نوظهور (مانند واریانتهای SARS-CoV-2)
-
برنامههای غربالگری برای بیماریهایی مثل هایپرکلسترولمی خانوادگی
-
ژنومیک جمعیت برای ارزیابی خطر بیماری در نژادهای مختلف
مقامات سلامت عمومی اکنون بیشتر از نمرات خطر چندژنی (Polygenic Risk Scores یا PRS) برای پیشگیری استفاده میکنند، بهویژه در:
-
بیماری قلبی-عروقی
-
دیابت نوع ۲
-
سرطان پستان و پروستات
۵.۷ ژندرمانی و پزشکی ژنومی
پیشرفت در CRISPR-Cas9، ویرایش باز، و ناقلهای ژندرمانی عصری نو در پزشکی ژنومی رقم زده است؛ عصری که در آن ژنوم تنها خوانده نمیشود، بلکه بازنویسی نیز میشود.
موارد مهم:
-
Luxturna: نخستین ژندرمانی تأییدشده FDA برای نابینایی ارثی (جهش RPE65)
-
Zolgensma: ژندرمانی برای آتروفی عضلانی نخاعی
-
بیماری داسیشکل: آزمایشهای CRISPR با هدف تقویت هموگلوبین جنینی از طریق BCL11A
اگرچه هنوز در مراحل اولیه است، اما ویرایش ژن پتانسیل تحول در درمان بیماریهای مونوزیگوت و حتی پیچیده را دارد.
۵.۸ چالشها در پزشکی ژنومی بالینی
با وجود نویدهای فراوان، پزشکی ژنومی با موانع جدی در پیادهسازی مواجه است:
۱. تفسیر دادهها:
-
واریانتهای با اهمیت نامشخص (VUS) رایج هستند.
-
کمبود داده از جمعیتهای کمنماینده منجر به تفسیر مغرضانه میشود.
۲. زیرساخت و آموزش:
-
نیازمند خطوط تحلیل بیوانفورماتیکی، ادغام با EHR و آموزش نیروی انسانی در ژنومیک است.
۳. ابعاد اخلاقی، قانونی و اجتماعی (ELSI):
-
چگونه با یافتههای ثانویه برخورد کنیم؟
-
قوانین برای تماس مجدد با بیماران چیست؟
-
مالک دادههای ژنومی کیست؟
سواد ژنومی و چارچوبهای اخلاقی باید همگام با تکنولوژی پیش بروند
بخش ۶: ژنومیک تطبیقی و ژنومیک تکاملی
مقدمه: آینهای ژنتیکی از تاریخچه تکامل
ژنومیک تطبیقی و ژنومیک تکاملی در تقاطع زیستشناسی مولکولی، فیلوژنتیک و نظریه تکامل قرار دارند و نمایی گسترده از ساختار، پویاییها و مسیرهای تکاملی ژنومها در سراسر حیات روی زمین ارائه میدهند. این دو زیرشاخه به طور مشترک هدف دارند تا نه تنها تفاوتهای ژنومها بین گونهها را درک کنند، بلکه علت این تفاوتها، نحوه به وجود آمدن آنها در روندهای تکاملی، و آنچه که درباره منشاء، عملکرد و سرنوشت ماده ژنتیکی نشان میدهند را هم بررسی کنند.
با مقایسه ژنومهای گونههای مختلف — چه گونههای نزدیک به هم، چه شاخههای دور از هم، یا حتی اجداد منقرض شده که از طریق DNA باستانی بازسازی شدهاند — دانشمندان میتوانند بخشهای حفظشده و ثابت که پایههای عملکردهای زیستی اساسی هستند را کشف کنند و همچنین نوآوریها و نشانههای ژنتیکی را شناسایی کنند که یک شاخه را از دیگری متمایز میسازد.
ژنومیک تکاملی بر اساس این پایه تطبیقی، مکانیزمهایی که باعث تغییرات ژنومی در طول زمان میشوند را بررسی میکند؛ مانند انتخاب طبیعی، رانش ژنتیکی، تکثیر ژن، انتقال افقی ژن، و بازآراییهای ژنومی.
این بخش به اصول، روشها و کشفیات پیشگام در ژنومیک تطبیقی و تکاملی میپردازد و نشان میدهد که چگونه این رشتهها درک ما را از وحدت و تنوع حیات عمیقتر کردهاند.
۶.۱ اصول ژنومیک تطبیقی
ژنومیک تطبیقی بر این ایده استوار است که تاریخچه تکاملی حیات در DNA هر موجودی رمزگذاری شده است و با مقایسه سیستماتیک ژنومهای کامل، میتوانیم الگوهای حفظشده و تفاوتها را شناسایی کنیم که بازتابدهنده فشارهای تکاملی، محدودیتهای عملکردی و نوآوریهای تطبیقی هستند.
هومولوژی و توالیهای حفظشده
یکی از مفاهیم پایه در ژنومیک تطبیقی، هومولوژی است، یعنی توالیهایی که منشاء تکاملی مشترک دارند. ژنهای همولوگ یا آرتولوگها معمولاً در گونههای مختلف یافت میشوند و عملکردهای مشابهی دارند که باعث میشود برای مقایسههای بینگونهای و استنتاج عملکرد بسیار ارزشمند باشند. در مقابل، پارالوگها از تکثیر ژن در داخل یک ژنوم به وجود میآیند و ممکن است به مرور زمان عملکردهای جدید یا تخصصی کسب کنند.
عناصر بسیار حفظشده مثل ژنهای RNA ریبوزومی، پروتئینهای هیستون و آنزیمهای اصلی متابولیکی نشاندهنده عملکردهای زیستی ضروری هستند که تحت انتخاب پاککننده قوی حفظ شدهاند. در مقابل، مناطق غیرحفظشده یا اختصاصی هر شاخه اغلب به ویژگیهایی اشاره دارند که اخیراً تکامل یافته یا منحصر به محیطهای زیستی خاص هستند.
سیتنی و سازماندهی ژنوم
ژنومیک تطبیقی همچنین به بررسی سیتنی میپردازد؛ یعنی حفظ ترتیب و جهتگیری ژنها در طول کروموزومها بین گونهها. تحلیل سیتنی میتواند بازآراییهای بزرگ کروموزومی مثل معکوسها، انتقالها، ادغامها و جدا شدنها را که در ایجاد گونهها و تکامل ژنومی نقش دارند، آشکار کند. مثلاً انسان و موش باوجود میلیونها سال فاصله تکاملی، بخش قابل توجهی از سیتنی را حفظ کردهاند و این حفاظت امکان استفاده از موش به عنوان مدل مطالعه بیماریهای انسانی را فراهم میکند.
۶.۲ ابزارها و فناوریهای ژنومیک تطبیقی
رشد فناوریهای توالییابی با سرعت بالا، ژنومیک تطبیقی را دمکراتیک کرده و امکان ساخت و حاشیهنویسی هزاران ژنوم، از ارگانیسمهای مدل تا گونههای غیرمدل و حتی اجداد منقرضشده را فراهم آورده است. چندین ابزار و پایگاه داده محاسباتی برای تحلیلهای ژنومیک تطبیقی حیاتی هستند.
تراز و حاشیهنویسی ژنوم
برنامههایی مانند MAUVE، MUMmer و LASTZ برای تراز کردن توالیهای بزرگ ژنومی و شناسایی مناطق حفظشده استفاده میشوند، در حالی که ابزارهایی مثل OrthoFinder، BLAST و Clustal Omega برای شناسایی ژنها و خانوادههای پروتئینی همولوگ در گونههای مختلف کاربرد دارند. تراز چندگانه توالیها تکنیک اصلی برای ارزیابی حفظ در سطح نوکلئوتید یا آمینو اسید است.
ابزارهای حاشیهنویسی مانند Ensembl، RefSeq و Gene Ontology اطلاعات سازمانیافتهای درباره عملکرد، تنظیم و بیان ژنها فراهم میکنند که برای نتیجهگیریهای زیستی از مقایسههای خام توالی بسیار مهم هستند.
فیلوژنومیک
فیلوژنومیک، دادههای ژنومی را با درختهای تکاملی تلفیق میکند و به محققان امکان میدهد روابط تکاملی گونهها را استنباط و زمان رویدادهای اصلی واگرایی را تخمین بزنند. این روشها بر ساعتهای مولکولی، الگوریتمهای حداکثر درستنمایی و استنتاج بیزی متکی هستند که مدلهای تکاملی قوی مبتنی بر شواهد ژنومی میسازند.
۶.۳ ژنومیک تکاملی: مکانیزمهای تغییر ژنوم
در حالی که ژنومیک تطبیقی بر شناسایی شباهتها و تفاوتها بین ژنومها تمرکز دارد، ژنومیک تکاملی به دنبال توضیح دادن چگونگی و چرایی به وجود آمدن این تفاوتها است. چند مکانیزم کلیدی تغییر ژنوم وجود دارد:
۱. جهش و انتخاب
جهشها — چه جایگزینیهای تک نوکلئوتیدی، درج، حذف یا تغییرات ساختاری — ماده خام تکامل هستند. اکثر جهشها خنثی یا مضر هستند، اما گاهی جهش سودمندی رخ میدهد که مزیت انتخابی ایجاد کرده و در جمعیت افزایش مییابد، فرآیندی که به آن انتخاب مثبت میگویند.
نشانههای انتخاب را میتوان از طریق الگوهای تنوع ژنتیکی، مانند نسبتهای dN/dS (نرخ جهشهای غیرهممعنی به هممعنی) تشخیص داد که به تمایز بین انتخاب پاککننده، تکامل خنثی و تطبیقی کمک میکند.
۲. تکثیر ژن و نئوفانکشنالیزاسیون
تکثیر ژن محرک قدرتمندی برای نوآوری ژنومی است. ژنهای تکثیر شده که ابتدا افزونگی داشتند، ممکن است نئوفانکشنالیزاسیون (کسب عملکردهای جدید) یا سابفانکشنالیزاسیون (تقسیم عملکردهای اصلی) را تجربه کنند. این فرآیند موجب تنوع خانوادههای ژنی مانند گیرندههای بویایی، گلوبینها و اجزای سیستم ایمنی میشود.
۳. انتقال افقی ژن
که به ویژه در پروکاریوتها رایج است، انتقال افقی ژن امکان جابجایی ماده ژنتیکی بین موجودات نامرتبط را فراهم میکند و از وراثت سنتی عبور میکند. انتقال افقی باعث سازگاری سریع، مانند گسترش ژنهای مقاومت به آنتیبیوتیک، میشود و میتواند تحلیلهای فیلوژنتیکی را پیچیده کند.
۴. عناصر انتقالی و پویایی ژنوم
عناصر انتقالی (TE) توالیهای متحرکی هستند که میتوانند خود را تکثیر و در مکانهای جدید ژنوم جای دهند. گرچه اغلب به عنوان انگلهای ژنومی در نظر گرفته میشوند، TEها میتوانند نقش مهمی در تکامل ایفا کنند؛ مثلاً با تغییر تنظیم ژنها، افزایش ریکامبیناسیون و فراهم کردن مواد اولیه برای ژنها و شبکههای تنظیمی جدید.
۶.۴ مطالعات موردی در ژنومیک تطبیقی و تکاملی
۱. ژنومهای انسان و شامپانزه
توالییابی ژنومهای انسان و شامپانزه نشان داد که تقریباً ۹۸.۷٪ شباهت در سطح نوکلئوتید دارند. با این حال، تفاوتهای کلیدی در تنظیم ژنها، ژنهای مرتبط با توسعه مغز (مانند FOXP2 و HAR1) و تغییرات تعداد نسخهها به توضیح تفاوتهای عمیق رفتاری و شناختی بین این دو گونه کمک میکنند. مطالعات ژنومیک تکاملی همچنان درک ما را از ویژگیهای منحصر به فرد انسان بهبود میبخشند.
۲. اهلیسازی گیاهان و حیوانات
ژنومیک تطبیقی، پایههای ژنتیکی اهلیسازی در گونههایی مانند سگها، ذرت و برنج را کشف کرده است. برای مثال، تغییر در تعداد نسخههای ژن آمیلاز با مصرف نشاسته در سگهای اهلی و انسانها ارتباط دارد، در حالی که در محصولات کشاورزی، تحلیلهای QTL و شناسایی مناطق انتخابی ژنهای مرتبط با عملکرد، تحمل به تنش و طعم را نشان میدهند.
۳. DNA باستانی و تکامل انسان
پیشرفتها در توالییابی DNA باستانی امکان بازیابی و تحلیل ماده ژنتیکی از گونههای منقرض شده مانند نئاندرتالها و دنیسووانها را فراهم کرده است. این مقایسهها نشان دادهاند که انسانهای مدرن درصد کمی DNA باستانی دارند که بر صفاتی مثل ایمنی، متابولیسم و ریسک بیماریها تأثیرگذار است.
۶.۵ ژنومیک عملکردی در بستر تکاملی
در حالی که ژنومیک تطبیقی به حفظ و تفاوتها میپردازد، ژنومیک عملکردی تلاش میکند این عناصر ژنتیکی را به صفات ظاهری مرتبط سازد. ترکیب ترانسکریپتومیکس، اپیژنتیک و ژنومیک تنظیمی با مطالعات تکاملی به بررسی این موضوع کمک میکند که چگونه تغییرات در بیان و تنظیم ژنها — نه فقط توالی کدکننده — نوآوری تکاملی را هدایت میکنند.
مثلاً مناطق افزایشی (enhancers) که کنترل بیان ژنها در طول توسعه را بر عهده دارند، اغلب به سرعت تکامل مییابند و میتوانند اثرات فنوتیپی بزرگی ایجاد کنند بدون اینکه توالی پروتئینها تغییر کند. این مفهوم اساس نظریه تکامل تنظیمکنندهی سیز (cis-regulatory evolution) است که معتقد است بخش زیادی از تنوع ریختشناسی از تغییرات در DNA تنظیمی غیرکدکننده ناشی میشود.
۶.۶ پایه ژنومی سازگاری و گونهزایی
یکی از چالشهای بزرگ ژنومیک تکاملی، درک مکانیزمهای ژنومی است که به جمعیتها امکان میدهد با محیطهای جدید سازگار شوند و در نهایت گونههای جدید شکل بگیرند. مطالعات ژنتیکی گسترده (GWAS) همراه با تحلیلهای جمعیت ژنتیکی میتوانند لوکوسهای سازگار را شناسایی کنند که مزایای بقا را فراهم میآورند، مانند:
-
سازگاری با سرما در جمعیت اینوئیت (مثلاً خوشه ژنی FADS)
-
سازگاری با ارتفاعات بلند در تبتیها (مثلاً ژن EPAS1)
-
تحمل شوری در گونههای مانگرو
گونهزایی معمولاً شامل انباشت موانع تولید مثلی است، و ژنومیک تطبیقی میتواند مناطق ژنومی مرتبط با ناباروری هیبریدی، ناسازگاری کروموزومی یا مکانیزمهای تقویت که یکپارچگی گونهها را حفظ میکنند، شناسایی کند.
۶.۷ مسیرهای آینده در ژنومیک تطبیقی و تکاملی
آینده ژنومیک تطبیقی و تکاملی در تحلیلهای عمیقتر، گستردهتر و یکپارچهتر نهفته است. با توالییابی ژنوم هزاران گونه، از جمله گونههایی در اکوسیستمها یا شاخههای کمتر مطالعه شده، دیدگاههای بیسابقهای درباره تنوع زیستی، سازگاری و نوآوری تکاملی به دست خواهیم آورد.
روندهای نوظهور شامل موارد زیر است:
-
پانژنومیک: نمایندگی گونهها نه فقط با یک ژنوم مرجع، بلکه با مجموعهای از تمام واریانتهای ژنومی شناخته شده.
-
استفاده از یادگیری عمیق برای پیشبینی ژنوم و مدلسازی تکاملی.
-
رویکردهای متاجنومیک و هولوژنومیک که همتکامل میزبان و میکروبیوم را در نظر میگیرند.
این روشها وعده میدهند که درک ما از تکامل در همه سطوح — از مسیرهای مولکولی تا پویاییهای اکوسیستم — را غنیتر کنند و به زیستشناسی حفاظتی، کشاورزی، زیستشناسی مصنوعی و پزشکی انسانی کمک کنند.
نتیجهگیری: نگاه ژنومی به تنوع حیات
ژنومیک تطبیقی و تکاملی درک ما از زیستشناسی را بنیادین تغییر دادهاند و با ارائه نگاهی ژنومی، منشاء، تنوع و ارتباطات حیات را نشان میدهند. با ترسیم مسیرهای تکاملی در DNA و تفسیر پیامدهای عملکردی آنها، این رشتهها همگرایی عمیقی که همه موجودات را متحد میکند و هم سازگاریهای منحصر به فرد هر گونه را آشکار میسازند.
این داستانی نیست که ایستا باشد، بلکه پویا است — جریان پیوستهای از تغییر، شکلگرفته توسط شانس، ضرورت و نوآوری. و با پیشرفت در توالییابی و درک درخت زندگی، مطالعه ژنومها نه تنها یک تلاش علمی بلکه روایت زندگی خود است.
بخش ۷: ژنومیک جمعیت و تنوع ژنتیکی انسان
مقدمه: دنبال کردن ردپای تنوع ژنتیکی
ژنومیک جمعیت در تقاطع زیستشناسی تکاملی، ژنتیک و علوم محاسباتی قرار دارد و چارچوبی قدرتمند برای درک نحوه توزیع تنوع ژنتیکی در داخل و بین جمعیتها فراهم میکند. همچنین بررسی میکند که این تنوع چگونه بر صفات، سازگاری و حساسیت به بیماریها تأثیر میگذارد. در حالی که ژنتیک جمعیت سنتی بیشتر روی تعداد محدودی از نشانگرهای ژنتیکی و مدلهای نظری تمرکز داشت، ژنومیک جمعیت با بهرهگیری از توالییابی پرسرعت و دادههای گستردهی ژنومی، کل گستره تنوع ژنتیکی را در افراد، گروهها و مناطق جغرافیایی بررسی میکند.
این زیرشاخه نقش مهمی در آشکار کردن تنوع ژنتیکی انسان دارد، ریشههای عمیق اجدادی جمعیتها را کشف میکند، الگوهای مهاجرت و ترکیب ژنها را بازسازی میکند و لوکوسهای ژنتیکی مرتبط با تفاوتهای فنوتیپی مانند رنگ پوست، قد، مقاومت در برابر بیماریها و ویژگیهای متابولیکی را شناسایی میکند. با ادغام دادههای ژنومی با زمینههای جمعیتی، تاریخی و محیطی، ژنومیک جمعیت پنجرهای بیسابقه به سوی پویاییهای تکامل، پیچیدگی تاریخ بشر و پایه ژنتیکی سلامت و بیماری در جمعیتهای باستانی و امروزی باز میکند.
۷.۱ اصول پایه ژنومیک جمعیت
در اصل، ژنومیک جمعیت فرکانس و توزیع آللها (اشکال مختلف یک ژن) را در بین افراد و جمعیتها بررسی میکند. با استفاده از مدلهای آماری مختلف، فرآیندهای تکاملی مانند انتخاب طبیعی، رانش ژنتیکی، مهاجرت و بازترکیبی را استنتاج میکند. با تحلیل کل ژنوم، پژوهشگران میتوانند نشانههای ظریف انتخاب طبیعی، گلوگاههای جمعیتی اخیر، یا گسترش جمعیتها را شناسایی کنند و الگوهای پیوند عدم تعادل را بررسی کنند که همگی بینشهایی درباره چگونگی تکامل ژنومها در پاسخ به فشارهای داخلی و خارجی فراهم میکنند.
برخلاف ژنومیک مقایسهای که تفاوتهای بین گونهای را بررسی میکند، ژنومیک جمعیت درون گونه، بهخصوص در انسان، فعالیت میکند تا تنوع درونگونهای را در مقیاس دقیقتر بررسی کند. پیشرفتهای این حوزه مدیون پروژههایی مانند ۱۰۰۰ ژنوم، HapMap، و پروژه تنوع ژنومی انسانی است که میلیونها واریانت ژنتیکی را در جمعیتهای مختلف انسانی ثبت کرده و تمرکز را از یک ژنوم مرجع واحد به طیف وسیعی از تنوع جهانی منتقل کردهاند.
۷.۲ انواع تنوع ژنتیکی
ژنومیک جمعیت شامل انواع مختلفی از واریانتهای ژنتیکی است، از تکنوکلئوتید پلیمورفیسمها (SNPs) رایج تا واریانتهای ساختاری نادرتر مانند درجها، حذفها، وارونگیها و تغییرات تعداد کپی (CNVs). هر یک از این واریانتها به روشهای مختلف به تنوع ژنتیکی کمک کرده و نقشهای متفاوتی در تکامل و بیان فنوتیپی دارند.
در حالی که SNPها رایجترین شکل تنوع هستند و در مطالعات وابستگی ژنومی (GWAS) بسیار کاربردیاند، واریانتهای ساختاری میتوانند اثرات عملکردی عمیقی داشته باشند، بهویژه اگر بر دوز ژنی تأثیر بگذارند یا توالیهای کدکننده و نواحی تنظیمی را مختل کنند. علاوه بر این، جمعشدن جهشها در DNA میتوکندریایی یا کروموزوم Y ابزارهای مهمی برای ردگیری خطوط مادری و پدری فراهم کردهاند و رکورد مولکولی از مهاجرت و اجداد انسانها را ثبت میکنند.
۷.۳ نیروهای شکلدهنده به تنوع ژنتیکی
چندین نیروی تکاملی به صورت مشترک ساختار ژنتیکی جمعیتها را شکل میدهند و ژنومیک جمعیت تلاش میکند اثرات آنها را از طریق دادههای تجربی و مدلهای شبیهسازی شده کمی کند.
انتخاب طبیعی
انتخاب طبیعی بر اساس تأثیر آللها بر موفقیت تولید مثلی آنها را افزایش یا کاهش میدهد. انتخاب مثبت آللهای مفید را افزایش میدهد، در حالی که انتخاب تصفیهکننده جهشهای مضر را حذف میکند. سیگنالهای ژنومی انتخاب معمولاً از طریق نواحی با تنوع ژنتیکی کاهش یافته، تفکیک فرکانس بالای آللها، یا هموزیگوتی هپلوتیپهای گسترده قابل شناسایی است.
مثالهای کلاسیک انتخاب مثبت در جمعیتهای انسانی شامل آلل سل داسی شکل در مناطق مالاریاخیز، تداوم لاکتاز در جوامع چراننشین، و ژنهای رنگ پوست مانند SLC24A5 است که تحت تأثیر سطوح مختلف اشعه فرابنفش قرار دارند.
رانش ژنتیکی و گلوگاههای جمعیتی
رانش ژنتیکی به تغییرات تصادفی فرکانس آللها به دلیل شانس گفته میشود، بهویژه در جمعیتهای کوچک. رویدادهایی مانند گلوگاههای جمعیتی که کاهش شدید جمعیت را باعث میشوند، میتوانند تأثیرات ماندگاری بر تنوع ژنتیکی داشته باشند. اثر بنیانگذار، نوعی رانش است که وقتی جمعیت جدیدی توسط تعداد کمی از افراد تأسیس میشود، به فرکانس بالای آللهای نادر و پروفایلهای ژنتیکی متمایز منجر میشود.
جریان ژن و ترکیب ژنومی (آدمیکسچر)
جریان ژن، یا انتقال مواد ژنتیکی بین جمعیتها، اثرات متنوعسازی رانش را خنثی میکند و میتواند واریانتهای جدیدی وارد جمعیت کند. تاریخ بشر مملو از نمونههای آدمیکسچر است؛ مثلاً سهم نئاندرتالها و دنیسووانها در ژنوم انسانهای امروزی، یا ترکیب پیچیده اجداد جمعیتهای آمریکای لاتین که تحت تأثیر اروپاییها، آفریقاییها و بومیان بوده است.
۷.۴ چشمانداز تنوع ژنتیکی انسان
یکی از بینشهای کلیدی ژنومیک جمعیت این است که اکثر قریب به اتفاق تنوع ژنتیکی انسانها بین جمعیتها مشترک است و مفهوم «نژاد» در سطح ژنومی پایه زیستی چندانی ندارد. اگرچه برخی آللها در فرکانس بین مناطق جغرافیایی متفاوتند که تحت تأثیر عوامل تاریخی، محیطی یا فرهنگی است، اما همه انسانها به یک گونه تعلق دارند که اختلاف ژنتیکی نسبتاً کمی دارد.
با این حال، ساختار جمعیتی دقیق وجود دارد که درک آن نه تنها برای بازسازی تاریخ بشر ضروری است بلکه برای بهبود دقت و عدالت در ژنومیک پزشکی نیز اهمیت دارد. تفاوتهای فرکانس آللها، الگوهای پیوند عدم تعادل و ساختارهای هپلوتیپی در جمعیتها میتوانند خطر بیماری، متابولیسم دارو و قدرت پیشبینی نمرات پلیژنتیک را تحت تأثیر قرار دهند.
مطالعات ژنومیک جمعیت نشان دادهاند که جمعیتهای آفریقایی بیشترین سطح تنوع ژنتیکی را دارند که با مدل «خروج از آفریقا» درباره منشاء انسانها سازگار است و جمعیتهای غیرآفریقایی زیرمجموعههایی از این تنوع هستند که تحت تأثیر رویدادهای بنیانگذاری و مهاجرتهای بعدی شکل گرفتهاند. مطالعه جمعیتهای بومی یا منزوی نیز واریانتهای منحصر به فرد و نشانههای سازگاری خاصی را کشف کرده که در نمونههای بیشتر جهانی ممکن است از دست برود.
۷.۵ نشانههای ژنومی سازگاری
سازگاری با محیطهای محلی اثرات قابل شناسایی بر ژنوم انسان گذاشته است که بسیاری از آنها بازتاب پاسخهای تکاملی به شرایطی مانند اقلیم، رژیم غذایی، پاتوژنها و ارتفاع است. ژنومیک جمعیت امکان شناسایی این اسویپهای انتخابی را فراهم میکند که در آنها یک آلل مفید به سرعت در جمعیت افزایش مییابد و تنوع ژنتیکی اطراف آن کاهش مییابد.
مثالها شامل:
-
EPAS1 در تبتیها که با تحمل کمبود اکسیژن در ارتفاعات بالا مرتبط است.
-
خوشه ژنی FADS در جمعیتهای قطبی که در متابولیسم اسیدهای چرب و سازگاری با رژیم غذایی دریایی نقش دارد.
-
ژنهای HLA که تحت انتخاب تعادلی قوی قرار دارند و منعکسکننده نبرد بین سیستم ایمنی میزبان و پاتوژنها هستند.
علاوه بر نواحی کدکننده، عناصر تنظیمی غیرکدکننده نیز تحت فشار انتخاب بودهاند و الگوهای بیان ژن را به صورت بافت- و زمان-ویژه تغییر دادهاند. این یافتهها اهمیت نگاه فراتر از اگزومها برای درک معماری کامل ژنومی سازگاری را نشان میدهد.
۷.۶ ژنومیک جمعیت در پزشکی و ژنومیک شخصی
پیامدهای بالینی ژنومیک جمعیت بسیار عمیق است. با وارد کردن تنوع ژنتیکی در جمعیتهای مختلف، پژوهشگران میتوانند تفسیر واریانتهای ژنتیکی را بهبود بخشند، خطاهای مثبت کاذب در مطالعات وابستگی بیماری را کاهش دهند و کاربردپذیری پزشکی دقیق را افزایش دهند.
با این حال، بیشتر تحقیقات ژنومی کنونی بر افراد با اجداد اروپایی تمرکز داشته که منجر به شکاف تنوع در پایگاههای داده ژنتیکی شده و میتواند نابرابریهای بهداشتی را تشدید کند. تلاشهایی مانند H3Africa، All of Us و GenomeAsia 100K در حال رفع این عدم تعادل با توالییابی جمعیتهای کمتر نماینده و دموکراتیزه کردن دسترسی به دادههای ژنومی هستند.
فرکانسهای آللی خاص جمعیتها برای تفسیر واریانتهای با اهمیت نامشخص (VUS) در ژنومیک بالینی بسیار حیاتیاند. علاوه بر این، واریانتهای فارماکوژنومیکی مانند واریانتهای آنزیمهای CYP450 در جمعیتها بسیار متفاوت است و پاسخ به داروهایی مانند ضدافسردگیها تا شیمیدرمانیها را تحت تأثیر قرار میدهد.
۷.۷ چالشها و ملاحظات اخلاقی
در حالی که ژنومیک جمعیت وعدههای بزرگی دارد، سوالات پیچیده اخلاقی، اجتماعی و سیاسی را نیز مطرح میکند. مسائل مربوط به رضایت آگاهانه، مالکیت داده، حریم خصوصی و تقسیم منافع به ویژه هنگام کار با جمعیتهای بومی یا به حاشیه رانده شده اهمیت دارد که سابقهای از کنار گذاشته شدن یا سوءاستفاده در تحقیقات علمی دارند.
تعامل با جامعه، مدیریت شفاف و رویکردهای فرهنگی حساس برای انجام ژنومیک جمعیت اخلاقی ضروری است. همچنین پژوهشگران باید مراقب سوءاستفاده از دادههای ژنومی برای اهداف شبهعلمی یا تبعیضآمیز باشند و بر وحدت گونه انسانی و اشتراک سفر تکاملی ما تاکید کنند.
نتیجهگیری: موزاییک ژنومی بشریت
ژنومیک جمعیت لنز قدرتمندی فراهم میکند تا غنای تنوع انسانی، نیروهایی که ژنومهای ما را شکل دادهاند و تعامل پیچیده بین زیستشناسی، تاریخ و محیط را کاوش کنیم. با پذیرفتن کل طیف تنوع جهانی، نه تنها داستان منشاء و سازگاری انسان را کشف میکنیم بلکه پایهای برای رویکردهای فراگیرتر و موثرتر در بهداشت، سیاست و کشف علمی میگذاریم.
با دسترسی آسانتر به توالییابی و افزایش حجم دادهها، مرز بعدی شامل ادغام ژنومیک با دادههای اجتماعی، محیطی و رفتاری خواهد بود تا درک جامع و کاملی از جمعیتهای انسانی—گذشته، حال و آینده—بدست آوریم.
بخش ۸: مسائل اخلاقی، حقوقی و اجتماعی در ژنومیک (ELSI)
مقدمه: ابعاد اخلاقی علم ژنومیک
با پیشرفت روزافزون ژنومیک که علوم زیستی را متحول کرده و در پزشکی، کشاورزی، علوم قضایی و حتی سیاستهای اجتماعی انقلاب ایجاد کرده است، واضح شده که مسائل اخلاقی، حقوقی و اجتماعی این فناوری قدرتمند باید به همان اندازه جدی گرفته شوند که خود علم اهمیت دارد. ژنومیک تنها یک رشته فنی محدود به آزمایشگاهها و کامپیوترها نیست؛ بلکه مستقیماً با هویت انسانی، حریم خصوصی، تبار، ساختار خانواده، تولید مثل و توزیع سلامت و بیماری در جامعه در ارتباط است. این تقاطعها هم فرصتها و هم ریسکهایی ایجاد میکنند و برای مدیریت آنها نیاز به تلفیق دقیق بیوانتیک، حقوق، سیاست عمومی و مشارکت جامعه است.
چارچوب ELSI که در دهه ۱۹۹۰ به عنوان بخشی از پروژه ژنوم انسانی معرفی شد، اولین نشانه این بود که پیشرفت علمی نباید از مسئولیت اخلاقی پیشی بگیرد. از آن زمان، برنامههای ELSI در سراسر جهان گسترش یافته و به مسائلی مانند تبعیض ژنتیکی، رضایت آگاهانه در تحقیقات ژنومی، بازگرداندن نتایج به شرکتکنندگان، مالکیت دادهها و پیامدهای ویرایش ژرملاین انسان پرداختهاند. با فراگیر شدن ژنومیک در زندگی روزمره – از طریق آزمایشهای مستقیم به مصرفکننده، غربالگری پیش از تولد، درمانهای شخصیسازی شده سرطان و بانکهای زیستی جمعیتی – این سوالات اخلاقی دیگر مباحث نظری نیستند بلکه مسائلی فوری و عملیاند که میلیونها نفر را تحت تاثیر قرار میدهند و آینده جمعی ما را شکل میدهند.
۸.۱ رضایت آگاهانه در تحقیقات ژنومی
اصلیترین پایه اخلاق در تحقیقات پزشکی، اصل رضایت آگاهانه است؛ یعنی شرکتکنندگان باید کاملاً بدانند هدف تحقیق چیست، چه خطراتی وجود دارد، دادههایشان چگونه استفاده میشود و حق دارند هر زمان که بخواهند انصراف دهند. اما در ژنومیک این موضوع پیچیدهتر است؛ چون پیامدهای به اشتراک گذاشتن دادههای ژنتیکی بسیار گسترده، نامشخص و غیرقابل پیشبینی است.
برخلاف آزمایشهای بالینی که محدوده و زمان مشخصی دارند، دادههای ژنومی ممکن است برای تحلیلهای ثانویه، تحقیقات آینده یا به طور دائمی در پایگاههای داده به اشتراک گذاشته شوند. همچنین چون ژنها تنها متعلق به فرد نیستند بلکه با خانواده و جمعیتهای اجدادی مشترکند، رضایت تنها یک مسئله فردی نیست بلکه مسئلهای اجتماعی و جمعی است. این سوالات دشواری ایجاد میکند که آیا یک فرد میتواند واقعاً رضایت بدهد برای چیزی که روی خواهر، برادر، والدین، فرزندان یا حتی جامعهاش اثر میگذارد؟
برای حل این چالشها، مدلهایی مانند رضایت پویا طراحی شدهاند که شرکتکنندگان بتوانند ترجیحات خود را به مرور زمان تغییر دهند، و همچنین چارچوبهای تحقیق مشارکتی مبتنی بر جامعه برای کار با جمعیتهای بومی، قبیلهای یا اقلیت که تاریخچهای از سوءاستفاده در تحقیقات دارند. ارتباط شفاف، احترام به خودمختاری و تصمیمگیری مشترک برای حفظ معنیداری و اعتبار اخلاقی رضایت ضروری است.
۸.۲ حفظ حریم خصوصی، امنیت داده و مالکیت
یکی از بزرگترین چالشهای اخلاقی در ژنومیک، حفظ حریم خصوصی دادههای ژنتیکی است. این دادهها دائمی، منحصر به فرد و پر از اطلاعات شخصی و خانوادگی هستند. برخلاف دادههای پزشکی دیگر که ممکن است تغییر کنند، دادههای ژنومی ثابت است و میتواند وضعیت سلامت فعلی، خطر ابتلا به بیماریهای آینده، روابط بیولوژیکی و تبار را فاش کند.
حتی وقتی دادهها ناشناسسازی میشوند، خطر بازشناسایی افراد وجود دارد، مخصوصاً با ابزارهای پیشرفته دادهکاوی و دسترسی عمومی به بانکهای داده ژنومی. مثالهایی مثل شناسایی افراد در پروژه ۱۰۰۰ ژنوم با استفاده از دادههای شجرهای نشان داده که هیچ روش ناشناسسازی کامل نیست. بنابراین، تضمین پروتکلهای امنیت داده قوی، کنترل دسترسی به اطلاعات حساس و شفافسازی درباره خطرات، نه فقط یک ضرورت فنی، بلکه یک وظیفه اخلاقی است.
مسئله دیگر، مالکیت دادههای ژنومی است؛ اینکه چه کسی حق کنترل، دسترسی یا بهرهبرداری از ژنوم فرد را دارد – خود فرد، مؤسسه تحقیقاتی، دولت یا شرکتهای خصوصی؟ این بحث شامل سوالاتی درباره سهم در سود، حقوق مالکیت فکری و تجاریسازی اطلاعات ژنتیکی میشود، به ویژه زمانی که شرکتهای دارویی یا بیوتکنولوژی محصولات سودآوری از منابع ژنتیکی جمعیتهای عمومی یا بومی تولید میکنند. درخواست برای «حاکمیت داده» توسط گروههای بومی و قبیلهای، نشاندهنده اهمیت احترام به زمینههای فرهنگی، تاریخی و سیاسی در استخراج، ذخیره و استفاده از دادههاست.
۸.۳ تبعیض و انگزنی ژنتیکی
با گستردهتر شدن آزمایشهای ژنتیکی، نگرانیها درباره تبعیض ژنتیکی – یعنی رفتار ناعادلانه بر اساس استعداد ژنتیکی برای بیماری یا ناتوانی – افزایش یافته است. این نگرانیها مخصوصاً در زمینههایی مثل استخدام، بیمه، مهاجرت و آموزش دیده میشود، جایی که افراد ممکن است بر اساس پیشبینیهای احتمالاتی DNA خود قضاوت شوند نه وضعیت واقعی سلامتشان.
در پاسخ، چند کشور قوانین ضد تبعیض ژنتیکی تصویب کردهاند. مثلاً در آمریکا، قانون GINA در سال ۲۰۰۸ تصویب شد تا از استفاده شرکتهای بیمه سلامت و کارفرمایان از اطلاعات ژنتیکی جلوگیری کند. اما این قانون محدودیتهایی دارد و بسیاری از کشورها هنوز چارچوبهای قانونی قوی ندارند.
فراتر از تبعیض رسمی، خطر انگزنی اجتماعی هم وجود دارد، جایی که افراد یا جمعیتها به خاطر نتایج تحقیقات ژنتیکی ممکن است کلیشهسازی یا حاشیهنشین شوند. برای مثال، یافتههای درباره تفاوتهای ژنتیکی بین گروههای قومی میتواند اشتباه تفسیر شود یا سوء استفاده شود تا سلسله مراتب نژادی را تقویت کند یا سیاستهای تبعیضآمیز را توجیه نماید. این مسئله مسئولیت اخلاقی دانشمندان، خبرنگاران و سیاستگذاران را برجسته میکند که نتایج ژنتیکی را با توجه به زمینه و به دور از تفاسیر قطعی گزارش دهند و روی اشتراکات ژنتیکی انسانها تأکید کنند نه تفاوتهای کماهمیت.
۸.۴ بازگرداندن نتایج ژنومی به شرکتکنندگان
یکی از بحثبرانگیزترین مسائل اخلاقی در ژنومیک، اینکه آیا، چه زمانی و چگونه باید نتایج به شرکتکنندگان داده شود، است. از یک سو، افراد مایلند بدانند آیا ژنومشان اطلاعاتی درباره بیماریهای قابل درمان، ریسکهای دارویی یا سندرمهای سرطانی ارثی دارد یا نه. از سوی دیگر، همه یافتههای ژنومی قابل اقدام پزشکی نیستند و اطلاع دادن درباره نتایج نامطمئن یا پیچیده ممکن است باعث سردرگمی، اضطراب یا اطمینان کاذب شود.
اتفاق نظر رو به افزایش است که یافتههای قابل اقدام بالینی، به خصوص آنهایی که توسط نهادهایی مثل کالج پزشکی ژنتیک آمریکا (ACMG) تعیین شدهاند، باید به شرکتکنندگان ارائه شود و همراه با حمایت مشاوران ژنتیکی باشد. اما درباره یافتههای جانبی یا ثانویه، یا نتایجی که مربوط به بیماریهای بزرگسالی در کودکان، ریسکهای تولید مثلی یا اطلاعات تبار هستند، توافق کامل وجود ندارد.
این چالش با نابرابریهای دسترسی به مشاوره ژنتیکی و مراقبتهای پس از آن تشدید میشود و ممکن است نابرابریهای سلامت را افزایش دهد اگر تنها برخی شرکتکنندگان بتوانند از اطلاعات بهرهمند شوند. بنابراین، هر سیاستی در بازگرداندن نتایج باید همراه با تعهد به آموزش سلامت، دسترسی برابر و احترام به ارزشها و ترجیحات مختلف باشد.
۸.۵ ویرایش ژرملاین و بهبود انسانی
شاید هیچ موضوعی در ژنومیک به اندازه ویرایش ژرملاین انسانی (تغییرات ژنتیکی که به نسلهای بعد منتقل میشود) بحثبرانگیز نباشد. تکنولوژیهایی مثل CRISPR-Cas9 امکان پیشگیری از بیماریهای ژنتیکی را فراهم میکنند اما نگرانیهای عمیقی درباره ایمنی، رضایت، عدالت و احتمال سوء استفاده برای اهداف غیر درمانی ایجاد کردهاند.
مثال بارز، مورد دانشمند چینی است که در ۲۰۱۸ تولد دو قلوی ویرایش شده ژنومی را اعلام کرد تا مقاومت در برابر HIV را ایجاد کند. این اقدام توسط جامعه علمی بینالمللی به عنوان زودهنگام، غیرمسئولانه و غیراخلاقی محکوم شد و منجر به بحثهای تازه درباره نظارت جهانی و ممنوعیت موقت ویرایش ژرملاین شد.
سؤال اصلی این است که آیا مزایای بالقوه مانند پیشگیری از بیماریهای ارثی فاجعهبار، خطرات ناشناخته مثل اثرات ناخواسته، پیامدهای چند نسلی و نابرابریهای اجتماعی را توجیه میکند یا خیر. حتی اگر این فناوریها ایمن و موثر شوند، ممکن است باعث ایجاد طبقهبندی ژنتیکی جدید شود که افراد دارای دسترسی به فناوریهای بهبود، مزایای جسمی، ذهنی یا ظاهری را به نسلهای بعد منتقل کنند و شکافهای اجتماعی را عمیقتر کنند.
یکی از اصول اخلاقی کلیدی، تمایز بین درمان و بهبود است، یعنی تفاوت میان پیشگیری از آسیب و دنبال کردن کمال. این خط مرز در عمل دشوار و فرهنگی متفاوت است، اما برای اطمینان از اینکه علم به کرامت انسانی خدمت میکند نه اینکه آن را تهدید کند، ضروری است.
۸.۶ ژنومیک و حقوق بومیان
تحقیقات ژنومی که شامل مردم بومی میشود نیازمند ملاحظات اخلاقی ویژه است که بر پایه احترام به حاکمیت، سنتهای فرهنگی و تاریخ استعمار و استثمار قرار دارد. جوامع بومی اغلب بدون رضایت، بدون بهره و بدون به رسمیت شناختن دانش یا وضعیت سیاسی خود، موضوع تحقیقات بودهاند. این سابقه منجر به بیاعتمادی عمیق و در برخی موارد ممنوعیت رسمی تحقیقات ژنتیکی شده است.
در سالهای اخیر، چارچوبهای اخلاقی مانند CARE (منفعت جمعی، اختیار کنترل، مسئولیت، اخلاق) و OCAP (مالکیت، کنترل، دسترسی و تصاحب) برای هدایت تعامل محترمانه با ژنومیک بومیان پدید آمدهاند. این اصول تأکید میکنند که دادههای به دست آمده از افراد و جوامع بومی باید توسط خود آنها مدیریت شود، شفاف به اشتراک گذاشته شود و در جهت رفاه آنها استفاده گردد.
پروژههایی مانند Silent Genomes در کانادا و Te Mana Raraunga در نیوزیلند نشان دادهاند که میتوان با مشارکت جوامع بومی، تحقیقات ژنومی با کیفیت انجام داد، به شرطی که از ابتدا جوامع دخیل باشند، ساختارهای حکومتی روشن باشد و منافع متقابل در اولویت قرار گیرد.
نتیجهگیری: ژنومیک در جامعهای عادلانه و فراگیر
مسائل اخلاقی، حقوقی و اجتماعی در ژنومیک نه حاشیهای بلکه مرکزیترین بخش مشروعیت، تأثیر و آینده آن هستند. اگر ژنومیک قرار است به وعدهاش برای بهبود سلامت، فهم زیستشناسی انسان و پیشرفت علم عمل کند، باید به گونهای باشد که حقوق بشر را محترم شمرده، از جمعیتهای آسیبپذیر محافظت کند، دسترسی برابر را تضمین نماید و اعتماد عمومی را ایجاد کند.
این امر نیازمند گفتگوی مستمر بین دانشمندان، اخلاقشناسان، سیاستگذاران و جوامع، همراه با تعهد به شفافیت، پاسخگویی و تواضع است. هدف فقط جلوگیری از آسیب نیست بلکه ساختن آیندهای ژنومی است که فراگیر، مسئولانه و عمیقاً متاثر از ارزشهای جوامعی باشد که برای خدمت به آنها طراحی شده است.
بخش ۹: ژنومیک عملکردی و زیستشناسی سامانهای
مقدمه: از توالی تا عملکرد
اگرچه تعیین توالی ژنوم انسان یک دستاورد بزرگ در تاریخ زیستشناسی بود، اما نشان داد که صرف داشتن اطلاعات توالی DNA نمیتواند پیچیدگیهای زندگی را بهطور کامل توضیح دهد. دانستن ترتیب دقیق نوکلئوتیدها در ژنوم، هرچند پایه و اساس است، اطلاعات کمی درباره اینکه چگونه ژنها تنظیم میشوند، بیان مییابند یا چگونه در فضای سلولها، بافتها و کل ارگانیسمها به صورت پویا تعامل دارند، به ما میدهد.
در این زمینه است که ژنومیک عملکردی شکل گرفت؛ نه تنها به عنوان رویکردی مکمل برای ژنومیک ساختاری بلکه به عنوان حوزهای مرکزی که بر تعیین نقشها، تنظیمها و ارتباطات ژنها و محصولات آنها در شرایط طبیعی و بیماریزا تمرکز دارد.
همزمان، زیستشناسی سامانهای یک تغییر مفهومی ایجاد کرد: از روشهای کاهشگرا که تنها روی ژنها یا پروتئینهای منفرد تمرکز داشتند، به مدلهای جامع و یکپارچهای که فرآیندهای زیستی را به عنوان شبکهای از اجزای در تعامل میبینند. زیستشناسی سامانهای بر درک این نکته تاکید دارد که چگونه اجزای مولکولی به صورت هماهنگ با هم کار میکنند تا ویژگیها و عملکردهای emergent یا نوظهور ایجاد کنند، یعنی رفتارهایی که با نگاه به هر جزء به تنهایی قابل پیشبینی نیستند. با ترکیب دادههای پرسرعت با مدلسازی محاسباتی، زیستشناسی سامانهای امکان ساخت مدلهای پیشبینیکننده از سیستمهای پیچیده زیستی را فراهم میکند و این به پیشرفت زیستشناسی پایه و کاربردهای ترجمهای در پزشکی، بیوتکنولوژی و زیستشناسی سنتتیک کمک میکند.
۹.۱ ترانسکریپتومیکس: چشمانداز پویا و بیان ژن
یکی از ارکان کلیدی ژنومیک عملکردی، ترانسکریپتومیکس است؛ مطالعه جامع تمام RNAهای تولید شده توسط ژنوم تحت شرایط، بافتها یا زمانهای مشخص. برخلاف ژنوم ایستا، ترانسکریپتوم بسیار پویا است و نشاندهنده فعالیت لحظهای ژنها است که توسط سیگنالهای محیطی، مرحلههای رشد، بیماری و درمان تنظیم میشود.
پیشرفتهای توالییابی RNA (RNA-seq) انقلابی در ترانسکریپتومیکس ایجاد کرده و به پژوهشگران اجازه میدهد تا میزان بیان ژن را با دقت تکنوکلئوتیدی بسنجند، ترانسکریپتهای جدید و انواع برشهای RNA را شناسایی کنند و RNAهای غیرکدکننده را که قبلاً در روشهای میکروآری نادیده گرفته میشدند، کشف کنند.
دادههای RNA-seq امکان ساخت پروفایلهای بیان ژن را میدهند که میتوانند انواع سلولی را تمایز دهند، زیرنوعهای تومور را طبقهبندی کنند یا پیامدهای مولکولی جهشهای ژنتیکی را آشکار سازند. مثلاً در زیستشناسی سرطان، امضای ترانسکریپتومی میتواند به عنوان نشانگرهای زیستی پیشآگهی، پیشبینی پاسخ به درمان یا کشف مسیرهای جدید سرطانزایی عمل کند. همچنین مطالعات ترانسکریپتومی سری زمانی، دیدگاههایی درباره دینامیک زمانی بیان ژن ارائه میدهند که به مدلسازی مدارهای تنظیمی و شناسایی فاکتورهای اصلی رونویسی کمک میکند. این فاکتورها نقش مهمی در تغییر وضعیتهای سلولی مانند تمایز، آپوپتوز (مرگ برنامهریزی شده سلول) یا فعالسازی سیستم ایمنی دارند.
با این حال، دادههای ترانسکریپتومی به تنهایی کافی نیستند چون میزان mRNA همیشه با سطح پروتئینها همخوانی ندارد؛ این به دلیل تنظیم پسارونویسی، کنترل ترجمه و تخریب پروتئینها است. این ناهماهنگی باعث شده تا ترانسکریپتومیکس با پروتئومیکس، اپیژنتیک و متابولومیکس ترکیب شود تا تصویر کاملتری از عملکرد سلولی ارائه شود.
۹.۲ پروتئومیکس: شناخت مجریان عملکرد
پروتئینها به عنوان عاملان اصلی عملکرد سلولی، تقریباً تمام فرآیندهای زیستی را از کاتالیز آنزیمی و انتقال سیگنال گرفته تا سازماندهی ساختاری و نظارت ایمنی انجام میدهند.
رشته پروتئومیکس تلاش میکند کل مجموعه پروتئینها (پروتئوم) در یک سلول، بافت یا ارگانیسم را شناسایی و کمّی کند، از جمله ایزوفورمها، تغییرات پساترنسلیشنال (PTMs) و شرکای تعاملی آنها.
پروتئومیکس مدرن بر پایه طیفسنجی جرمی (MS) امکان تشخیص همزمان هزاران پروتئین را فراهم میکند و بینشی بینظیر درباره میزان، مکان و وضعیتهای تغییر یافته پروتئینها ارائه میدهد. مهمتر اینکه پروتئومیکس نشان میدهد کدام پروتئینها حضور دارند و چگونه با فسفریلاسیون، استیلاسیون، یوبیکویتینهشدن و دیگر PTMها تنظیم میشوند که میتوانند عملکرد، پایداری یا شبکههای تعاملی آنها را به شدت تغییر دهند.
یکی از کاربردهای قدرتمند پروتئومیکس، نقشهبرداری تعاملات پروتئین-پروتئین است که ساختار ماژولار مسیرهای زیستی را آشکار میکند و نقاط حساس یا گلوگاههای مهم در انتقال سیگنال را شناسایی میکند. با ترکیب این دادهها با اطلاعات ترانسکریپتومیک و ژنومی، پژوهشگران میتوانند بفهمند چگونه واریانتهای ژنتیکی شبکههای پروتئینی را تحت تاثیر قرار میدهند یا چگونه جهشهای بیماری مدارهای سلولی را بازتنظیم میکنند.
هرچند پروتئومیکس چالشهایی مانند گستره وسیع میزان پروتئینها، شناسایی محدود پروتئینهای با فراوانی کم و تعیین اهمیت عملکردی تعاملات دارد، پیشرفتهای مداوم در آمادهسازی نمونه، حساسیت MS و تحلیل دادهها در حال گسترش دامنه و دقت این حوزه هستند.
۹.۳ اپیژنتیک و ساختار کروماتین
علاوه بر توالی DNA، بیان ژن و عملکرد ژنوم تحت تاثیر تغییرات اپیژنتیکی است؛ تغییرات شیمیایی قابل وراثت اما برگشتپذیر روی DNA و هیستونها که توالی نوکلئوتیدی را تغییر نمیدهند. این تغییرات شامل متیلاسیون DNA، استیلاسیون هیستون، متیلاسیون، فسفریلاسیون و بازسازی کروماتین هستند که در مجموع دسترسی ژنوم به ماشینآلات رونویسی و پروتئینهای تنظیمی را شکل میدهند.
روشهای پروفایلینگ اپیژنتیکی مانند ChIP-seq (ترکیب ایمنی کروماتین)، ATAC-seq (آزمون دسترسیپذیری کروماتین با ترانسپوزاز) و بیسولفیت توالییابی، به پژوهشگران امکان میدهند نقشهبرداری دقیق تغییرات هیستونی، محلهای اتصال فاکتورهای رونویسی، مناطق کروماتین باز و الگوهای متیلاسیون DNA را در سراسر ژنوم انجام دهند. این دادهها نشان میدهند چگونه سلولهای مختلف هویتهای منحصر به فرد رونویسی ایجاد و حفظ میکنند و چگونه وضعیتهای اپیژنتیکی نابههنجار میتوانند منجر به بیماریهایی مانند سرطان، اختلالات رشد یا تخریب عصبی شوند.
کارهای اخیر در زمینه ساختار سهبعدی ژنوم با استفاده از روشهایی مانند Hi-C نشان دادهاند که کروماتین به صورت تصادفی در هسته سلول سازماندهی نمیشود، بلکه حلقهها، حوزهها و بخشهایی دینامیک ایجاد میکند که عناصر تنظیمی دور را در نزدیکی ژنهای هدف قرار میدهد. این سازماندهی سهبعدی تاثیر زیادی بر تنظیم ژن، ارتباط عناصر افزاینده با پروموترها و تفسیر واریانتهای ژنتیکی غیرکدکننده که از اهداف عملکردی خود دور هستند، دارد.
ترکیب دادههای اپیژنتیک با ترانسکریپتومیکس و نقشههای ساختار کروماتین، چارچوبی قدرتمند برای رمزگشایی منطق cis-تنظیمی فراهم میکند و کمک میکند تا بفهمیم چگونه تصمیمگیریهای سرنوشت سلولی، گذارهای بیماری و پاسخ به محیط در نه فقط ژنوم بلکه در ساختار و زمینه شیمیایی آن کدگذاری شدهاند.
۹.۴ متابولومیکس و فیزیولوژی سلولی
در حالی که ژنومیکس، ترانسکریپتومیکس و پروتئومیکس نقشه و ماشینآلات سلول را توصیف میکنند، متابولومیکس محصولات نهایی فعالیتهای بیوشیمیایی یعنی مولکولها و متابولیتهای کوچک را بررسی میکند که وضعیت کنونی متابولیسم انرژی، تعادل اکسیداسیون-کاهش، فعالیت سیگنالینگ و خروجی بیوسنتزی سلول را منعکس میکنند.
چون متابولیتها در تقریبا تمام فرآیندهای فیزیولوژیکی نقش مستقیم دارند، سطح آنها به شدت به واریاسیون ژنتیکی، بیماری، رژیم غذایی، داروها و شرایط محیطی پاسخ میدهد.
پلتفرمهای پرسرعت مانند طیفسنجی رزونانس مغناطیسی هستهای (NMR) و طیفسنجی جرمی (MS) به پژوهشگران اجازه میدهند تا صدها تا هزاران متابولیت را در نمونههای زیستی پروفایل کنند و امضاهایی پیدا کنند که بتوانند وضعیت سلامت را از بیماری تمیز دهند، نتایج درمان را پیشبینی کنند یا اهداف دارویی جدید پیشنهاد دهند.
مثلاً، بازبرنامهریزی متابولیکی یک ویژگی بارز سرطان است و پروفایلینگ متابولومیک میتواند مسیرهای خاصی مانند گلیکولیز یا گلوتامینولیز را شناسایی کند که در سلولهای توموری تغییر کردهاند و ممکن است قابل هدفگذاری درمانی باشند.
متابولومیکس یک خروجی عملکردی حیاتی فراهم میکند که ارتباط بین ژنوتیپ و فنوتیپ را برقرار میکند و مطالعه تعاملات ژن-محیط، مانند تأثیر پلیمورفیسمهای ژنتیکی بر پاسخ فرد به مواد مغذی یا داروها را ممکن میسازد. وقتی با دادههای ژنومی، ترانسکریپتومی و پروتئومیکی ترکیب شود، متابولومیکس حلقه را در زیستشناسی سامانهای کامل میکند و پنجرهای به وضعیت فیزیولوژیکی آنی تغییرات مولکولی باز میکند.
۹.۵ زیستشناسی شبکهای و مدلسازی یکپارچه
در قلب زیستشناسی سامانهای، این مفهوم وجود دارد که عملکرد زیستی از مولکولهای منفرد ایجاد نمیشود بلکه از شبکههای پیچیدهای از ژنها، پروتئینها، RNAها، متابولیتها و عناصر تنظیمی ناشی میشود. این شبکهها میتوانند به صورت گرافهای ریاضیاتی نمایش داده شوند، که گرهها نماینده موجودیتهای مولکولی و یالها نشاندهنده تعاملات فیزیکی، تنظیمی یا عملکردی هستند.
با استفاده از استنتاج شبکه، تحلیل توپولوژیکی و مدلسازی دینامیکی، پژوهشگران تلاش میکنند اصول سازماندهی زیستی را کشف و رفتار سیستم را تحت اختلال پیشبینی کنند.
برای مثال، شبکههای تنظیم ژن ارتباط بین فاکتورهای رونویسی و ژنهای هدفشان را نشان میدهند، در حالی که شبکههای تعامل پروتئین-پروتئین ساختار مسیرهای چندپروتئینی و سیگنالینگ را آشکار میکنند. به همین ترتیب، شبکههای متابولیکی جریان سوبستراها و محصولات در واکنشهای آنزیمی را مدل میکنند و بینشهایی درباره کنترل جریان و گلوگاههای متابولیکی میدهند.
با ادغام چند لایه اومیکس مانند ترانسکریپتومیکس، پروتئومیکس و متابولومیکس در چارچوبهای یکپارچه، زیستشناسان سامانهای میتوانند مدلهای چندمقیاسی بسازند که رویدادهای مولکولی را به فنوتیپهای سلولی و نتایج ارگانیسمی پیوند میدهد. این مدلها میتوانند برای شبیهسازی پیشرفت بیماری، پیشبینی پاسخ دارویی یا راهنمایی زیستشناسی سنتتیک برای مهندسی عملکردهای زیستی جدید استفاده شوند.
دیدگاه سامانهای به شدت علتیابی خطی را به چالش میکشد و بر ظهور، تنظیم بازخورد و مقاومت به عنوان موضوعات مرکزی زیستشناسی تاکید دارد. این دیدگاه تمرکز را از هدفهای منفرد به سمت اختلالات شبکهای تغییر میدهد و راه را برای رویکردهای جامعتر در تشخیص، درمان و پزشکی دقیق هموار میکند.