تفسیر باندهای الکتروفورز
مشکلات رایج در الکتروفورز ژل DNA/RNA و روشهای رفع آن
«مشکلات رایج در الکتروفورز ژل شامل نبود نوارها، کشیدگی نوارها، وضوح ضعیف، نوارهای پخششده، نوارهای موجدار و جداسازی ضعیف نوارها هستند. این مقاله شامل راهحلهایی رایج برای رفع این مشکلات است.»
الکتروفورز ژل بومی کاربرد گستردهای در مطالعات ژنتیک مولکولی برای تجسم و تحلیل DNA یا RNA دارد. اصل عملکرد الکتروفورز ژل بر مبنای «جداسازی مولکولهای باردار بر اساس اندازه، شکل و بار آنها» است.
این تکنیک در حال حاضر به طور گسترده در مطالعات PCR، انگشتنگاری DNA، هضم با آنزیم محدودکننده، و بررسی جهشها و بیماریهای ژنتیکی استفاده میشود. با این حال، همانند PCR، دانشمندان در طول انجام الکتروفورز نیز با مشکلات متعددی روبرو میشوند.
مشکلات رایج در الکتروفورز ژل DNA و RNA و روشهای رفع آن:
-
نبود نوارها
-
نبود نوارهای نمونه
-
نوارهای کمرنگ یا ضعیف
-
نوارهای پخششده
-
نوارهای کشیده (Smear)
-
نوارهای خمیده یا لبخندی (Smiley Bands)
-
الگوهای موجدار نوارها
-
ناهنجاریهای نوار
-
باندهای متعدد و اضافی (Extra or Unexpected Bands)
-
جداسازی ضعیف نوارها
-
باقی ماندن DNA در چاهک
-
سایر مشکلات رایج در الکتروفورز ژل DNA/RNA
-
جمعبندی
نبود نوارها:
تصویر: ژلی که هیچ نواری در آن دیده نمیشود.
نبود کامل نوارها یکی از مشکلات رایجی است که افراد مبتدی هنگام انجام الکتروفورز با آن روبرو میشوند. زمانی که شخص برای اولین بار PCR یا الکتروفورز انجام میدهد، اغلب هیچ نواری مشاهده نمیکند. البته این مشکل میتواند برای افراد باتجربه هم پیش بیاید. این مشکل به دو نوع تقسیم میشود:
۱. نبود هیچ نواری (نه مارکر و نه نمونه)
۲. نبود نوار در خطوط نمونه، در حالی که نوار مارکر وجود دارد.
اکنون هر یک از این موقعیتها را بررسی میکنیم.
«نبود هیچ نواری» به این معنی است که نه نوارهای مارکر (لدر) و نه نمونهها در ژل ظاهر نمیشوند. دلایل رایج برای این وضعیت و راهحلهای آن در جدول زیر آمدهاند:
|
علت |
راهحل |
|
فراموش کردن افزودن رنگ ردیاب (Tracking Dye) |
ژل را با اتیدیوم بروماید (EtBr) با غلظت 0.5 µg/ml در بافر الکتروفورز به مدت حداقل ۲۰ دقیقه مجدداً رنگآمیزی کنید یا ژل جدیدی آماده نمایید. |
|
نوارها از ژل خارج شدهاند به دلیل اتصال اشتباه الکترودها |
بررسی کنید که الکترودها بهدرستی وصل شدهاند (قرمز به مثبت و سیاه به منفی). |
|
نمونهها به اشتباه وارد ژل شدهاند و از آن خارج شدهاند |
بررسی کنید که رنگ بارگیری (Loading Dye) قابل مشاهده باشد. |
|
نمونه از ژل خارج شده ولی الکترودها درست قرار گرفتهاند (Over-run) |
ژل را مجدداً آماده و الکتروفورز را تکرار کنید. حرکت رنگ ردیاب را به دقت دنبال کنید. |
|
احتمال بسیار کم: تخریب مارکر یا نمونهها توسط نوکلئاز در هنگام نگهداری |
مواد را در شرایط مناسب نگهداری کنید. |
|
مشکل در فرآیند PCRولی چون مارکر هم وجود ندارد، کمتر محتمل است. |
پروتکل PCR و آمادهسازی را بررسی کنید. |
نبود نوارهای نمونه:
تصویر: ژلی که فقط نوارهای مارکر دیده میشوند اما هیچ نواری از نمونهها وجود ندارد.
در این حالت، نوارهای مارکر دیده میشوند ولی هیچ نواری از نمونهها ظاهر نشده است. این حالت نسبتاً رایج است و به راحتی قابل حل میباشد.
|
علت |
راهحل |
|
تقویت (آمپیفیکیشن) ضعیف یا آمادهسازی ضعیف نمونه PCR |
پروتکل و آمادهسازی PCR خود را بررسی و تکرار کنید. |
نکته مهم: نبود نوارهای نمونه معمولاً مربوط به مشکلات PCR است و در الکتروفورز DNA ژنومی کمتر دیده میشود.
نکته خارج از چارچوب: نبود نوارها نشاندهنده شرایط نامناسب تقویت DNA است و معمولاً ناشی از دمای نامناسب Annealing میباشد. کاهش دمای Annealing میتواند یک راهحل در PCR باشد.
نوارهای کمرنگ یا ضعیف:
تصویر: ژلی با نوارهای کمرنگ یا محو.
نوارهای کمرنگ منجر به وضوح پایین ژل میشوند. این وضعیت میتواند هم در نوارهای مارکر و هم در نوارهای نمونه اتفاق بیفتد. دو سناریو قابل بررسی هستند:
-
اگر نوارهای مارکر و نمونه هر دو ضعیف هستند، مشکل از رنگ ردیاب یا اتیدیوم بروماید است.
-
اگر فقط نوارهای نمونه ضعیفاند، مشکل از آمپیفیکیشن ضعیف در PCR است.
راهحلها:
-
از اتیدیوم بروماید یا رنگ ردیاب با کیفیت و غلظت مناسب استفاده کنید.
-
ژل را مجدداً با رنگ ردیاب رنگآمیزی کنید.
-
تنظیمات نور دستگاه ژل داک (Gel Doc) را تنظیم کنید.
-
در صورت ادامه مشکل، فیلتر UV را تعویض کنید.
-
از استفاده مجدد از بافر اجتناب کنید.
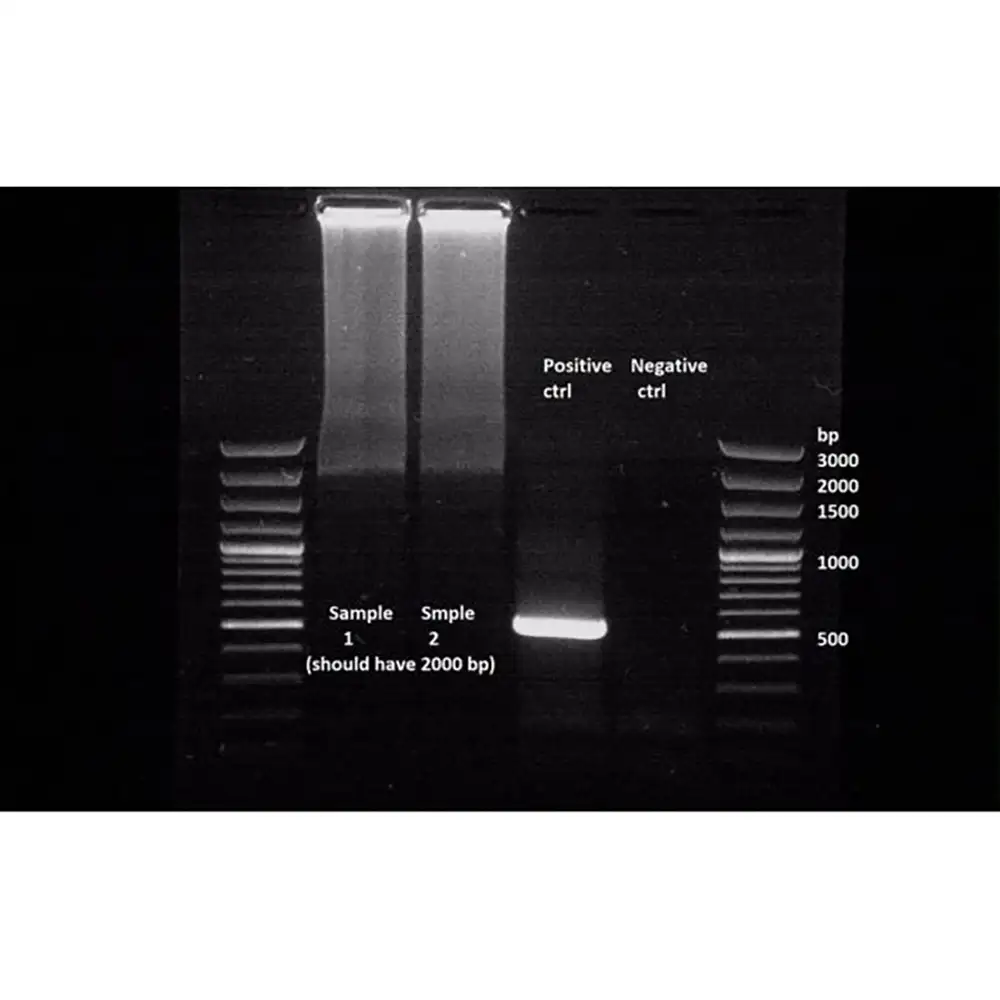
نوارهای پخششده (Diffused Bands):
تصویر: ژلی با نوارهای مبهم و پخششده.
نوارهای پخششده یا مبهم نشاندهنده پخش شدن نمونهها در حفرههای ژل است. این پدیده میتواند در اثر زمان طولانی بارگذاری نمونه یا تاخیر در تحلیل نمونهها رخ دهد.
|
علت |
راهحل |
|
آمادهسازی یا تحلیل نمونهها زمانبر بوده است |
یاد بگیرید که نمونهها را سریع بارگذاری کنید |
|
تاخیر در تحلیل ژل پس از اتمام اجرای الکتروفورز |
پیش از پایان اجرا، همه چیز را برای تحلیل آماده کرده و بلافاصله نمونهها را آنالیز کنید |
|
اجرای ژل در ولتاژ بسیار پایین |
ولتاژ مناسب بین ۵۰ تا ۸۰ ولت است |
|
گرم شدن ژل در طول اجرا |
از ولتاژ بالا پرهیز کنید و در صورت گرم شدن شدید، بافر را تعویض کنید |
|
غلظت ژل خیلی پایین بوده است |
از غلظت مناسب استفاده کنید: برای DNA ژنومی ۰.۸٪ و برای محصولات PCR، ژل ۲ تا ۳٪ استفاده کنید. |
نوارهای کشیده (Smears):
تصویر: انواع الگوهای کشیدگی نوار در ژل.
Smear یا کشیدگی نوار یکی از پیچیدهترین مشکلات برای حل کردن است. انواع مختلفی از کشیدگی دیده میشوند که هر یک دلایل خاص خود را دارند:
-
Smear دمدار (tailed): به دلیل غلظت زیاد نمونه، آلودگی با پروتئین یا غلظت بالای ژل.
-
Smear سردار (headed): ناشی از آلودگی RNA در DNA (یا بالعکس)، غلظت بالا یا تخریب DNA.
-
فعالیت نوکلئاز نیز میتواند باعث خرد شدن DNA یا RNA و ایجاد Smear شود.
-
در ژل DNA ژنومی: آلودگی زیاد، غلظت بالای DNA، و آمادهسازی نادرست ژل.
-
در هضم آنزیمی: انتخاب آنزیم اشتباه با سایتهای برش متعدد یا ژل نامناسب.
|
علت |
راهحل |
|
غلظت بالای DNA |
غلظت DNA را کاهش داده و دوباره ژل را اجرا کنید. |
|
آلودگی یا تخریب |
DNA را خالصسازی کنید. |
|
تخریب توسط نوکلئاز |
DNA/RNA را در محیط عاری از نوکلئاز نگهداری کنید. برای RNA بسیار مهم است. |
|
نوع ژل نامناسب |
از غلظت و نوع ژل مناسب استفاده کنید. |
|
پارامترهای نادرست الکتروفورز |
ولتاژ بیش از حد بالا نباشد، دمای ژل کمتر از ۳۰ درجه باقی بماند، بافر تازه و با ظرفیت بافری مناسب استفاده شود. |
|
آلودگی DNA به نمک |
DNA را با شستوشوی الکلی از نمکها پاک کنید. |
|
DNA دناتورهشده در اثر گرما |
از حرارت بالا اجتناب کنید. |
|
شکستن تصادفی DNA (مثلاً با ورتکس) |
از پروتکلهای استاندارد استخراج و نگهداری استفاده کنید. |
راهحلهای دیگر: از بافر یا ژل استفادهشده مجدداً استفاده نکنید. کشیدگی نوارها میتواند در اثر آمادهسازی نادرست ژل، وجود حباب یا شکسته شدن ژل هنگام بارگذاری نیز ایجاد شود. در نتیجه، رعایت اصول درست در تهیه ژل اهمیت زیادی دارد.
نوارهای خمیده یا هلالی (Smiley Bands):
جای تعجب نیست اگر بهعنوان یک علاقهمند به ژنتیک، بارها نوارهای خمیده در ژل دیده باشید. اگر فکر میکنید کار خاصی انجام دادهاید و میخواهید آن را به رخ بکشید، سخت در اشتباه هستید! نوارهای خمیده یکی از ناهنجاریهای رایج در الکتروفورز ژل هستند.
ویژگی معمول آنها، خمیده بودن دو سر نوارهاست. نوارهای لبخندی تفسیر نتایج را بهویژه در تستهایی مثل PCR چندگانه (Multiplex PCR) یا هضم آنزیمی که چندین نوار در یک چاهک دارند، دشوار میکنند. در جدول زیر علل رایج و راهحلها آورده شدهاند:
|
علت |
راهحل |
|
آمادهسازی نامناسب ژل (جایگذاری یا خارج کردن نادرست شانه ژل، خشک بودن چاهکها، شکسته شدن چاهکها) |
از شیوههای درست در تهیه ژل پیروی کنید. شانه ژل را بهآرامی و بدون فشار وارد یا خارج کنید. مطمئن شوید که هر چاهک با بافر پر شده است. از نظر چشمی ژل و چاهکها را برای ترک یا مشکل بررسی کنید. |
|
نوارهای لبخندی در کل ژل (چگالی نابرابر ژل یا استفاده از بافر قدیمی) |
ژل و بافر را مجدداً با مواد تازه تهیه کنید. |
الگوی نوار موجدار (Wavy Banding Pattern):
تصویر: ژلی با نوارهای DNA به شکل موجدار
گاهی ممکن است در ژل DNA خود، نوارهایی با الگوی موجدار مشاهده کنید. این حالت معمولاً در تکنیکهای انتخاب مبتنی بر مارکر مانند RAPD یا RFLP دیده میشود. بهطور کلی، چنین حالتی تفسیر نتایج را دشوار میسازد.
|
علت |
راهحل |
|
چگالی نامساوی ژل |
روشهای صحیح تهیه ژل را بیاموزید. غلظت ژل در همه بخشها (چه وسط، چه لبهها) باید یکسان باشد. |
|
توزیع نابرابر جریان الکتریسیته |
اطمینان حاصل کنید که جریان برق بهطور یکنواخت در کل ژل توزیع میشود. |
نکته:
اگر نوارهای وسط ژل سریعتر حرکت کنند، دلیل آن جریان نابرابر الکتروفورز است.
اگر نوارهای دو طرف (چپ و راست) سریعتر باشند، مشکل از چگالی نابرابر ژل است.
ناهنجاریهای نوار (Banding Anomalies):
تصویر: صفحات ژل با انواع مختلف ناهنجاریهای نوار
زمانی که نوارهای منفرد بهدرستی دیده نمیشوند، آنها در دستهی ناهنجاریهای نواری قرار میگیرند. ناهنجاریهای رایج عبارتاند از:
شکستگی در نوار، خمیدگی، کمرنگی، نوار لبخندی و لکهمانند بودن (smear) در یک نوار خاص.
|
علت |
راهحل |
|
آمادهسازی نادرست ژل (وجود حباب، استفاده مجدد، چگالی نابرابر ژل، شکستن ژل و غیره) |
روشهای صحیح و سالم برای تهیه ژل آگارز و اجرای الکتروفورز را بیاموزید. |
نوارهای اضافی (Extra Bands):
ظاهر شدن نوارهای اضافی در ژل معمولاً به آمادهسازی ژل یا فرآیند الکتروفورز مربوط نیست، بلکه دلایل اصلی آن در مرحله PCR و مشکلاتی مانند دمای Annealing نامناسب نهفته است. این موضوع در بخش خطایابی PCR بهتفصیل بررسی خواهد شد.
اگر در ژل خود نوارهای اضافی مشاهده کردید، قطعاً مشکلی در آمادهسازی PCR وجود دارد.
جداسازی ضعیف نوارها (Poor Band Separation):
یکی دیگر از مشکلات مهم در الکتروفورز اسیدهای نوکلئیک، جداسازی ضعیف نوارهاست؛ یعنی نوارها از هم بهدرستی جدا نمیشوند. این مشکل معمولاً در PCR چندگانه یا در هضم آنزیمی رخ میدهد.
جداسازی ضعیف نوارها باعث دشواری در تفسیر نتایج میشود. در ادامه علل رایج و راهحلهای پیشنهادی آمدهاند:
|
علت |
راهحل |
|
ژل را تا رسیدن کامل رنگ بارگیری (Loading dye) به انتهای ژل اجرا نکردهاید |
الکتروفورز را تا انتها ادامه دهید. |
|
اجرای آهسته الکتروفورز |
الکتروفورز را در ولتاژ بین ۵۰ تا ۸۰ ولت انجام دهید. |
|
محصولات PCR یا هضم آنزیمی بسیار نزدیک به هماند |
ژل را مدت بیشتری اجرا کنید تا امکان جداسازی بهتر قطعات فراهم شود. |
|
کاهش ظرفیت بافری |
بافر را تازه تهیه کرده و از بافرهایی با ظرفیت بافری مناسب استفاده کنید. |
باقیماندن DNA در چاهک (DNA Remains in the Well):
این مشکل کمتر در محصولات PCR دیده میشود، اما در ژلهای DNA ژنومی شایعتر است. مقداری از DNA در چاهک باقی میماند و شبیه به نوارهای smear در نزدیکی چاهک ظاهر میشود. دلایل و راهحلها در ادامه آمدهاند:
|
علت |
راهحل |
|
غلظت نامناسب ژل |
غلظت ژل را بر اساس نوع نمونه تنظیم کنید؛ برای PCR از ۲٪ و برای DNA ژنومی از ۰.۸٪ استفاده کنید. |
|
شکستن چاهک ژل |
شانه ژل را بهآرامی و درست قرار داده و خارج کنید. |
|
وجود حباب در چاهک |
در زمان تهیه ژل دقت کنید که هیچ حبابی در نزدیکی چاهکها باقی نماند. |
|
غلظت بالای DNA |
DNA را رقیق کنید یا مقدار نمونه بارگذاریشده را کاهش دهید. |
|
شرایط نامناسب تهیه ژل |
دوباره غلظت مناسب ژل را انتخاب و ژل را صحیح آماده کنید. |
سایر مشکلات رایج در الکتروفورز ژل DNA/RNA:
در پایان، به چند عامل دیگر اشاره میکنم که میتوانند باعث ایجاد ناهنجاریهای ناشناخته در طی فرآیند الکتروفورز شوند:
-
وجود نمک، پروتئین و سایر آلودگیها در نمونه
-
چگالی پایین بافر بارگیری که باعث تهنشینی ناقص DNA در چاهک میشود
-
قطع شدن برق هنگام اجرای ژل
-
استفاده از بافر نادرست برای اجرای ژل
-
تفاوت در نوع بافری که برای تهیه ژل و اجرای ژل استفاده شده
-
رنگآمیزی نابرابر ژل
-
استفاده از مارکر نامناسب
-
ناسازگاری بافر اجرای ژل
-
آلودگی نمونهها
-
استفاده مجدد از ژل
تمامی مشکلات فوق با پیروی از روشهای استاندارد استخراج DNA و تهیه صحیح ژل قابل پیشگیری و کنترل هستند.
نوارهای کمرنگ در الکتروفورز ژل
تصویر ژل حاوی نوارهای کمرنگ
شکل ۱. نوارهای کمرنگ در الکتروفورز ژل.
همانطور که از نامشان پیداست، نوارهای کمرنگ ظاهری کمرنگ، تار و غیر شفاف دارند و بهراحتی قابل مشاهده نیستند.
نوارهای کمرنگ یا حتی نبود نوار ممکن است در نتیجه آمادهسازی نادرست نمونه، غلظت پایین DNA یا RNA، شرایط نامناسب الکتروفورز یا اشکال در ژل یا بافر رخ دهد. در ادامه، توصیههایی برای به حداقل رساندن بروز نوارهای کمرنگ ارائه شده است:
آمادهسازی ژل برای کاهش نوارهای کمرنگ
|
علت احتمالی |
توصیه برای پیشگیری یا کاهش نوارهای کمرنگ |
|
مقدار کم نمونه |
برای مشاهده واضح نوارها، حداقل 0.1 تا 0.2 میکروگرم DNA یا RNA در هر میلیمتر عرض چاهک ژل بارگذاری کنید. از شانههایی با چاهکهای عمیق و باریک استفاده کنید. |
|
تجزیهشدن نمونه |
از معرفهای گرید مولکولی استفاده کرده و ظروف آزمایش را از آلودگی نوکلئازی دور نگه دارید. حتماً دستکش بپوشید، از مناطق مجزا برای کار با اسیدهای نوکلئیک استفاده کرده و مراقب RNA باشید. |
|
پنهان شدن نوار توسط رنگ |
رنگهای بارگذاری (loading dyes) ممکن است در صورت نزدیکی وزن مولکولیشان با اسید نوکلئیک، نوار را پنهان کنند. به محل مهاجرت ظاهری رنگها توجه کنید، بهویژه وقتی حجم نمونه کم است. |
شرایط اجرای ژل برای کاهش نوارهای کمرنگ
|
علت احتمالی |
توصیه |
|
بیش از حد اجرا شدن ژل |
مدت زمان اجرای ژل و حرکت رنگهای بارگذاری را پایش کنید تا مولکولهای کوچکتر از ژل خارج نشوند. استفاده از چاهکهای عمیق و باریک توصیه میشود. |
|
اتصال معکوس الکترودها |
مطمئن شوید که الکترودها به درستی به منبع برق متصل شدهاند؛ چاهکها باید در طرف منفی باشند. |
مشاهده نوارها برای کاهش نوارهای کمرنگ
|
علت احتمالی |
توصیه |
|
حساسیت پایین رنگ |
به حساسیت رنگ فلورسانس توجه کنید. از رنگ بیشتر یا زمان رنگآمیزی طولانیتر استفاده کنید. برای اسیدهای نوکلئیک تکرشتهای از رنگهایی با تمایل بالا به این مولکولها استفاده کنید. در ژلهای ضخیم یا درصد بالا، زمان رنگآمیزی را بیشتر کنید. |
|
زمینه (بکگراند) بالای رنگ |
ژل را دیرنگ (destain) کنید یا رنگهایی با فلورسانس ذاتی کم انتخاب کنید. |
|
رنگآمیزی ناهماهنگ |
در رنگآمیزی درونژلی، رنگ را کاملاً در آگارز مخلوط کرده و از ایجاد حباب جلوگیری کنید. در رنگآمیزی پس از اجرای ژل، ژل را کاملاً در محلول رنگ قرار داده و با تکان ملایم رنگآمیزی کنید. |
|
منبع نور نامناسب |
طولموج تحریک رنگ را بررسی کرده و مطمئن شوید منبع نوری با آن مطابقت دارد. |
نوارهای پخش یا "اسمیر"
نوارهای پخششده یا تار (smeared bands) ظاهر مهآلود و تار دارند (شکل ۲). این نوارها به خوبی تفکیک نشده و ممکن است با نوارهای مجاور همپوشانی داشته باشند، که تفسیر نتایج را دشوار میکند.
تصویر ژل با نوارهای پخششده
شکل ۲. نوارهای پخششده در الکتروفورز ژل.
آمادهسازی ژل برای جلوگیری از پخششدگی
|
علت احتمالی |
راهکار پیشنهادی |
|
ژل ضخیم |
ضخامت ژل را در حد ۳ تا ۴ میلیمتر نگه دارید؛ ژلهای ضخیمتر از ۵ میلیمتر منجر به پخششدگی نوارها میشوند. |
|
چاهکهای بدفرم |
از شانههای تمیز استفاده کرده و شانه را تا انتهای ژل فشار ندهید. پس از سفت شدن ژل، شانه را با دقت و بهآرامی بردارید. از پر کردن بیش از حد سینی ژل خودداری کنید. |
|
ژل نامناسب |
برای RNA یا سایر اسیدهای نوکلئیک تکرشتهای، ژل دناتورهکننده تهیه کنید. از ژل دناتورهکننده برای DNA دورشتهای استفاده نکنید. |
آمادهسازی نمونه برای جلوگیری از اسمیر
|
علت احتمالی |
راهکار پیشنهادی |
|
بارگذاری بیش از حد نمونه |
0.1 تا 0.2 میکروگرم نمونه در هر میلیمتر عرض چاهک توصیه میشود. نوارهای کشیده، قوسدار یا ادغامشده نشانه بارگذاری زیاد هستند. |
|
تجزیهشدن نمونه |
از معرفهای خالص و ظروف بدون نوکلئاز استفاده کنید. |
|
نمونه در بافر پرنمک |
در صورت امکان، نمونه را با آب بدون نوکلئاز رقیق کرده یا قبل از افزودن رنگ، نمونه را خالصسازی یا رسوبدهی کنید. |
|
وجود پروتئین زیاد |
پروتئینها ممکن است حرکت نمونه را مختل کنند. پروتئین را حذف یا با SDS و حرارتدهی دناتوره کنید. |
|
بافر بارگذاری ناسازگار |
برای RNA از رنگهای حاوی دناتورانت استفاده کرده و نمونه را حرارت دهید. برای DNA دورشتهای، از رنگهای فاقد دناتورانت استفاده کنید و نمونه را گرم نکنید. |
اجرای ژل برای جلوگیری از اسمیر
|
علت احتمالی |
راهکار پیشنهادی |
|
وجود حباب در چاهک |
هنگام بارگذاری نمونه، از تشکیل حباب در چاهک جلوگیری کنید. |
|
آسیبدیدگی چاهک |
نوک سمپلر را به چاهک فشار ندهید. |
|
باقیمانده آکریلآمید یا اوره |
در ژل پلیآکریلآمید، چاهکها را قبل از بارگذاری شستوشو دهید. |
|
ولتاژ خیلی کم یا زیاد |
ولتاژ مناسب با نوع نمونه و بافر انتخاب شود. |
|
زمان اجرای خیلی کوتاه یا طولانی |
زمان اجرای کافی ولی نه بیش از حد باشد. اجرای طولانی باعث تولید حرارت، دناتوره شدن نمونه و پخش نوارها میشود. |
|
بافر ناسازگار |
از بافری با ظرفیت بافری مناسب استفاده کنید، بهویژه برای الکتروفورز طولانیتر از ۲ ساعت. |
جداسازی ضعیف نوارها
تصویر ژل با نوارهای بههمچسبیده
شکل ۳. نوارهایی با جداسازی ضعیف.
نوارهای با جداسازی ضعیف نزدیک به هم قرار گرفته و تشخیص آنها دشوار است. در ادامه راهکارهای رفع این مشکل ذکر شده است.
آمادهسازی ژل برای جداسازی بهتر
|
علت احتمالی |
راهکار پیشنهادی |
|
درصد نامناسب ژل |
برای قطعات کوچکتر، از ژل با درصد بالاتر استفاده کنید. پس از جوشاندن آگارز، حجم را با آب تنظیم کنید تا از غلیظ شدن ژل جلوگیری شود. |
|
انتخاب نامناسب نوع ژل |
برای قطعات کوچکتر از ۱۰۰۰ جفتباز، ژل پلیآکریلآمید انتخاب بهتری است. |
|
چاهکهای بدفرم |
نکات ذکرشده در بخش نوارهای پخششده درباره چاهکها در اینجا هم صادق است. |
|
ژل نامناسب |
برای RNA از ژل دناتورهکننده و برای DNA از ژل غیردناتوره استفاده کنید. |
آمادهسازی نمونه برای جداسازی بهتر
|
علت احتمالی |
راهکار پیشنهادی |
|
بارگذاری بیش از حد نمونه |
توصیه مشابه قبل: حداکثر 0.2 میکروگرم نمونه در هر میلیمتر عرض چاهک. |
|
پروتئین زیاد |
با دناتوره کردن یا حذف پروتئین، مزاحمت در حرکت DNA کاهش مییابد. |
|
بافر بارگذاری ناسازگار |
مشابه قبل، برای RNA از دناتورانت و برای DNA از بافر بدون دناتورانت استفاده کنید. |
|
حجم کم نمونه |
حجم نمونه باید حداقل ۳۰٪ از حجم چاهک را پر کند تا نوار شکل صحیحی داشته باشد. |
اجرای ژل برای جداسازی بهتر
|
علت احتمالی |
راهکار پیشنهادی |
|
حباب یا آسیب در چاهک |
حباب ایجاد نکنید و چاهک را سوراخ نکنید. |
|
باقیمانده آکریلآمید یا اوره در چاهکها |
قبل از بارگذاری، آنها را شستوشو دهید. |
|
ولتاژ نامناسب |
بسته به اندازه قطعه DNA و نوع بافر، ولتاژ را تنظیم کنید. |
|
زمان اجرای نامناسب |
ژل را نه خیلی کوتاه و نه خیلی طولانی اجرا کنید. اجرای طولانی ممکن است باعث پخششدگی نوارها شود. |
|
بافر ناسازگار |
بافر متناسب انتخاب شود: |
- TAE برای قطعات بزرگتر از ۱۵۰۰ جفتباز و اجرای کوتاه مناسبتر است.
- TBE برای قطعات کوتاهتر از ۵۰۰۰ جفتباز ترجیح داده میشود.
- برای اجرای طولانی از بافر با ظرفیت بالای بافری استفاده شود. |
جداسازی یا مهاجرت غیرعادی (نوارهای "لبخندزن")
نوارهایی که بهطور غیرطبیعی خم میشوند یا الگوی مهاجرت غیرمنتظره دارند، مانند نوارهای "لبخندزن" در ژل دیده میشوند (شکل ۴).
علت اصلی این پدیده توزیع نابرابر حرارت یا میدان الکتریکی در عرض ژل است.
آمادهسازی ژل برای کاهش مهاجرت غیرطبیعی (anomalous migration)
توصیههایی برای آمادهسازی ژل به منظور کاهش مهاجرت غیرعادی نوارها در الکتروفورز ژل
|
علت احتمالی جداسازی غیرطبیعی نوارها |
توصیه برای کاهش مهاجرت غیرعادی |
|
غلظت غیر یکنواخت ژل |
هنگام آمادهسازی ژل، محلول آگارز را کاملاً مخلوط کنید. بعد از جوشاندن، نباید هیچ پودر حلنشده یا جامد ذوبنشدهای باقی بماند. |
|
ژل ناهموار یا چاهکهای مورب |
هنگام ریختن ژل و قرار دادن شانه، سینی ژل را روی سطح کاملاً صاف قرار دهید. شانه باید به صورت عمودی، عمود بر سطح ژل، موازی با لبه بالایی ژل و در طول فرآیند جامد شدن کاملاً ثابت باشد. |
|
بافر نادرست ژل |
مطمئن شوید که ژل با همان بافری تهیه شده که قرار است برای اجرای ژل نیز استفاده شود. استفاده از بافرهای متفاوت ممکن است باعث مهاجرت نادرست نمونهها شود. |
آمادهسازی نمونه برای کاهش مهاجرت غیرطبیعی
|
علتهای احتمالی |
توصیه برای کاهش مهاجرت غیرطبیعی |
|
نمونه دارای ساختارهای متفاوت |
انواع مختلف ساختار DNA پلاسمیدی مانند سوپرکویل، خطی، ریلکس یا شکسته دارای سرعت مهاجرت متفاوتی در ژل هستند. برای الکتروفورز پلاسمیدها، از افزودن بیش از حد رنگهای بینابینی (intercalating dyes) خودداری کنید، چون ممکن است ساختار آنها را تغییر دهد. برای حفظ حالت تکرشتهای RNA، از بافر حاوی دناتورانت استفاده کرده و قبل از بارگذاری نمونه را حرارت دهید. |
|
نمونه دارای توالیهای غیرمعمول |
DNA غنی از آدنین و تیمین (AT-rich) ممکن است در الکتروفورز با وضوح بالا کندتر مهاجرت کند. DNA خمیده (curved DNA) که هر حدود 10 باز، حاوی توالیهای تکراری آدنین (4–6 عدد) است، در ژل پلیآکریلآمید به شکل غیرطبیعی مهاجرت میکند. DNAهای تغییر یافته، مانند DNAهای متیله یا دارای نشانههای بزرگ فلورسانس یا بیوتین، نسبت به DNA طبیعی با همان اندازه جفتباز کندتر مهاجرت میکنند. |
|
نمونه با انتهای چسبنده |
برای جلوگیری از برهمکنش انتهای مکمل طولانی اسیدهای نوکلئیک و تشکیل concatemer، از بافر بارگذاری حاوی SDS استفاده کرده و نمونه را حرارت دهید. |
|
نمونه حاوی پروتئین متصل به اسید نوکلئیک |
برای جدا کردن پروتئینهایی که به DNA یا RNA متصل شدهاند (مثلاً بعد از هضم با آنزیم محدودکننده یا واکنش لیگیشن)، از SDS و حرارت استفاده کنید. |
اجرای ژل برای کاهش مهاجرت غیرطبیعی
|
علتهای احتمالی |
توصیه برای کاهش مهاجرت غیرطبیعی |
|
بافر ناسازگار برای اجرای ژل |
اطمینان حاصل کنید که بافر اجرای ژل با بافر ساخت ژل مطابقت دارد. مثلاً: |
-
بافر TAE برای جداسازی قطعات بزرگتر از ۱۵۰۰ جفتباز در مدت کوتاه مناسبتر است.
-
بافر TBE برای قطعات کوچکتر از ۵۰۰۰ جفتباز مناسبتر است ولی ممکن است مهاجرت DNA خطی را کندتر کند.
-
برای اجرای طولانی (بیش از دو ساعت)، از بافرهایی با ظرفیت بافری بالا استفاده کنید. |
| ولتاژ خیلی بالا | استفاده از ولتاژ بیش از حد توصیهشده باعث تولید حرارت زیاد، دناتوره شدن نمونهها و ایجاد نوارهای خمیده (smiling bands) میشود. |
تولید حرارت زیاد: برای جلوگیری از گرمای بیش از حد:
-
از بافر با ظرفیت بافری بالا استفاده کنید.
-
در صورت اجرای طولانی، بافر را بچرخانید یا تعویض کنید.
-
از سیستم خنککننده برای دستگاه ژل استفاده کنید.
-
ولتاژ را کاهش دهید یا جریان/توان را روی آمپراژ ثابت تنظیم نمایید. |
مشاهده نمونه برای کاهش مهاجرت غیرطبیعی
|
علت احتمالی |
توصیه |
|
اتصال رنگ به نمونه |
در صورت استفاده از رنگهای فلورسانس بزرگ، پیشنهاد میشود بعد از اجرای ژل رنگآمیزی انجام شود، زیرا اتصال رنگ به اسید نوکلئیک ممکن است حرکت آن را در حین الکتروفورز تغییر دهد. |
دادههای نادرست کمی (Quantitation)
Quantitation به معنای برآورد غلظت اسید نوکلئیک با استفاده از ژل الکتروفورز است. خطاهای رایج در کمیسازی معمولاً ناشی از استفاده از ladder نامناسب یا استفاده از رنگهای بارگذاری متفاوت در ladder و نمونه است.
آمادهسازی نمونه برای کاهش خطا در کمیسازی
|
علت احتمالی |
توصیه |
|
لدر نادرست |
از ladderهای مخصوص Quantitation استفاده کنید که حاوی باندهایی با مقادیر مشخص DNA هستند. |
|
استفاده از رنگهای متفاوت در لدر و نمونه |
برای دستیابی به دادههای کمی قابل اطمینان، از یک نوع رنگ بارگذاری برای نمونه و ladder استفاده شود. |
مشاهده نمونه برای کاهش خطا در کمیسازی
|
علت احتمالی |
توصیه |
|
انتخاب نادرست باند در ladder |
باند مورد نظر نمونه را با باندی با اندازه مشابه در ladder کمی مقایسه کنید تا دقت افزایش یابد. |
|
اندازهگیری نادرست شدت باند |
برای دقت بیشتر، مقدار بکگراند ژل را از شدت اندازهگیریشده باند کم کنید. اگر نرمافزار دستگاه تصویربرداری ژل دارای ابزار اندازهگیری کمی است، از آن استفاده کنید. |
|
رنگآمیزی ناهماهنگ |
اطمینان حاصل کنید که رنگ فلورسانس در کل ژل یا محلول رنگآمیزی به خوبی مخلوط شده است. ژل باید کاملاً در محلول رنگ غوطهور شود. در ژلهای ضخیم یا با درصد بالا، زمان رنگآمیزی را طولانیتر کنید تا رنگ به خوبی نفوذ کند. همچنین میتوان از رنگهایی با سرعت نفوذ بالاتر استفاده کرد. در ژلهای دناتورهکننده، ژل را بشویید تا دناتورانتهایی که باعث کاهش فلورسانس میشوند، حذف شوند. یا از رنگهایی مقاوم در برابر دناتورانتها استفاده کنید. |
سایر مشکلات در الکتروفورز
علاوه بر موارد بالا، مشکلات دیگر نظیر باقی ماندن نمونه در چاهک، شناور شدن نمونه، و نقاط نورانی پراکنده (speckles) نیز ممکن است رخ دهد.
باقی ماندن نمونه در چاهک ژل
|
علت احتمالی |
راهکار پیشنهادی |
|
بارگذاری بیش از حد نمونه |
مقدار نمونه را در حد 0.1 تا 0.2 میکروگرم در هر میلیمتر عرض چاهک نگه دارید. |
|
وجود پروتئین یا بقایای سلولی در نمونه |
آلودگیهای پروتئینی یا سلولی ممکن است حرکت اسید نوکلئیک را کند کنند. نمونه را خالصسازی کرده یا با استفاده از SDS و حرارت، پروتئینها را دناتوره نمایید. |
|
عدم تأمین جریان برق |
بررسی کنید منبع تغذیه روشن، متصل و سالم باشد. در آغاز الکتروفورز، وجود حباب اطراف الکترودها نشاندهنده جریان الکتریکی است. |
|
بافر ناسازگار یا ناقص |
بافر باید به درستی تهیه شده، رسانا و با ژل هماهنگ باشد. |
جلوگیری از جهشهای توالی بعد از الکتروفورز
|
علت احتمالی |
راهکار پیشنهادی |
|
آسیب ناشی از نور UV |
تماس DNA با نور UV را به حداقل برسانید. از طولموجهای بلندتر مانند 360 نانومتر استفاده کنید. یا از رنگهایی با تحریک در طولموجهای کمتر آسیبزا بهره ببرید. در صورت امکان، از نور بالایی (epi-illumination) بهجای نور از زیر (transillumination) استفاده کنید. |
شناور شدن نمونه بعد از بارگذاری
|
علت احتمالی |
راهکار پیشنهادی |
|
بافر بارگذاری بدون ماده چگال |
مطمئن شوید بافر بارگذاری دارای مادهای مانند گلیسرول یا ساکارز است که چگالی آن را افزایش داده و باعث فرو رفتن نمونه در چاهک میشود. |
|
نمونه در محلول ناسازگار |
نمونه را خالصسازی کرده یا در آب بدون نوکلئاز بازتعلیق کنید. وجود اتانول یا حلالهای استخراج ممکن است از فرورفتن نمونه جلوگیری کند. |
نقاط فلورسانس پراکنده در ژل (Speckles)
|
علت احتمالی |
راهکار پیشنهادی |
|
آلودگیهای فلورسانت |
گرد و غبار یا میکروارگانیسمها ممکن است فلورسانس تولید کنند. از معرفهای گرید مولکولی و ظروف تمیز و مخصوص استفاده کنید. |
جمعبندی:
الکتروفورز، پایه بسیاری از کاربردهای زیستمولکولی است. بنابراین، بروز مشکلات در الکتروفورز ژل اسید نوکلئیک میتواند فرایندهای پاییندستی آزمایش را مختل کرده و روند کلی آزمایش را با اختلال مواجه کند؛ در واقع، اشتباهات در انجام الکتروفورز اغلب به نتایج منفی در آزمایش منجر میشود.




