فسفریلاسیون اکسیداتیو در میتوکندری؛ چگونه ATP تولید میشود؟
مقدمهای بر فسفریلاسیون اکسیداتیو
فسفریلاسیون اکسیداتیو (Oxidative Phosphorylation یا OXPHOS) یکی از حیاتیترین فرآیندهای بیوشیمیایی در بدن موجودات زنده است. این مسیر متابولیکی که در میتوکندری – معروف به "نیروگاه سلول" – رخ میدهد، عامل اصلی تولید انرژی سلولی به شکل آدنوزین تریفسفات (ATP) محسوب میشود. بدون ATP، سلولها توان انجام هیچیک از فعالیتهای ضروری مانند رشد، ترمیم، تقسیم و حتی حفظ پایداری خود را ندارند. در واقع، ATP واحد پول انرژی زیستی است و OXPHOS به عنوان کارخانه چاپ این ارز عمل میکند.
در دنیای زیستشناسی سلولی، انرژی همواره در مرکز توجه قرار دارد. بدن انسان برای انجام تمام اعمال حیاتی خود، از انقباض عضلانی گرفته تا انتقال پیامهای عصبی و ساخت پروتئین، به ATP نیاز دارد. اما سوال کلیدی این است: چگونه ATP در سلولها تولید میشود؟ و چرا فسفریلاسیون اکسیداتیو نسبت به سایر مسیرهای تولید انرژی مثل گلیکولیز، از اهمیت بالاتری برخوردار است؟
فرآیند فسفریلاسیون اکسیداتیو شامل یک زنجیره پیچیده از واکنشهای شیمیایی است که به کمک آن، الکترونها از مولکولهای حامل انرژی (مانند NADH و FADH2) به اکسیژن منتقل میشوند. این انتقال انرژی منجر به ایجاد یک شیب پروتونی در غشای داخلی میتوکندری میشود. در مرحله بعد، این شیب پروتونی نیروی محرکهای فراهم میآورد تا آنزیم ATP سنتاز (ATP Synthase) بتواند مولکول ADP را به ATP تبدیل کند.
مفهوم فسفریلاسیون اکسیداتیو به شکلی انقلابی در دهه ۱۹۶۰ میلادی توسط پیتر میچل (Peter Mitchell) با ارائه نظریه شیمیاسمزی توضیح داده شد؛ وی برای این نظریه جایزه نوبل شیمی را دریافت کرد. از آن زمان تاکنون، تحقیقات گستردهای در مورد نقش این مسیر در سلامت و بیماری، خصوصاً در زمینههایی مانند سرطان، پیری، التهاب، اختلالات نورودژنراتیو و حتی عملکرد گیاهان انجام شده است.
یکی از ویژگیهای منحصر به فرد فسفریلاسیون اکسیداتیو، بازدهی بالای آن در مقایسه با مسیرهای جایگزین مانند گلیکولیز است. در حالی که گلیکولیز تنها ۲ مولکول ATP به ازای هر گلوکز تولید میکند، فسفریلاسیون اکسیداتیو میتواند تا ۳۴ مولکول ATP تولید نماید. به همین دلیل، OXPHOS به عنوان یک سیستم فوقالعاده مؤثر در تأمین انرژی سلولی شناخته میشود.
با این حال، اهمیت فسفریلاسیون اکسیداتیو تنها به تولید ATP محدود نمیشود. مطالعات جدید نشان دادهاند که این مسیر نقشهای گستردهای در تنظیم آپوپتوز (مرگ برنامهریزی شده سلول)، متابولیسم اسیدهای آمینه، پاسخ ایمنی، تولید گونههای فعال اکسیژن (ROS) و حتی تنظیم بیان ژن دارد. این گستردگی عملکرد، فسفریلاسیون اکسیداتیو را به یک موضوع جذاب و کلیدی برای پژوهشگران در زمینههای پزشکی، سلولی و بیوشیمی تبدیل کرده است.
در این مقاله، به شکلی جامع و علمی به بررسی جزئیات فسفریلاسیون اکسیداتیو خواهیم پرداخت. هدف ما آن است که با نگاهی تخصصی، به تمام ابعاد این مسیر انرژیزا بپردازیم، عملکرد آن را در سطح سلولی و مولکولی بشکافیم، و نقش آن را در شرایط فیزیولوژیکی و پاتولوژیکی مختلف مورد تحلیل قرار دهیم. همچنین به بررسی پتانسیلهای درمانی هدفگیری OXPHOS در بیماریهای مزمن و تحلیل مکانیسمهای آن در گیاهان نیز خواهیم پرداخت.
اگر شما از متخصصین علوم زیستی، پزشکان، پژوهشگران زیستپزشکی یا علاقهمندان به بیوشیمی سلولی هستید، این مقاله میتواند برایتان پاسخی جامع به بسیاری از سوالات علمی درباره منبع اصلی انرژی در سلولهای زنده باشد.
میتوکندری: خانه قدرت سلول
میتوکندریها ساختارهای بینظیری در سلولهای یوکاریوتی هستند که اغلب با عنوان "خانه قدرت سلول" شناخته میشوند. این لقبی است که به درستی بیانگر نقش حیاتی آنها در تولید انرژی شیمیایی به صورت آدنوزین تریفسفات (ATP) از طریق فرآیند فسفریلاسیون اکسیداتیو است. در این بخش به بررسی ساختار، منشأ، عملکرد و نقش کلیدی میتوکندری در حیات سلولی میپردازیم.
منشأ تکاملی میتوکندری
نظریه اندوسیمبیوزی بیان میکند که میتوکندریها زمانی باکتریهای مستقل بودند که با سلولهای یوکاریوتی اولیه همزیستی برقرار کردند. با گذشت زمان، این همزیستی به ادغام کامل انجامید و منجر به تبدیل این باکتریها به اندامکی شد که امروزه آن را به عنوان میتوکندری میشناسیم. شواهدی از این گذشته تکاملی در ساختار حلقوی DNA میتوکندری، شباهت ریبوزومهای آن با باکتریها، و توانایی مستقل آن در تولید برخی از پروتئینها دیده میشود.
ساختار میتوکندری
میتوکندری دارای دو غشا است:
-
غشای خارجی : نسبتاً نفوذپذیر بوده و اجازه عبور مولکولهای کوچک و یونی را میدهد.
-
غشای داخلی: دارای چینخوردگیهایی به نام کریستا است که سطح تماس وسیعی را برای زنجیره انتقال الکترون فراهم میکند. این غشا تقریباً نفوذناپذیر است و حاوی پروتئینهای ضروری برای انتقال الکترون و سنتز ATP میباشد.
بین این دو غشا فضای بینغشایی و درون غشای داخلی فضای ماتریکس قرار دارد که حاوی آنزیمهای چرخه کربس، DNA میتوکندریایی، ریبوزومها و بسیاری از فاکتورهای متابولیکی است.
نقش میتوکندری در متابولیسم انرژی
میتوکندری مکان اصلی وقوع چرخه اسید سیتریک (چرخه کربس) و زنجیره انتقال الکترون است. این مسیرها با اکسیداسیون کامل مولکولهای سوخت (گلوکز، اسیدهای چرب و اسیدهای آمینه) منجر به تولید NADH و FADH₂ میشوند. این کوآنزیمهای احیاشده الکترونهای خود را به کمپلکسهای زنجیره انتقال الکترون در غشای داخلی میتوکندری منتقل کرده و باعث تولید ATP در مرحله نهایی میشوند.
نقشهای فراتر از تولید ATP
اگرچه تولید ATP شناختهشدهترین وظیفه میتوکندری است، اما این اندامک نقشهای بسیار بیشتری در حیات سلولی ایفا میکند:
-
تنظیم مرگ برنامهریزیشده سلول (آپوپتوز) از طریق آزادسازی سیتوکروم C.
-
تنظیم یون کلسیم به عنوان سیگنالدهنده در مسیرهای مختلف.
-
تنظیم استرس اکسیداتیو و تولید گونههای فعال اکسیژن (ROS).
-
اثرگذاری بر بیان ژنها از طریق تنظیم اپیژنتیکی و مسیرهای سیگنالدهی انرژیمحور.
بیماریهای مرتبط با اختلال عملکرد میتوکندری
هرگونه نقص در عملکرد میتوکندری میتواند زمینهساز طیف وسیعی از بیماریها باشد، از جمله:
-
بیماریهای عصبی مانند پارکینسون و آلزایمر
-
بیماریهای متابولیکی مانند دیابت نوع ۲
-
سرطانها بهویژه گلیوبلاستوما و سرطان تخمدان
-
پیری زودرس به دلیل تجمع گونههای فعال اکسیژن و آسیب به DNA
در واقع، میتوکندری یک پلتفرم مرکزی برای ادغام متابولیسم، سیگنال دهی و کنترل حیات سلولی است و شناخت عمیقتر از آن میتواند در درمان بسیاری از بیماریهای مزمن و مهلک موثر باشد.
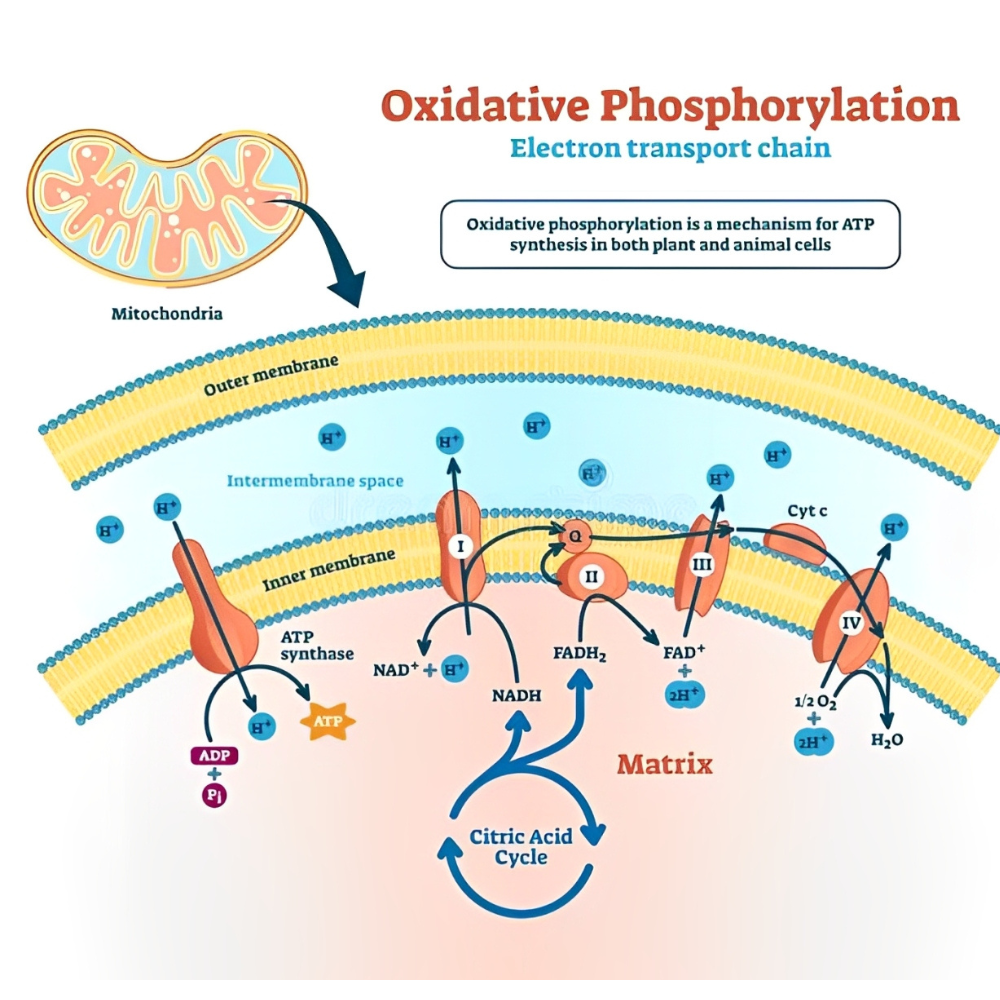
زنجیره انتقال الکترون (ETC) و نقش آن در تولید انرژی
زنجیره انتقال الکترون )Electron Transport Chain یا ETC) هسته مرکزی فرآیند فسفریلاسیون اکسیداتیو در میتوکندری است و بدون تردید یکی از پیچیدهترین و در عین حال حیاتیترین سامانههای بیوشیمیایی در بدن انسان به شمار میرود. ETC مسئول تبدیل انرژی حاصل از مواد غذایی (مانند گلوکز و اسیدهای چرب) به شکل قابل استفادهی انرژی یعنی آدنوزین تریفسفات (ATP) است. این فرآیند با استفاده از گرادیان پروتون در غشای داخلی میتوکندری و از طریق آنزیم ATP سنتاز (ATP Synthase) انجام میپذیرد.
مروری کلی بر عملکرد زنجیره انتقال الکترون
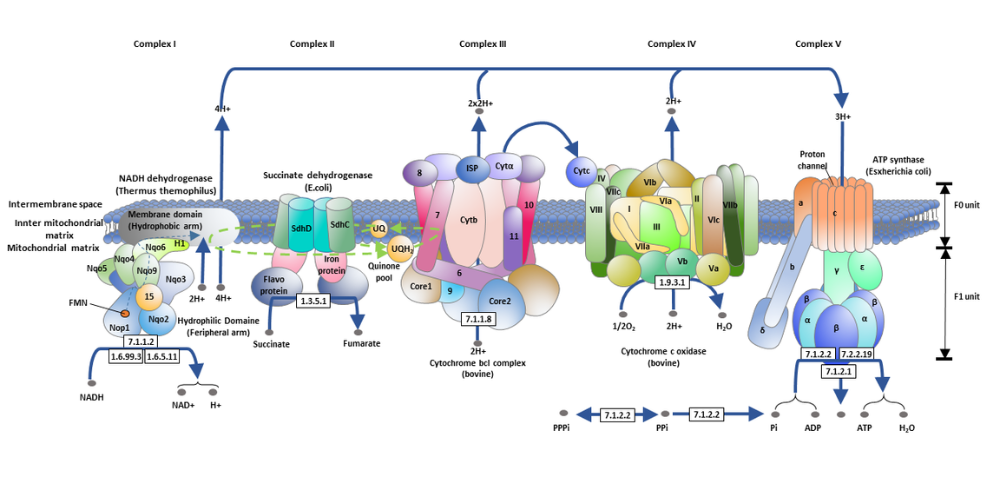
زنجیره انتقال الکترون در غشای داخلی میتوکندری مستقر شده و از چهار کمپلکس پروتئینی اصلی و دو حامل الکترونی متحرک تشکیل شده است:
-
کمپلکس I نادئید دهیدروژناز (NADH:Ubiquinone oxidoreductase)
این کمپلکس اولین دریافتکنندهی الکترونها از مولکول NADH است. با اهدای الکترونها به یوبیکینون (CoQ)، این کمپلکس چهار پروتون را از ماتریکس به فضای بینغشایی پمپ میکند. -
کمپلکس II سوکسینات دهیدروژناز (Succinate:Ubiquinone oxidoreductase)
در این کمپلکس، FADH₂ الکترونهای خود را به زنجیره انتقال میدهد. برخلاف کمپلکس I ، این کمپلکس پروتون به فضای بینغشایی پمپ نمیکند، اما در تولید ATP سهم دارد. -
یوبیکینون (Coenzyme Q or Ubiquinone)
این مولکول لیپوفیل، الکترونها را از کمپلکسهای I و II جمعآوری کرده و به کمپلکس III انتقال میدهد. -
کمپلکس III سیتوکروم bc₁ (Cytochrome bc₁ Complex)
این کمپلکس الکترونها را به سیتوکروم c منتقل کرده و همزمان چهار پروتون را به فضای بینغشایی پمپ میکند. -
سیتوکروم c
یک پروتئین کوچک محلول در فضای بینغشایی که الکترونها را به کمپلکس IV میبرد. -
کمپلکس IV سیتوکروم c اکسیداز (Cytochrome c oxidase)
این کمپلکس الکترونها را به گیرنده نهایی یعنی اکسیژن منتقل میکند. اکسیژن در این مرحله با پروتونها ترکیب شده و مولکول آب تشکیل میدهد. هم زمان، دو پروتون نیز به فضای بینغشایی پمپ میشوند.
ایجاد گرادیان پروتون و نقش آن در تولید ATP
با پمپ شدن پروتونها از ماتریکس میتوکندری به فضای بینغشایی از طریق کمپلکسهای I، III و IV، یک شیب الکتروشیمیایی (گرادیان پروتون) به وجود میآید. این گرادیان شامل دو مؤلفه است:
-
اختلاف بار الکتریکی (پتانسیل غشایی()
-
اختلاف غلظت پروتونها (pH)
این شیب انرژیزا باعث ورود پروتونها از طریق آنزیم ATP سنتاز به درون ماتریکس میشود و طی این فرآیند، انرژی گرادیان پروتون به انرژی شیمیایی ذخیرهشده در ATP تبدیل میشود. به این فرآیند، فسفریلاسیون اکسیداتیو میگویند.
اهمیت اکسیژن در عملکرد ETC
اکسیژن به عنوان گیرنده نهایی الکترونها در ETC عمل میکند. بدون حضور اکسیژن، زنجیره انتقال الکترون متوقف میشود، NADH و FADH₂ نمیتوانند به شکل اکسید شده بازگردند، و چرخه کربس نیز به دلیل نبود این کوآنزیمهای احیا نشده متوقف خواهد شد. این شرایط منجر به کاهش چشمگیر ATP و در نهایت مرگ سلول میشود.
اثربخشی و بازدهی ETC در تولید ATP
بهطور تقریبی، اکسیداسیون یک مولکول NADH در ETC منجر به تولید حدود 2.5 مولکول ATP و اکسیداسیون FADH₂ به حدود 1.5 مولکول ATP منجر میشود. بنابراین، ETC بخش اعظم ATP مورد نیاز بدن را تولید میکند. این بازده بالا، ETC را به یکی از مهمترین ابزارهای متابولیکی در پستانداران تبدیل کرده است.
اختلال در ETC و پیامدهای آن
اختلال در عملکرد هر یک از اجزای زنجیره انتقال الکترون میتواند منجر به تولید ناکافی ATP و تجمع گونههای فعال اکسیژن (ROS) شود. این وضعیت میتواند در بروز یا پیشرفت بیماریهای زیر نقش ایفا کند:
-
بیماریهای نورودژنراتیو (مثل آلزایمر و پارکینسون)
-
سرطانها بهخصوص تومورهایی که به انرژی بالا نیاز دارند (مانند گلیوبلاستوما)
-
سندرومهای میتوکندریایی مادرزادی
-
پیری زودرس و کاهش ظرفیت ترمیم سلولی
جمعبندی
زنجیره انتقال الکترون نقطهی تلاقی متابولیسم، انرژی، و سلامت سلولی است. هر اختلال در این سامانه، میتواند عواقب متعددی برای بدن انسان به همراه داشته باشد. بنابراین، شناخت دقیق آن نه تنها برای درک عملکرد سلول ضروری است، بلکه در طراحی درمانهای نوین برای بیماریهای مزمن نیز اهمیت دارد.
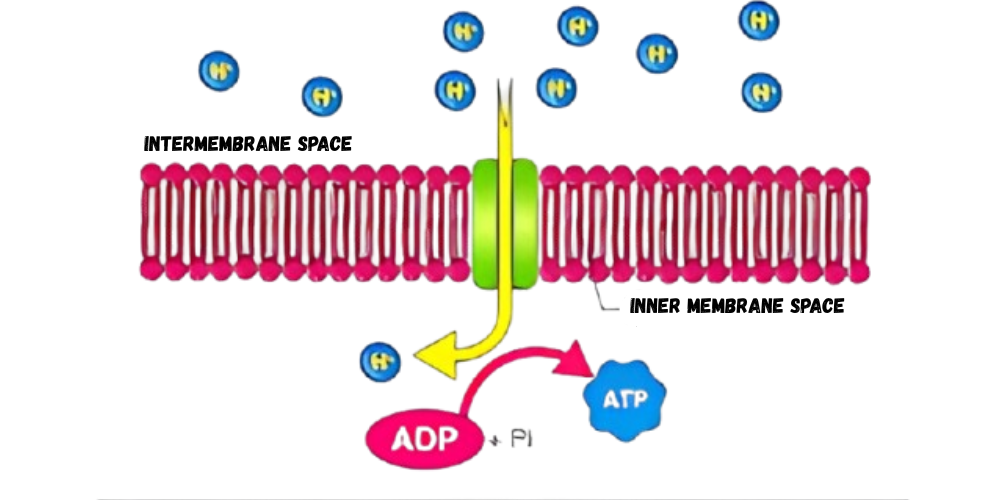
ساختار و عملکرد ATP Synthase
ATP سنتاز (یا ATPase ) آنزیمی استراتژیک در قلب فرآیند فسفریلاسیون اکسیداتیو است که وظیفه دارد گرادیان پروتون ایجاد شده توسط زنجیره انتقال الکترون (ETC) را به انرژی شیمیایی در قالب ATP تبدیل کند. این آنزیم، از نظر ساختاری و عملکردی یکی از پیشرفته ترین ماشینهای نانو مقیاس زیستی شناخته شده در علم زیست فیزیک محسوب میشود.
ساختار ATP Synthase: یک نانوماشین مولکولی
ATP سنتاز یک کمپلکس پروتئینی بزرگ و چندبخشی است که در غشای داخلی میتوکندری تعبیه شده و از دو بخش اصلی تشکیل شده است:
-
بخش F₀ (درونغشایی)
این بخش در غشای داخلی میتوکندری قرار دارد و کانالی برای عبور پروتونها فراهم میکند. F₀ متشکل از زیرواحدهای پروتئینی a ، b و حلقهای از زیرواحدهای c است. عبور پروتونها از این بخش باعث چرخش حلقه c و انتقال انرژی به بخش F₁ میشود. -
بخش F₁ (یرونغشایی یا ماتریکسی(
این بخش در ماتریکس میتوکندری قرار گرفته و متشکل از زیرواحدهای α، β، γ، δ و ε است. بخش F₁ فعالیت کاتالیزوری دارد و مسئول سنتز واقعی ATP از ADP و Pi )فسفات غیرآلی) است.
نحوه عملکرد: تبدیل انرژی گرادیان پروتون به ATP
فرآیند تولید ATP توسط ATP سنتاز در سه مرحله کلی صورت میگیرد:
-
عبور پروتونها از طریق F₀ :
پروتونهایی که در فضای بینغشایی تجمع یافتهاند، از طریق کانال F₀ به داخل ماتریکس بازمیگردند. -
ایجاد حرکت چرخشی (Rotational Catalysis) :
عبور پروتونها موجب چرخش حلقه c و محور γ در بخش F₁ میشود. این چرخش باعث تغییرات ساختاری در زیرواحدهای β میگردد. -
سنتز ATP :
در اثر چرخش محور γ، زیرواحدهای β وارد سه وضعیت ساختاری متفاوت میشوند:-
حالت باز (Open): اتصال ADP و Pi
-
حالت بسته (Tight): سنتز ATP
-
حالت آزادسازی (Loose): آزادسازی ATP سنتزشده
-
در هر چرخش کامل ATP سنتاز، سه مولکول ATP تولید میشود.
تنظیم فعالیت ATP Synthase در شرایط فیزیولوژیکی و پاتولوژیکی
ATP سنتاز تحت کنترلهای پیچیده سلولی عمل میکند. عواملی مانند نسبت ATP/ADP ، اختلاف پتانسیل غشایی، میزان اکسیژن، سطح گلوکز، و pH محیط، همگی میتوانند بر فعالیت این آنزیم تأثیر بگذارند. در شرایط کمبود اکسیژن یا استرس اکسیداتیو، فعالیت ATP سنتاز ممکن است کاهش یافته یا به طور معکوس عمل کند و باعث هدررفت ATP به جای تولید آن شود.
ATP سنتاز بهعنوان هدف دارویی
با پیشرفت تحقیقات، ATP سنتاز بهعنوان هدفی برای درمان بیماریهایی چون سرطان، عفونتها، دیابت، و بیماریهای عصبی مورد توجه قرار گرفته است. برخی ترکیبات دارویی مانند اولیگومایسین (Oligomycin) به طور اختصاصی بخش F₀ را مهار میکنند و از چرخش محور γ جلوگیری مینمایند. همچنین، مهارکنندههای جدید ATP سنتاز در درمان تومورها که وابستگی زیادی به OXPHOS دارند، در حال بررسی هستند.
ناهنجاریهای ژنتیکی مربوط به ATP Synthase
جهشهای ژنتیکی در ژنهای کد کننده زیرواحدهای ATP سنتاز میتواند منجر به بیماریهای میتوکندریایی شود. برخی از این اختلالات با کاهش تولید انرژی، ضعف عضلانی، نارسایی قلبی و نقص در رشد مغزی همراه هستند.
همولوژی و حفظ ساختار در طول تکامل
ATP سنتاز در میان ارگانیسمهای مختلف، از باکتریها تا انسان، ساختار بسیار مشابهی دارد. این حفظ ساختار طی تکامل، نشاندهنده اهمیت بالای عملکرد آن در بقاء سلولی است. حتی در گیاهان، ATP سنتاز نقش مشابهی در کلروپلاستها برای تولید ATP از نور ایفا میکند.
نتیجهگیری
ATP سنتاز، موتور نهایی تولید انرژی در بدن ماست. درک ساختار دقیق و عملکرد دینامیک این آنزیم، نه تنها کلید فهم عملکرد میتوکندری است، بلکه افقهای جدیدی برای درمان بیماریهایی که با اختلال انرژی در سطح سلولی همراه هستند، میگشاید. مهار یا تحریک این آنزیم بسته به بافت هدف، میتواند تأثیر درمانی شگرفی داشته باشد.
نظریه شیمیاسمزی (Mitchell Theory) و تکامل آن
درک مدرن ما از تولید ATP در میتوکندری بهطور بنیادی مدیون نظریه شیمیاسمزی است؛ نظریهای انقلابی که توسط پیتر میچل (Peter Mitchell) در دهه ۱۹۶۰ ارائه شد و بعدها جایزه نوبل شیمی سال ۱۹۷۸ را برای او به ارمغان آورد. این نظریه، دیدگاه قبلی که بر سنتز ATP از طریق انتقال مستقیم گروه فسفات تأکید داشت را به چالش کشید و با ارائه مدلی که به گرادیان پروتون وابسته بود، تحول عمیقی در بیوشیمی سلولی ایجاد کرد.
اصول کلیدی نظریه شیمیاسمزی
در قلب این نظریه، دو مفهوم اصلی وجود دارد:
-
ایجاد گرادیان پروتون در غشای داخلی میتوکندری
با عبور الکترونها از زنجیره انتقال الکترون (ETC)، انرژی آزاد شده برای پمپاژ فعال پروتونها (H⁺) از ماتریکس میتوکندری به فضای بینغشایی استفاده میشود. این فرآیند منجر به ایجاد یک شیب الکتروشیمیایی پروتونها در دو طرف غشای داخلی میتوکندری میشود. -
استفاده از انرژی گرادیان پروتون برای تولید ATP
بازگشت پروتونها به داخل ماتریکس، از طریق ATP سنتاز انجام میشود. انرژی آزاد شده از این حرکت "شیمیاسمزی" برای سنتز ATP از ADP و فسفات معدنی مورد استفاده قرار میگیرد.
این نظریه ساده و در عین حال قدرتمند، مدل جدیدی از تولید انرژی زیستی را تعریف کرد که کاملاً متفاوت از دیدگاههای قبلی بود.
مدارک تجربی تأییدکننده نظریه میچل
پس از ارائه این نظریه، مطالعات متعددی برای تأیید آن انجام شد. مهمترین شواهد شامل:
-
اندازهگیری مستقیم اختلاف پتانسیل غشایی و pH دو طرف غشای داخلی میتوکندری؛
-
مهار سنتز ATP با استفاده از یونوفورها و تخریب گرادیان پروتون؛
-
بررسی عملکرد مجدد ATP سنتاز در سیستمهای مصنوعی (liposome reconstitution)؛
-
مطالعه عملکرد پروتئینهای حامل پروتون مانند یونوفورهای یون H⁺ مثل FCCP) و DNP)
همه این دادهها، مدل میچل را بهعنوان چارچوب پذیرفتهشده تولید انرژی در ارگانیسمهای هوازی تثبیت کردند.
گسترش و تکامل نظریه: «Extended Mitchell Theory»
با گذر زمان و پیشرفت تکنیکهای زیستمولکولی، نظریه شیمیاسمزی نیز بسط یافت. مفاهیم تکمیلی شامل موارد زیر بودند:
-
مدل چرخشی ATP سنتاز: ارائه مکانیسم چرخشی برای تولید ATP (rotational catalysis) که توسط Paul Boyer و John Walker توسعه یافت و جایزه نوبل 1997 را برای آنان به همراه داشت.
-
نقش سوپراسمولها: (Supercomplexes) کشف اینکه پروتئینهای ETC در غشا بهصورت مجزا عمل نمیکنند، بلکه ساختارهای فوقمولکولی پایداری تشکیل میدهند که بهرهوری انتقال الکترون و پمپاژ پروتون را افزایش میدهد.
-
مفهوم "جریان جانبی پروتونها": (Lateral Proton Transfer) بررسی نحوه حرکت پروتونها در سطح غشاء و نقش لیپیدهای خاص مانند کاردیولیپین در این فرآیند.
بازنگریهای نوین و چالشها
با وجود استحکام نظریه میچل، برخی مطالعات جدید پیشنهاد کردهاند که در سلولهای خاص (مانند سلولهای توموری یا شرایط کماکسیژنی)، مسیرهای جایگزین برای تولید ATP از جمله فسفریلاسیون در سطح سوبسترا یا وابستگی کمتر به گرادیان پروتون نیز ممکن است وجود داشته باشند.
همچنین، در شرایط پاتولوژیکی مانند سپسیس، بیماریهای نورودژنراتیو یا کمبود اکسیژن مزمن، تخریب گرادیان پروتون یا تغییر در ساختار ATP سنتاز میتواند نظریه کلاسیک شیمیاسمزی را به چالش بکشد.
اهمیت نظریه شیمیاسمزی در علم مدرن
نظریه میچل نهتنها راه را برای درک بهتر تولید ATP باز کرد، بلکه بنیانی برای مفاهیم مدرن در ترابری فعال، الکتروفیزیولوژی سلولی، نورو بیوشیمی و حتی سنتز مصنوعی انرژی زیستی ایجاد کرد.
نظریه شیمیاسمزی بهعنوان یک دستاورد انقلابی در زیستشناسی سلولی باقی مانده است. با وجود برخی چالشها و تکاملهای مفهومی، مدل میچل همچنان بهعنوان سنگبنای فهم فسفریلاسیون اکسیداتیو شناخته میشود. شناخت این نظریه برای هر متخصص علوم زیستی، پزشکی، و بیوفیزیک ضروری است، چرا که درک درست آن به تحلیل بهتر مکانیسمهای سلولی در شرایط سلامتی و بیماری کمک میکند.
نقش فسفریلاسیون اکسیداتیو در شرایط فیزیولوژیکی و پاتولوژیکی
فسفریلاسیون اکسیداتیو (OXPHOS) بهعنوان یک فرآیند مرکزی در متابولیسم سلولی، نقشی تعیینکننده در حفظ تعادل انرژی و عملکرد حیاتی سلولها ایفا میکند. این فرآیند نه تنها در شرایط فیزیولوژیکی عادی مانند تولید انرژی برای تقسیم سلولی و انقباض عضلانی اهمیت دارد، بلکه در بسیاری از بیماریهای مزمن و حاد نیز دچار اختلال میشود. درک چگونگی تنظیم OXPHOS در شرایط طبیعی و پاتولوژیکی، برای شناخت مکانیسمهای بیماری و توسعه درمانهای هدفمند ضروری است.
نقش OXPHOS در شرایط فیزیولوژیکی
-
تولید انرژی مؤثر برای بافتهای پرمصرف
فسفریلاسیون اکسیداتیو در قلب، مغز، کبد و عضلات اسکلتی بسیار فعال است؛ زیرا این اندامها نیاز مداوم به ATP دارند. کارایی بالای این مسیر در تولید ATP نسبت به گلیکولیز (تقریباً 15 برابر بیشتر) آن را به منبع اصلی انرژی در بافتهای هوازی تبدیل کرده است. -
تولید گرما در بافت قهوهای (Thermogenesis)
در سلولهای چربی قهوهای، پروتئینهای جدا کننده (UCPs) گرادیان پروتون را بدون تولید ATP تخلیه میکنند، و انرژی حاصل را به صورت گرما آزاد مینمایند. این عملکرد به تنظیم دمای بدن، به ویژه در نوزادان و در مواجهه با سرما کمک میکند. -
نقش در سیگنالینگ سلولی و تنظیم مرگ برنامهریزیشده
محصولات جانبی ETC مانند گونههای فعال اکسیژن (ROS) در دوزهای پایین نقش سیگنالینگ دارند و در تنظیم مسیرهای مانند آپوپتوز و تمایز سلولی مشارکت میکنند.
تنظیم OXPHOS در پاسخ به نیازهای متابولیکی
-
میزان اکسیژن و در دسترس بودن سوبستراها (گلوکز، اسیدهای چرب، کتونها) نقش مهمی در کنترل فعالیت ETC دارند.
-
تنظیمات توسط آنزیمهای کلیدی، مانند کمپلکس I و IV، توسط فسفریلاسیون، تغییر بیان ژنی، یا هموستاز یونهای کلسیم و NADH انجام میشود.
-
فاکتور HIF-1α در پاسخ به هیپوکسی (کماکسیژنی) با کاهش فعالیت OXPHOS و افزایش گلیکولیز، تعادل را در شرایط بحرانی حفظ میکند.
اختلال در OXPHOS در بیماریها
OXPHOS نه تنها در عملکرد طبیعی سلول مؤثر است، بلکه اختلال در آن منجر به طیف وسیعی از بیماریها میشود:
اختلالات میتوکندریال مادرزادی
جهش در ژنهای هستهای یا میتوکندریایی کد کننده پروتئینهای ETC میتواند به بیماریهای مادرزادی مانند سندرم MELAS، Leigh یا LHON منجر شود. این بیماریها اغلب در سیستم عصبی و عضلات بروز میکنند.
التهاب و سپسیس
مطالعات نشان دادهاند که در شرایط التهابی شدید مانند سپسیس، عملکرد ETC مختل شده و تولید ATP کاهش مییابد. این پدیده به ویژه در اندامهایی مانند کلیه، قلب و ریه دیده میشود و میتواند منجر به نارسایی چند عضوی شود. همچنین، تولید بیش ازحد ROS در این شرایط به آسیب سلولی شدید منجر میشود.
بیماریهای متابولیکی و دیابت نوع ۲
در بیماران دیابتی، مقاومت به انسولین با کاهش فعالیت OXPHOS در عضلات اسکلتی مرتبط است. کاهش بیوژنز میتوکندری و اختلال در عملکرد کمپلکسهای زنجیره تنفسی در پاتوفیزیولوژی دیابت نقش دارند.
نارسایی قلبی
در نارسایی مزمن قلبی، اختلال در زنجیره انتقال الکترون و کاهش ظرفیت فسفریلاسیون اکسیداتیو، منجر به کاهش کارایی عضله قلب و پیشرفت بیماری میشود.
بیماریهای نورودژنراتیو
در شرایطی مانند آلزایمر، پارکینسون و ALS، آسیب به کمپلکسهای ETC و افزایش استرس اکسیداتیو نقش کلیدی در مرگ نورونی دارد. مطالعات نشان داده اند که کمپلکس I به ویژه در نورونهای دوپامینرژیک بسیار حساس است.
سرطان
در برخی تومورها مانند گلیوبلاستوما، مسیر فسفریلاسیون اکسیداتیو بهطور غیرعادی فعال است و نقش مهمی در تأمین انرژی، حفظ پتانسیل غشایی و مقاومت به درمان ایفا میکند. سلولهای سرطانی ممکن است به طور دینامیک بین گلیکولیز و OXPHOS جابهجا شوند (Plasticity Metabolic).
انعطافپذیری OXPHOS در پاسخ به شرایط محیطی
جالب است بدانیم که OXPHOS مسیر سخت گیرانهای نیست؛ بلکه در بسیاری از سلولها با گلیکولیز یا مسیرهای جایگزین مانند فسفریلاسیون در سطح سوبسترا تعامل دارد. این ویژگی امکان سازگاری متابولیکی در شرایطی مانند کمبود اکسیژن، استرس تغذیهای یا فشار اسمزی را فراهم میآورد.
نتیجهگیری
فسفریلاسیون اکسیداتیو در مرکز هماهنگی متابولیک سلول قرار دارد. عملکرد صحیح آن ضامن بقا و فعالیت طبیعی سلول است و هرگونه اختلال در آن میتواند مسیر بیماری را تسریع کند. درک پیچیدگیهای تنظیم این مسیر در فیزیولوژی و پاتولوژی، فرصتهای جدیدی برای درمانهای هدفمند میتوکندریایی فراهم میسازد.
فسفریلاسیون اکسیداتیو و سرطان (بهویژه گلیوبلاستوما و سرطان تخمدان)
برای مدتها، این باور وجود داشت که بیشتر سلولهای سرطانی عمدتاً از گلیکولیز هوازی (اثر واربورگ) برای تولید انرژی استفاده میکنند، حتی در حضور اکسیژن کافی. اما پژوهشهای نوین نشان دادهاند که بسیاری از سلولهای سرطانی، بهویژه در تومورهای تهاجمی مانند گلیوبلاستوما و سرطان تخمدان، همچنان از مسیر فسفریلاسیون اکسیداتیو (OXPHOS) بهره میگیرند یا بهطور دینامیک بین گلیکولیز و OXPHOS جابجا میشوند. این پدیده به انعطافپذیری متابولیک (metabolic plasticity) معروف است و در بقای سلولهای سرطانی نقش مهمی ایفا میکند.
گلیوبلاستوما: استفاده از فسفریلاسیون در سطح سوبسترا و OXPHOS
گلیوبلاستوما، توموری بسیار تهاجمی در سیستم عصبی مرکزی، بهدلیل محیط کماکسیژن و نیاز بالا به انرژی، از مکانیسمهای متابولیکی متنوعی بهره میبرد. مطالعهای با عنوان “Mitochondrial Substrate-Level Phosphorylation as Energy Source for Glioblastoma: Review and Hypothesis” نشان داده که در این نوع سرطان، حتی در شرایط مهار OXPHOS، سلولها میتوانند از فسفریلاسیون در سطح سوبسترا در ماتریکس میتوکندری برای تولید ATP استفاده کنند. این قابلیت باعث مقاومت متابولیکی بالا در برابر داروهای مهارکننده زنجیره تنفسی میشود.
نکات کلیدی:
-
سلولهای گلیوبلاستوما معمولاً دارای میتوکندریهای فعال با ساختار حفظشده هستند.
-
آنها توانایی استفاده از کتونها، گلوتامین و لاکتات را در کنار گلوکز دارند.
-
استفاده همزمان از گلیکولیز و OXPHOS باعث افزایش زندهمانی و رشد تومور میشود.
سرطان تخمدان: وابستگی به OXPHOS و هدفگیری درمانی
سرطان تخمدان، بهویژه در مراحل پیشرفته، اغلب به OXPHOS وابسته است. مطالعهای منتشرشده در مجله Cancers (MDPI) با عنوان “Oxidative Phosphorylation: A Target for Novel Therapeutic Strategies Against Ovarian Cancer” نشان داده که:
-
زیرگروهی از سلولهای بنیادی سرطانی (CSCs) در سرطان تخمدان دارای سطح بالای فعالیت میتوکندریایی هستند.
-
این سلولها به OXPHOS وابستهاند و نسبت به مهارکنندههای کمپلکس I مانند metformin یا phenformin حساساند.
-
ترکیب درمانی داروهای مهارکننده OXPHOS با شیمیدرمانی میتواند اثربخشی درمانی را افزایش دهد و عود مجدد تومور را کاهش دهد.
نکته مهم دیگر اینکه مقاومت دارویی در سرطان تخمدان، گاه با افزایش فعالیت OXPHOS مرتبط است. به عبارت دیگر، وقتی سلولهای سرطانی در برابر داروی خاصی مقاومت پیدا میکنند، مسیر OXPHOS را برای تأمین انرژی جایگزین فعالتر میکنند.
انعطافپذیری متابولیک در تومورها: یک چالش درمانی
در حالی که برخی سلولهای سرطانی بهشدت به گلیکولیز متکیاند، برخی دیگر مانند تومورهای تخمدان و مغز دارای انعطافپذیری متابولیکی بالایی هستند. این انعطافپذیری باعث میشود تا در برابر درمانهایی که فقط یک مسیر متابولیکی را هدف میگیرند مثل مهار گلیکولیز یا OXPHOS مقاومت ایجاد شود.
پاسخ درمانی موفق نیاز به درک دینامیک متابولیسم درون تومور دارد. در بسیاری از موارد، ترکیب مهارکنندههای OXPHOS با داروهایی که مسیرهای سیگنالدهی (مثل mTOR، PI3K یا HIF-1α) را هدف میگیرند، میتواند نتایج بهتری داشته باشد.
فرصتهای درمانی جدید با هدفگیری OXPHOS
-
مهارکنندههای کمپلکس I مانند IACS-010759، metformin و phenformin، در حال حاضر در آزمایشهای بالینی هستند.
-
استفاده از ترکیب مهارکنندههای OXPHOS با شیمیدرمانی سنتی یا مهارکنندههای PARP در سرطان تخمدان نتایج امیدوارکنندهای داشتهاند.
-
هدفگیری سلولهای بنیادی سرطانی وابسته به OXPHOS میتواند خطر بازگشت تومور را کاهش دهد.
-
استفاده از زیستنشانگرهای متابولیکی برای پیشبینی پاسخ به درمان، یک رویکرد جدید در پزشکی شخصیشده است.
نتیجهگیری
مطالعات نوین نشان دادهاند که فسفریلاسیون اکسیداتیو برخلاف تصور قبلی، نقش کلیدی در رشد و بقاء بسیاری از تومورها ایفا میکند. بهویژه در تومورهایی مانند گلیوبلاستوما و سرطان تخمدان، فعالیت OXPHOS میتواند به مقاومت دارویی، بقاء سلولهای بنیادی سرطانی و عود بیماری منجر شود. بنابراین، هدفگیری OXPHOS بهعنوان بخشی از استراتژی درمان ترکیبی، میتواند گامی مؤثر در درمان سرطانهای مقاوم باشد.
فسفریلاسیون اکسیداتیو و بیماریهای نورودژنراتیو
سیستم عصبی مرکزی برای عملکرد طبیعی خود به سطح بالایی از انرژی نیاز دارد، و این انرژی عمدتاً از طریق فسفریلاسیون اکسیداتیو (OXPHOS) در میتوکندری تأمین میشود. مغز، با اینکه تنها حدود ۲٪ از وزن بدن را تشکیل میدهد، اما بیش از ۲۰٪ از اکسیژن بدن را مصرف میکند. در نتیجه، هرگونه اختلال در عملکرد زنجیره انتقال الکترون یا کاهش ظرفیت ATP سنتاز، میتواند بهطور مستقیم بر سلامت نورونها تأثیر بگذارد و در بروز بیماریهای تخریب عصبی نقش داشته باشد.
اختلال در عملکرد میتوکندری و آغاز نورودژنراسیون
میتوکندریها نهتنها منبع اصلی تولید ATP در نورونها هستند، بلکه در تنظیم آپوپتوز (مرگ برنامهریزیشده سلول)، هموستاز کلسیم و مدیریت استرس اکسیداتیو نیز نقش اساسی دارند. زمانیکه عملکرد فسفریلاسیون اکسیداتیو مختل شود، تولید گونههای فعال اکسیژن (ROS) افزایش مییابد که میتواند به آسیب اکسیداتیو به لیپیدها، پروتئینها و DNA منجر شود.
طبق مقالهی منتشر شده در Journal of Bioenergetics and Biomembranes، عنوان شده است که آسیب به کمپلکس I یا کمپلکس IV زنجیره انتقال الکترون، میتواند اولین مرحله از شروع پاتولوژی در بیماریهای نورودژنراتیو باشد.
بیماری آلزایمر (AD) و اختلال در OXPHOS
در بیماران مبتلا به آلزایمر، کاهش فعالیت کمپلکسهای میتوکندریایی و افزایش سطح ROS مشاهده میشود. مهمترین ویژگیهای مرتبط با OXPHOS در آلزایمر عبارتند از:
-
کاهش فعالیت کمپلکس IV (سیتوکروم c اکسیداز) در نورونها.
-
تغییر در توزیع میتوکندری در آکسونها و دندریتها که بر انتقال سیگنال عصبی اثر میگذارد.
-
افزایش آسیب اکسیداتیو به mtDNA که خود باعث چرخهی تخریب بیشتر میتوکندری میشود.
علاوه براین، پروتئینهای آمیلوئید-بتا و tau که در پاتولوژی آلزایمر نقش دارند، با عملکرد میتوکندریایی تداخل کرده و حتی ممکن است باعث باز شدن منافذ انتقالی میتوکندری (mPTP) و آپوپتوز نورونی شوند.
بیماری پارکینسون (PD) و نقش کمپلکس I
در بیماری پارکینسون، تخریب انتخابی نورونهای دوپامینساز در جسم سیاه مغز (Substantia nigra) یکی از ویژگیهای کلیدی است. مطالعات نشان دادهاند که:
-
کاهش شدید در فعالیت کمپلکس I زنجیره تنفسی در این نورونها وجود دارد.
-
برخی از سموم محیطی مانند MPTP و rotenone، که مدلهای آزمایشگاهی پارکینسون ایجاد میکنند، دقیقاً از طریق مهار کمپلکس I عمل میکنند.
-
موتاسیون در ژنهایی مانند PINK1، Parkin، DJ-1 که با عملکرد میتوکندریایی در ارتباطاند، باعث بروز شکلهای ارثی پارکینسون میشوند.
به طور خلاصه، میتوان گفت اختلال در فسفریلاسیون اکسیداتیو هم میتواند علت و هم پیامد در زوال عملکرد نورونی در پارکینسون باشد.
بیماریهای دیگر مرتبط با اختلال OXPHOS
-
ALS (اسکلروز جانبی آمیوتروفیک): در این بیماری، آسیب میتوکندری در نورونهای حرکتی با افزایش ROS و نقص در سنتز ATP همراه است.
-
Huntington’s Disease (HD) : کاهش فعالیت کمپلکسهای II و III و استرس اکسیداتیو نقش مهمی در مرگ سلولی در HD ایفا میکنند.
-
: Ataxia برخی از انواع آتاکسیهای ارثی، بهویژه آتاکسی میتوکندریایی، مستقیماً از نقص در عملکرد کمپلکسهای OXPHOS ناشی میشوند.
درمانهای هدفگیری میتوکندری در بیماریهای نورودژنراتیو
با توجه به نقش کلیدی فسفریلاسیون اکسیداتیو در سلامت نورونی، رویکردهای درمانی متعددی برای حمایت یا بازسازی عملکرد میتوکندری مطرح شدهاند:
-
آنتیاکسیدانهای هدفگیرنده میتوکندری مانند MitoQ و SkQ1 برای کاهش ROS.
-
داروهای تقویتکننده بیوژنز میتوکندری مثل PGC-1α agonists.
-
مهارکنندههای باز شدن mPTP که مانع از آپوپتوز میشوند.
-
ترکیبات افزایشدهنده کمپلکس I یا IV برای بهبود کارایی زنجیره تنفسی.
-
درمان ژنی برای جایگزینی ژنهای معیوب در موارد ارثی.
جمعبندی
در بیماریهای نورودژنراتیو، اختلال در فسفریلاسیون اکسیداتیو هم یک علت اصلی و هم یک تشدیدکننده پاتولوژی است. کاهش ظرفیت تولید ATP، افزایش ROS، و نقص در پاکسازی میتوکندریهای آسیبدیده از عوامل کلیدی در آسیب نورونی هستند. لذا شناخت دقیق مسیرهای مرتبط با OXPHOS در نورونها و توسعه داروهای هدفگیرنده میتوکندری، میتواند راهگشای درمانهای مؤثرتر در بیماریهای تحلیلبرنده عصبی باشد.
نقش فسفریلاسیون اکسیداتیو در پیری و استرس اکسیداتیو
فرآیند پیری یکی از پیچیدهترین پدیدههای زیستی است که در آن تغییرات تدریجی در ساختار و عملکرد سلولها به کاهش عملکرد فیزیولوژیکی و افزایش خطر ابتلا به بیماریهای مزمن منجر میشود. یکی از مهمترین نظریههایی که امروزه در مورد پیری مطرح است، نظریه میتوکندریایی پیری (Mitochondrial Theory of Aging) است. این نظریه نقش محوری را برای فسفریلاسیون اکسیداتیو (OXPHOS) و محصولات جانبی آن یعنی گونههای فعال اکسیژن (ROS) در نظر میگیرد.
میتوکندری و پیری: ارتباطی دوطرفه
میتوکندریها هم تولید کننده ATP و هم منبع اصلی تولید ROS درونسلولی هستند. در طول عمر، میزان تولید ROS افزایش یافته و توانایی سلول برای دفع این مولکولهای مخرب کاهش مییابد. این ROSها به DNA میتوکندری (mtDNA)، پروتئینها و لیپیدها آسیب میزنند و موجب کاهش عملکرد زنجیره تنفسی میشوند. این کاهش عملکرد باعث تولید بیشتر ROS شده و یک چرخه معیوب ایجاد میکند که به پیری سلولی دامن میزند.
مطالعات منتشرشده در Redox Biology و Trends in Cell Biology به وضوح نشان دادهاند که با افزایش سن، فعالیت کمپلکس I و IV کاهش مییابد و بیان ژنهای دخیل در OXPHOS نیز افت میکند. همچنین، موتاسیونهای تجمعیافته در mtDNA در افراد مسن بیشتر دیده میشوند که نشانهی بارز پیری سلولی است.
استرس اکسیداتیو و تخریب عملکرد OXPHOS
استرس اکسیداتیو حالتی است که در آن تعادل بین تولید ROS و ظرفیت دفاع آنتیاکسیدانی بدن برهم میخورد. در شرایط استرس اکسیداتیو:
-
ساختار ATP سنتاز ممکن است تغییر کند و توانایی آن در تولید ATP کاهش یابد.
-
آسیب به فسفولیپیدهای غشای داخلی میتوکندری منجر به نشت پروتونها و کاهش شیب پروتون میشود.
-
پروتئینهای کمپلکس I، III و IV اکسیده شده و عملکرد زنجیره انتقال الکترون مختل میشود.
نتیجهی همه این فرآیندها، کاهش تولید انرژی در سلولها و بروز علائم پیری است.
پیری، OXPHOS و بافتهای پرمصرف انرژی
برخی از بافتها که به ATP وابستهاند، مانند مغز، عضلات قلبی و اسکلتی، بهشدت از کاهش کارایی OXPHOS در طول پیری آسیب میبینند. شایعترین تغییرات عبارتند از:
-
کاهش توده میتوکندریایی در سلولهای عضلانی.
-
افت در ظرفیت تنفس سلولی در نورونهای پیریافته.
-
افزایش میزان آپوپتوز در سلولهای کبدی، کلیوی و قلبی.
همچنین در پوست، که نمایانترین عضو برای مشاهده روند پیری است، افت عملکرد میتوکندریایی با کاهش سنتز کلاژن و افزایش چینوچروکها همراه است.
نقش آنتیاکسیدانها و سبک زندگی در مهار پیری میتوکندریایی
با درک نقش OXPHOS در پیری، توجه زیادی به راهکارهای مقابله با این روند معطوف شده است. برخی رویکردهای مؤثر شامل:
-
آنتیاکسیدانهای هدفگیرنده میتوکندری مانند MitoQ، CoQ10 و SkQ1 که مستقیماً وارد میتوکندری شده و ROS را خنثی میکنند.
-
مداخلات تغذیهای مانند محدودیت کالری (Caloric Restriction) و روزهداری متناوب (Intermittent Fasting) که با تحریک مسیرهای AMPK و SIRT1 باعث افزایش بیوژنز میتوکندری و کاهش ROS میشوند.
-
ورزشهای هوازی که با افزایش بیان PGC-1α تولید میتوکندری جدید را افزایش میدهند.
-
ترکیبات تحریککننده اتوفاژی میتوکندری (Mitophagy) مانند spermidine و rapamycin که به پاکسازی میتوکندریهای آسیبدیده کمک میکنند.
درمانهای هدفمند برای پیری وابسته به میتوکندری
درمانهایی که مستقیماً عملکرد OXPHOS را هدف قرار میدهند، در حال بررسی هستند. برای مثال:
-
NAD⁺ boosters مانند نیکوتینآمید ریبوزید (NR) و NMN میتوانند سطح انرژی را در سلولهای پیر افزایش دهند.
-
استفاده از مولکولهای کوچک برای بازسازی عملکرد کمپلکس I و IV در بافتهای آسیب دیده.
-
درمانهای ژنی برای اصلاح جهشهای mtDNA که در حال حاضر در مرحله آزمایش حیوانی قرار دارند.
نتیجهگیری
پیری بهعنوان فرآیندی چندعاملی، بهطور عمیق با اختلال در فسفریلاسیون اکسیداتیو و افزایش استرس اکسیداتیو در ارتباط است. با شناسایی نقش کلیدی میتوکندریها در این روند، امروزه تمرکز علمی بر مداخلات هدفمند برای بهبود عملکرد OXPHOS و کاهش ROS افزایش یافته است. پیشرفت در این حوزه میتواند به افزایش طول عمر سالم و کاهش بار بیماریهای مرتبط با سن کمک کند.
مداخلات درمانی هدفگیری فسفریلاسیون اکسیداتیو (OXPHOS): داروها و استراتژیهای جدید
فسفریلاسیون اکسیداتیو (OXPHOS) بهعنوان یکی از حیاتیترین مسیرهای تولید انرژی در سلولهای یوکاریوتی، بهویژه در بافتهایی با متابولیسم بالا مانند مغز، قلب، عضله و کبد، از دیر باز مورد توجه پژوهشگران بوده است. اما در سالهای اخیر، این مسیر نه تنها در فیزیولوژی طبیعی بلکه در پاتولوژی بیماریهایی همچون سرطان، بیماریهای متابولیک، عفونتهای حاد و بیماریهای تحلیلبرنده عصبی به عنوان یک هدف درمانی بالقوه مطرح شده است.
مهارکنندههای کمپلکسهای زنجیره انتقال الکترون
برخی از داروها بهصورت اختصاصی یکی از کمپلکسهای زنجیره انتقال الکترون را مهار کرده و از این طریق فعالیت OXPHOS را کاهش میدهند. این دسته از داروها بیشتر در درمان سرطانهای وابسته به OXPHOS مورد استفاده یا آزمایش قرار گرفتهاند.
-
IACS-010759 : یک مهارکننده قدرتمند کمپلکس I که در درمان سرطانهای مغزی مانند گلیوبلاستوما و برخی لنفومها مورد بررسی قرار گرفته است.
-
Phenformin و Metformin : داروهای ضد دیابت که با مهار کمپلکس I، استرس متابولیک را افزایش داده و از رشد سلولهای سرطانی جلوگیری میکنند.
-
Atovaquone : یک داروی ضد مالاریا که کمپلکس III را مهار میکند و در برخی سرطانها اثرات ضد تکثیری از خود نشان داده است.
تقویت عملکرد میتوکندری با مولکولهای انرژیزا
برخلاف رویکرد مهاری، در برخی شرایط پاتولوژیک (مانند بیماریهای نورودژنراتیو یا قلبی)، هدف، افزایش عملکرد OXPHOS است.
-
: Coenzyme Q10 (CoQ10) یکی از اجزای کلیدی زنجیره انتقال الکترون است که در بیماریهای عضلانی، نورودژنراتیو و سندرمهای میتوکندریایی بهعنوان مکمل تجویز میشود.
-
Idebenone : آنالوگ سنتتیک CoQ10 است که با قابلیت نفوذ بهتر به سلول، برای درمان بیماریهایی مانند Ataxia Friedreich پیشنهاد شده است.
-
EPI-743 (vatiquinone) : یک آنتیاکسیدان قوی که عملکرد OXPHOS را بهبود داده و در بیماریهای نادر ژنتیکی با اختلال در تنفس سلولی در حال بررسی بالینی است.
تحریک بیوژنز میتوکندری و PGC-1α
یکی از راهکارهای مدرن در تقویت OXPHOS، افزایش تعداد و کارایی میتوکندریها در سلول است. این هدف عمدتاً از طریق فعالسازی مسیرهای سیگنالدهی نظیر AMPK–SIRT1–PGC-1α انجام میشود.
-
Resveratrol : پلیفنول موجود در انگور که با فعالسازی SIRT1 باعث افزایش بیان PGC-1α و تقویت بیوژنز میتوکندری میشود.
-
AICAR : فعالکننده AMPK که در مطالعات پیشبالینی توانسته ظرفیت OXPHOS را در سلولهای عضلانی و کبدی افزایش دهد.
-
Exercise mimetics (مانند GW501516) : داروهایی که اثرات متابولیکی ورزش را تقلید میکنند و باعث افزایش عملکرد میتوکندریایی میشوند.
اصلاح ژنتیکی و درمانهای هدفمند mtDNA
با پیشرفت ابزارهای ویرایش ژن، رویکردهای نوینی برای اصلاح جهشهای بیماریزای DNA میتوکندریایی (mtDNA) توسعه یافتهاند.
-
MitoTALENs و : ZFNs آنزیمهایی که بهطور اختصاصی میتوانند جهشهای mtDNA را هدف قرار داده و حذف کنند.
-
Peptide Nucleic Acids (PNAs) : مولکولهای سنتتیکی که میتوانند به mtDNA متصل شوند و بیان ژنهای جهشیافته را مهار کنند.
-
در کنار اینها، استفاده از RNA دارویی هدفمند میتوکندری (mtRNA therapeutics) نیز در مرحله تحقیقاتی قرار دارد.
مهارکنندههای ATP سنتاز
گرچه سنتز ATP هدف ارزشمندی است، اما مهار آن نیازمند دقت بالاست؛ چراکه در تمام سلولهای بدن انجام میشود. با این حال، در سرطانهایی با وابستگی شدید به OXPHOS، ATP سنتاز هدف مناسبی تلقی میشود.
-
Oligomycin : مهارکننده سنتی ATP سنتاز که در محیط آزمایشگاهی باعث توقف تولید ATP و مرگ سلول میشود.
-
: Bedaquiline داروی ضد سل که بهتازگی بهعنوان مهارکننده انتخابی ATP سنتاز در سلولهای سرطانی مورد بررسی قرار گرفته است.
-
IF1 mimetics : یک مهارکننده فیزیولوژیک ATP سنتاز است و استفاده از مولکولهای مشابه آن میتواند تولید ATP در شرایط خاصی مانند تومورها کاهش دهد.
آنتیاکسیدانهای هدفگیرنده میتوکندری
برای شرایطی مانند پیری، بیماریهای نورودژنراتیو یا قلبی که افزایش ROS مشکلساز است، استفاده از آنتیاکسیدانهایی که بهطور اختصاصی وارد میتوکندری میشوند، رویکردی موفق بوده است.
-
MitoQ : مشتق از CoQ10 که با عبور از غشای داخلی میتوکندری، مستقیماً در محل تولید ROS اثر میگذارد.
-
SkQ1 : آنتیاکسیدان حاوی یون فسفونیوم که برای مهار پراکسیداسیون لیپیدها طراحی شده است.
-
Elamipretide (SS-31) : پپتیدی که با غشای داخلی میتوکندری برهمکنش میکند و عملکرد زنجیره تنفسی را تقویت میکند.
کاربرد در طب شخصی (Personalized Medicine)
پیشرفتهای اخیر در پروفایلینگ متابولیک تومورها و بیماران نورولوژیک نشان دادهاند که وابستگی به OXPHOS میتواند فرد به فرد متفاوت باشد. این یافتهها بستری فراهم کردهاند برای:
-
انتخاب داروهای مهارکننده OXPHOS برای تومورهایی با وابستگی متابولیکی بالا به فسفریلاسیون اکسیداتیو.
-
شناسایی بیماران با جهشهای خاص mtDNA جهت درمان هدفمند.
-
تعیین دوز مناسب مکملهای انرژیزا در بیماریهای میتوکندریایی مادرزادی.
جمعبندی
با درک عمیقتر از نقش مرکزی OXPHOS در فیزیولوژی و پاتوفیزیولوژی، طیف وسیعی از داروها و رویکردهای درمانی جدید برای بهبود یا مهار این مسیر متابولیکی توسعه یافتهاند. این مداخلات نه تنها چشمانداز درمان بیماریهای مزمن را روشنتر کردهاند، بلکه به افزایش طول عمر و ارتقاء کیفیت زندگی نیز کمک میکنند. آینده درمانهای هدفمند OXPHOS در گرو ادغام دانش میتوکندری، ژنتیک، داروسازی و طب دقیق خواهد بود.
فسفریلاسیون اکسیداتیو در گیاهان: شباهتها و تفاوتها با انسان
فسفریلاسیون اکسیداتیو (OXPHOS) نه تنها در سلولهای جانوری بلکه در سلولهای گیاهی نیز به عنوان مکانیزمی کلیدی برای تولید انرژی عمل میکند. اما برخلاف موجودات یوکاریوتی بدون کلروپلاست، گیاهان دارای دو ارگانل تولیدکننده انرژی هستند: میتوکندری و کلروپلاست. این دو اندامک اگرچه از نظر عملکردی با یکدیگر تعامل دارند، اما مسیرهای متابولیکی متفاوتی را دنبال میکنند. بررسی OXPHOS در گیاهان، تفاوتها و سازگاریهای جالبی را نسبت به سیستم انسانی آشکار میسازد.
ساختار و عملکرد زنجیره انتقال الکترون در گیاهان
زنجیره انتقال الکترون میتوکندریایی در گیاهان از لحاظ ساختار کلی مشابه انسان است، اما دارای اجزای منحصربهفردی نیز میباشد:
-
کمپلکسهای I تا V در گیاهان وجود دارند، اما علاوه بر آنها، مسیرهای جایگزین (Alternative Pathways ) نیز فعال هستند.
-
یکی از مهمترین این مسیرها شامل آنزیم AOX (Alternative Oxidase) است که الکترونها را مستقیماً از UQH₂ به اکسیژن منتقل میکند، بدون آنکه با کمپلکسهای III و IV تعامل داشته باشد.
-
این مسیر جایگزین برخلاف مسیر اصلی OXPHOS باعث تولید ATP نمیشود، اما به گیاه در شرایط استرس (مانند دمای بالا، کمبود اکسیژن یا وجود سموم) کمک میکند با جلوگیری از تولید ROS اضافی، زنده بماند.
حضور مسیرهای جایگزین در گیاهان
برخلاف سلولهای انسانی که به مسیر کلاسیک زنجیره تنفسی وابسته هستند، گیاهان دارای دو مسیر اضافی هستند:
-
AOX (Alternative Oxidase): در پاسخ به استرس اکسیداتیو فعال میشود و نقش تنظیمی در کنترل میزان ROS و حفظ تعادل رداکس ایفا میکند.
-
NDH (Type II NAD(P)H Dehydrogenases): گروهی از آنزیمها هستند که میتوانند NADH را به زنجیره انتقال الکترون وارد کنند، بدون نیاز به کمپلکس I.
این مسیرها انعطاف متابولیکی بیشتری به گیاهان میدهند و در سازگاری با محیط زیست نقش کلیدی دارند.
تعامل بین کلروپلاست و میتوکندری
در گیاهان، کلروپلاستها محل اصلی فتوسنتز و تولید NADPH و ATP در روز هستند، در حالی که میتوکندریها وظیفه تولید ATP را در شب و در شرایط غیرنوری به عهده دارند. اما این دو اندامک ارتباط نزدیکی با هم دارند:
-
میتوکندری با اکسید کردن NADH حاصل از فتوسنتز، به تنظیم تعادل انرژی در روز کمک میکند.
-
کلروپلاستها با تولید قند، زمینه را برای فعالسازی مسیرهای تنفسی میتوکندری در شب فراهم میکنند.
-
این همکاری باعث تقسیم کار انرژی و افزایش بهرهوری متابولیکی در سلولهای گیاهی میشود.
نقش OXPHOS در رشد و پاسخ به تنشهای زیستی و محیطی
در گیاهان، فسفریلاسیون اکسیداتیو علاوه بر تأمین انرژی برای رشد و توسعه، در پاسخ به عوامل تنشزا مانند خشکی، سرما، شوری، عفونتهای قارچی و باکتریایی نیز نقش دارد:
-
در شرایط تنش، مسیر AOX فعال شده و با کاهش تولید ROS، از آسیب اکسیداتیو به سلولها جلوگیری میکند.
-
برخی تنظیمکنندههای ژنی مانند ABI4 و ANAC017 نیز با تنظیم بیان ژنهای OXPHOS و AOX، پاسخ به تنش را کنترل میکنند.
-
مطالعات نشان دادهاند گیاهانی با بیان بالاتر AOX تحمل بهتری در برابر تنش دارند.
کاربردهای تحقیقاتی و بیوتکنولوژیک
درک عملکرد OXPHOS در گیاهان نه تنها در علوم پایه بلکه در کشاورزی و زیستفناوری نیز اهمیت دارد:
-
افزایش بهرهوری فتوسنتزی و تنفسی با مهندسی مسیرهای تنفسی برای تولید گیاهان مقاومتر به شرایط اقلیمی.
-
استفاده از مهارکنندههای AOX برای بررسی اثرات ROS در رشد گیاه.
-
تنظیم بیان ژنهای مربوط به زنجیره تنفسی برای بهبود تولید زیستتوده در گیاهان صنعتی و دارویی.
جمعبندی
فسفریلاسیون اکسیداتیو در گیاهان شباهت زیادی به فرآیند مشابه در انسان دارد، اما وجود مسیرهای جایگزین، تعامل با کلروپلاست و انعطافپذیری بالاتر در شرایط محیطی، وجه تمایز مهمی را ایجاد میکند. درک این تفاوتها میتواند به طراحی گیاهان مقاوم، افزایش بهرهوری انرژی و حتی توسعه داروهای جدید الهامبخش باشد.
نتیجهگیری و پاسخ به سوالات متداول متخصصان
فسفریلاسیون اکسیداتیو (OXPHOS) در میتوکندری، فرایندی کلیدی و پیچیده است که نقش اصلی را در تولید انرژی سلولی ایفا میکند. این فرایند متکی بر تعامل هماهنگ بین زنجیره انتقال الکترون، ATP سنتاز و سایر پروتئینهای مرتبط است. در طول مقاله، به شرح مفصل ساختار، عملکرد، و اهمیت فسفریلاسیون اکسیداتیو در شرایط فیزیولوژیکی و پاتولوژیکی پرداختیم و تأثیر آن در بیماریهایی مانند سرطان، بیماریهای نورودژنراتیو، پیری و استرس اکسیداتیو را بررسی کردیم.
همچنین تفاوتها و شباهتهای فسفریلاسیون اکسیداتیو در گیاهان و انسان را مطرح کردیم و کاربردهای بیوتکنولوژیک این دانش را توضیح دادیم. با پیشرفتهای اخیر در درک این فرایند، روشهای درمانی هدفمند علیه اختلالات مرتبط با OXPHOS در حال توسعه هستند که نویدبخش بهبود کیفیت زندگی بیماران میباشند.
پاسخ به سوالات متداول
۱. فسفریلاسیون اکسیداتیو چگونه ATP تولید میکند؟
فرآیند OXPHOS با انتقال الکترونها از NADH و FADH₂ به زنجیره انتقال الکترون آغاز میشود، که منجر به پمپاژ پروتونها به فضای بینمیتوکندریایی میگردد. این اختلاف غلظت پروتونها باعث ایجاد یک گرادیان الکتروشیمیایی شده و انرژی حاصل از آن توسط ATP سنتاز برای سنتز ATP از ADP و فسفات آزاد مصرف میشود.
۲. تفاوت اصلی بین فسفریلاسیون اکسیداتیو در گیاهان و انسان چیست؟
گیاهان علاوه بر مسیر کلاسیک OXPHOS، دارای مسیرهای جایگزین مانند AOX هستند که در شرایط استرس از تولید ROS جلوگیری میکند. همچنین کلروپلاستها در گیاهان نقش مهمی در تامین انرژی دارند که در انسان وجود ندارد.
۳. فسفریلاسیون اکسیداتیو چگونه در بیماریها نقش دارد؟
اختلال در OXPHOS میتواند منجر به کاهش تولید ATP، افزایش تولید گونههای فعال اکسیژن (ROS)، و آسیب سلولی شود که در بیماریهای مختلف مانند سرطان، نورودژنراتیوها و بیماریهای متابولیک دیده میشود.
۴. آیا میتوان فسفریلاسیون اکسیداتیو را به صورت هدفمند درمان کرد؟
بله، داروها و استراتژیهای نوینی در حال توسعه هستند که با هدفگیری مسیرهای خاص OXPHOS، میتوانند به درمان بیماریهایی مانند سرطان کمک کنند. مهندسی ژنتیکی و داروهای مهارکننده ATP سنتاز نمونههایی از این رویکردها هستند.
۵. نقش فسفریلاسیون اکسیداتیو در فرایند پیری چیست؟
افزایش استرس اکسیداتیو و کاهش کارایی OXPHOS با بالا رفتن سن همراه است که منجر به کاهش تولید ATP و آسیب به بافتها میشود، بنابراین فسفریلاسیون اکسیداتیو به طور مستقیم در فرایند پیری و کاهش عملکرد سلولی نقش دارد.
سخن پایانی
فسفریلاسیون اکسیداتیو یکی از مهمترین فرایندهای زیستی است که در تأمین انرژی سلولی نقش محوری دارد و به شدت تحت تأثیر شرایط فیزیولوژیکی و پاتولوژیکی قرار میگیرد. شناخت عمیقتر این فرایند و مکانیسمهای تنظیمی آن، چشماندازهای جدیدی برای درمان بیماریها و بهبود سلامت عمومی ایجاد کرده است. امید است که این مقاله توانسته باشد تصویری جامع و کامل از فسفریلاسیون اکسیداتیو ارائه دهد و پاسخگوی سوالات متخصصان و پژوهشگران حوزه زیستشناسی و پزشکی باشد.
منابع:
https://journals.sagepub.com/doi/full/10.1177/1759091418818261
Mitochondrial Substrate-Level Phosphorylation as Energy Source for Glioblastoma: Review and Hypothesis
https://www.sciencedirect.com/science/article/pii/S0925443914001598
Energy crisis: The role of oxidative phosphorylation in acute inflammation and sepsis
https://www.sciencedirect.com/science/article/pii/S0925443909001914
Mitochondria as ATP consumers in cellular pathology
https://www.mdpi.com/2072-6694/10/9/337
Oxidative Phosphorylation: A Target for Novel Therapeutic Strategies Against Ovarian Cancer
https://www.sciencedirect.com/science/article/pii/S0022510X12002584
Mitochondria, oxidative stress and neurodegeneration
https://www.degruyterbrill.com/document/doi/10.1515/bmc-2019-0001/html
ATP Synthase: Structure, Function and Inhibition
https://www.sciencedirect.com/science/article/pii/S0167488916300684
The transport mechanism of the mitochondrial ADP/ATP carrier
https://onlinelibrary.wiley.com/doi/full/10.1155/2012/646354
Oxidative Stress, Mitochondrial Dysfunction, and Aging
https://sci-hub.ru/https://doi.org/10.1016/j.tcb.2021.05.003
Oxidative phosphorylation system and cell culture media
https://sci-hub.ru/https://doi.org/10.1021/acs.jmedchem.0c01013
Why All the Fuss about Oxidative Phosphorylation (OXPHOS)?
https://sci-hub.ru/https://doi.org/10.1007/s11302-012-9305-8
ATP synthesis and storage
https://sci-hub.ru/https://doi.org/10.1016/j.mito.2020.04.007
The Oxidative Phosphorylation system of the mitochondria in plants
https://sci-hub.ru/https://doi.org/10.1113/JP273839
Oxidative phosphorylation: regulation and role in cellular and tissue metabolism
https://sci-hub.ru/https://doi.org/10.1016/j.redox.2020.101674
Mitochondrial electron transport chain: Oxidative phosphorylation, oxidant production, and methods of measurement
https://sci-hub.ru/https://doi.org/10.1016/j.bbagen.2009.04.019
New extension of the Mitchell Theory for oxidative phosphorylation in mitochondria of living organisms
https://sci-hub.ru/https://doi.org/10.1007/978-94-007-2869-1_1
The Oxidative Phosphorylation System in Mammalian Mitochondria
مقدمهای بر فسفریلاسیون اکسیداتیو
فسفریلاسیون اکسیداتیو (Oxidative Phosphorylation یا OXPHOS) یکی از حیاتیترین فرآیندهای بیوشیمیایی در بدن موجودات زنده است. این مسیر متابولیکی که در میتوکندری – معروف به "نیروگاه سلول" – رخ میدهد، عامل اصلی تولید انرژی سلولی به شکل آدنوزین تریفسفات (ATP) محسوب میشود. بدون ATP، سلولها توان انجام هیچیک از فعالیتهای ضروری مانند رشد، ترمیم، تقسیم و حتی حفظ پایداری خود را ندارند. در واقع، ATP واحد پول انرژی زیستی است و OXPHOS به عنوان کارخانه چاپ این ارز عمل میکند.
در دنیای زیستشناسی سلولی، انرژی همواره در مرکز توجه قرار دارد. بدن انسان برای انجام تمام اعمال حیاتی خود، از انقباض عضلانی گرفته تا انتقال پیامهای عصبی و ساخت پروتئین، به ATP نیاز دارد. اما سوال کلیدی این است: چگونه ATP در سلولها تولید میشود؟ و چرا فسفریلاسیون اکسیداتیو نسبت به سایر مسیرهای تولید انرژی مثل گلیکولیز، از اهمیت بالاتری برخوردار است؟
فرآیند فسفریلاسیون اکسیداتیو شامل یک زنجیره پیچیده از واکنشهای شیمیایی است که به کمک آن، الکترونها از مولکولهای حامل انرژی (مانند NADH و FADH2) به اکسیژن منتقل میشوند. این انتقال انرژی منجر به ایجاد یک شیب پروتونی در غشای داخلی میتوکندری میشود. در مرحله بعد، این شیب پروتونی نیروی محرکهای فراهم میآورد تا آنزیم ATP سنتاز (ATP Synthase) بتواند مولکول ADP را به ATP تبدیل کند.
مفهوم فسفریلاسیون اکسیداتیو به شکلی انقلابی در دهه ۱۹۶۰ میلادی توسط پیتر میچل (Peter Mitchell) با ارائه نظریه شیمیاسمزی توضیح داده شد؛ وی برای این نظریه جایزه نوبل شیمی را دریافت کرد. از آن زمان تاکنون، تحقیقات گستردهای در مورد نقش این مسیر در سلامت و بیماری، خصوصاً در زمینههایی مانند سرطان، پیری، التهاب، اختلالات نورودژنراتیو و حتی عملکرد گیاهان انجام شده است.
یکی از ویژگیهای منحصر به فرد فسفریلاسیون اکسیداتیو، بازدهی بالای آن در مقایسه با مسیرهای جایگزین مانند گلیکولیز است. در حالی که گلیکولیز تنها ۲ مولکول ATP به ازای هر گلوکز تولید میکند، فسفریلاسیون اکسیداتیو میتواند تا ۳۴ مولکول ATP تولید نماید. به همین دلیل، OXPHOS به عنوان یک سیستم فوقالعاده مؤثر در تأمین انرژی سلولی شناخته میشود.
با این حال، اهمیت فسفریلاسیون اکسیداتیو تنها به تولید ATP محدود نمیشود. مطالعات جدید نشان دادهاند که این مسیر نقشهای گستردهای در تنظیم آپوپتوز (مرگ برنامهریزی شده سلول)، متابولیسم اسیدهای آمینه، پاسخ ایمنی، تولید گونههای فعال اکسیژن (ROS) و حتی تنظیم بیان ژن دارد. این گستردگی عملکرد، فسفریلاسیون اکسیداتیو را به یک موضوع جذاب و کلیدی برای پژوهشگران در زمینههای پزشکی، سلولی و بیوشیمی تبدیل کرده است.
در این مقاله، به شکلی جامع و علمی به بررسی جزئیات فسفریلاسیون اکسیداتیو خواهیم پرداخت. هدف ما آن است که با نگاهی تخصصی، به تمام ابعاد این مسیر انرژیزا بپردازیم، عملکرد آن را در سطح سلولی و مولکولی بشکافیم، و نقش آن را در شرایط فیزیولوژیکی و پاتولوژیکی مختلف مورد تحلیل قرار دهیم. همچنین به بررسی پتانسیلهای درمانی هدفگیری OXPHOS در بیماریهای مزمن و تحلیل مکانیسمهای آن در گیاهان نیز خواهیم پرداخت.
اگر شما از متخصصین علوم زیستی، پزشکان، پژوهشگران زیستپزشکی یا علاقهمندان به بیوشیمی سلولی هستید، این مقاله میتواند برایتان پاسخی جامع به بسیاری از سوالات علمی درباره منبع اصلی انرژی در سلولهای زنده باشد.
میتوکندری: خانه قدرت سلول
میتوکندریها ساختارهای بینظیری در سلولهای یوکاریوتی هستند که اغلب با عنوان "خانه قدرت سلول" شناخته میشوند. این لقبی است که به درستی بیانگر نقش حیاتی آنها در تولید انرژی شیمیایی به صورت آدنوزین تریفسفات (ATP) از طریق فرآیند فسفریلاسیون اکسیداتیو است. در این بخش به بررسی ساختار، منشأ، عملکرد و نقش کلیدی میتوکندری در حیات سلولی میپردازیم.
منشأ تکاملی میتوکندری
نظریه اندوسیمبیوزی بیان میکند که میتوکندریها زمانی باکتریهای مستقل بودند که با سلولهای یوکاریوتی اولیه همزیستی برقرار کردند. با گذشت زمان، این همزیستی به ادغام کامل انجامید و منجر به تبدیل این باکتریها به اندامکی شد که امروزه آن را به عنوان میتوکندری میشناسیم. شواهدی از این گذشته تکاملی در ساختار حلقوی DNA میتوکندری، شباهت ریبوزومهای آن با باکتریها، و توانایی مستقل آن در تولید برخی از پروتئینها دیده میشود.
ساختار میتوکندری
میتوکندری دارای دو غشا است:
-
غشای خارجی : نسبتاً نفوذپذیر بوده و اجازه عبور مولکولهای کوچک و یونی را میدهد.
-
غشای داخلی: دارای چینخوردگیهایی به نام کریستا است که سطح تماس وسیعی را برای زنجیره انتقال الکترون فراهم میکند. این غشا تقریباً نفوذناپذیر است و حاوی پروتئینهای ضروری برای انتقال الکترون و سنتز ATP میباشد.
بین این دو غشا فضای بینغشایی و درون غشای داخلی فضای ماتریکس قرار دارد که حاوی آنزیمهای چرخه کربس، DNA میتوکندریایی، ریبوزومها و بسیاری از فاکتورهای متابولیکی است.
نقش میتوکندری در متابولیسم انرژی
میتوکندری مکان اصلی وقوع چرخه اسید سیتریک (چرخه کربس) و زنجیره انتقال الکترون است. این مسیرها با اکسیداسیون کامل مولکولهای سوخت (گلوکز، اسیدهای چرب و اسیدهای آمینه) منجر به تولید NADH و FADH₂ میشوند. این کوآنزیمهای احیاشده الکترونهای خود را به کمپلکسهای زنجیره انتقال الکترون در غشای داخلی میتوکندری منتقل کرده و باعث تولید ATP در مرحله نهایی میشوند.
نقشهای فراتر از تولید ATP
اگرچه تولید ATP شناختهشدهترین وظیفه میتوکندری است، اما این اندامک نقشهای بسیار بیشتری در حیات سلولی ایفا میکند:
-
تنظیم مرگ برنامهریزیشده سلول (آپوپتوز) از طریق آزادسازی سیتوکروم C.
-
تنظیم یون کلسیم به عنوان سیگنالدهنده در مسیرهای مختلف.
-
تنظیم استرس اکسیداتیو و تولید گونههای فعال اکسیژن (ROS).
-
اثرگذاری بر بیان ژنها از طریق تنظیم اپیژنتیکی و مسیرهای سیگنالدهی انرژیمحور.
بیماریهای مرتبط با اختلال عملکرد میتوکندری
هرگونه نقص در عملکرد میتوکندری میتواند زمینهساز طیف وسیعی از بیماریها باشد، از جمله:
-
بیماریهای عصبی مانند پارکینسون و آلزایمر
-
بیماریهای متابولیکی مانند دیابت نوع ۲
-
سرطانها بهویژه گلیوبلاستوما و سرطان تخمدان
-
پیری زودرس به دلیل تجمع گونههای فعال اکسیژن و آسیب به DNA
در واقع، میتوکندری یک پلتفرم مرکزی برای ادغام متابولیسم، سیگنال دهی و کنترل حیات سلولی است و شناخت عمیقتر از آن میتواند در درمان بسیاری از بیماریهای مزمن و مهلک موثر باشد.
زنجیره انتقال الکترون (ETC) و نقش آن در تولید انرژی
زنجیره انتقال الکترون )Electron Transport Chain یا ETC) هسته مرکزی فرآیند فسفریلاسیون اکسیداتیو در میتوکندری است و بدون تردید یکی از پیچیدهترین و در عین حال حیاتیترین سامانههای بیوشیمیایی در بدن انسان به شمار میرود. ETC مسئول تبدیل انرژی حاصل از مواد غذایی (مانند گلوکز و اسیدهای چرب) به شکل قابل استفادهی انرژی یعنی آدنوزین تریفسفات (ATP) است. این فرآیند با استفاده از گرادیان پروتون در غشای داخلی میتوکندری و از طریق آنزیم ATP سنتاز (ATP Synthase) انجام میپذیرد.
مروری کلی بر عملکرد زنجیره انتقال الکترون
زنجیره انتقال الکترون در غشای داخلی میتوکندری مستقر شده و از چهار کمپلکس پروتئینی اصلی و دو حامل الکترونی متحرک تشکیل شده است:
-
کمپلکس I نادئید دهیدروژناز (NADH:Ubiquinone oxidoreductase)
این کمپلکس اولین دریافتکنندهی الکترونها از مولکول NADH است. با اهدای الکترونها به یوبیکینون (CoQ)، این کمپلکس چهار پروتون را از ماتریکس به فضای بینغشایی پمپ میکند. -
کمپلکس II سوکسینات دهیدروژناز (Succinate:Ubiquinone oxidoreductase)
در این کمپلکس، FADH₂ الکترونهای خود را به زنجیره انتقال میدهد. برخلاف کمپلکس I ، این کمپلکس پروتون به فضای بینغشایی پمپ نمیکند، اما در تولید ATP سهم دارد. -
یوبیکینون (Coenzyme Q or Ubiquinone)
این مولکول لیپوفیل، الکترونها را از کمپلکسهای I و II جمعآوری کرده و به کمپلکس III انتقال میدهد. -
کمپلکس III سیتوکروم bc₁ (Cytochrome bc₁ Complex)
این کمپلکس الکترونها را به سیتوکروم c منتقل کرده و همزمان چهار پروتون را به فضای بینغشایی پمپ میکند. -
سیتوکروم c
یک پروتئین کوچک محلول در فضای بینغشایی که الکترونها را به کمپلکس IV میبرد. -
کمپلکس IV سیتوکروم c اکسیداز (Cytochrome c oxidase)
این کمپلکس الکترونها را به گیرنده نهایی یعنی اکسیژن منتقل میکند. اکسیژن در این مرحله با پروتونها ترکیب شده و مولکول آب تشکیل میدهد. هم زمان، دو پروتون نیز به فضای بینغشایی پمپ میشوند.
ایجاد گرادیان پروتون و نقش آن در تولید ATP
با پمپ شدن پروتونها از ماتریکس میتوکندری به فضای بینغشایی از طریق کمپلکسهای I، III و IV، یک شیب الکتروشیمیایی (گرادیان پروتون) به وجود میآید. این گرادیان شامل دو مؤلفه است:
-
اختلاف بار الکتریکی (پتانسیل غشایی()
-
اختلاف غلظت پروتونها (pH)
این شیب انرژیزا باعث ورود پروتونها از طریق آنزیم ATP سنتاز به درون ماتریکس میشود و طی این فرآیند، انرژی گرادیان پروتون به انرژی شیمیایی ذخیرهشده در ATP تبدیل میشود. به این فرآیند، فسفریلاسیون اکسیداتیو میگویند.
اهمیت اکسیژن در عملکرد ETC
اکسیژن به عنوان گیرنده نهایی الکترونها در ETC عمل میکند. بدون حضور اکسیژن، زنجیره انتقال الکترون متوقف میشود، NADH و FADH₂ نمیتوانند به شکل اکسید شده بازگردند، و چرخه کربس نیز به دلیل نبود این کوآنزیمهای احیا نشده متوقف خواهد شد. این شرایط منجر به کاهش چشمگیر ATP و در نهایت مرگ سلول میشود.
اثربخشی و بازدهی ETC در تولید ATP
بهطور تقریبی، اکسیداسیون یک مولکول NADH در ETC منجر به تولید حدود 2.5 مولکول ATP و اکسیداسیون FADH₂ به حدود 1.5 مولکول ATP منجر میشود. بنابراین، ETC بخش اعظم ATP مورد نیاز بدن را تولید میکند. این بازده بالا، ETC را به یکی از مهمترین ابزارهای متابولیکی در پستانداران تبدیل کرده است.
اختلال در ETC و پیامدهای آن
اختلال در عملکرد هر یک از اجزای زنجیره انتقال الکترون میتواند منجر به تولید ناکافی ATP و تجمع گونههای فعال اکسیژن (ROS) شود. این وضعیت میتواند در بروز یا پیشرفت بیماریهای زیر نقش ایفا کند:
-
بیماریهای نورودژنراتیو (مثل آلزایمر و پارکینسون)
-
سرطانها بهخصوص تومورهایی که به انرژی بالا نیاز دارند (مانند گلیوبلاستوما)
-
سندرومهای میتوکندریایی مادرزادی
-
پیری زودرس و کاهش ظرفیت ترمیم سلولی
جمعبندی
زنجیره انتقال الکترون نقطهی تلاقی متابولیسم، انرژی، و سلامت سلولی است. هر اختلال در این سامانه، میتواند عواقب متعددی برای بدن انسان به همراه داشته باشد. بنابراین، شناخت دقیق آن نه تنها برای درک عملکرد سلول ضروری است، بلکه در طراحی درمانهای نوین برای بیماریهای مزمن نیز اهمیت دارد.
ساختار و عملکرد ATP Synthase
ATP سنتاز )یا( ATPase آنزیمی استراتژیک در قلب فرآیند فسفریلاسیون اکسیداتیو است که وظیفه دارد گرادیان پروتون ایجاد شده توسط زنجیره انتقال الکترون (ETC) را به انرژی شیمیایی در قالب ATP تبدیل کند. این آنزیم، از نظر ساختاری و عملکردی یکی از پیشرفته ترین ماشینهای نانو مقیاس زیستی شناخته شده در علم زیست فیزیک محسوب میشود.
ساختار ATP Synthase: یک نانوماشین مولکولی
ATP سنتاز یک کمپلکس پروتئینی بزرگ و چندبخشی است که در غشای داخلی میتوکندری تعبیه شده و از دو بخش اصلی تشکیل شده است:
-
بخش F₀ (درونغشایی)
این بخش در غشای داخلی میتوکندری قرار دارد و کانالی برای عبور پروتونها فراهم میکند. F₀ متشکل از زیرواحدهای پروتئینی a ، b و حلقهای از زیرواحدهای c است. عبور پروتونها از این بخش باعث چرخش حلقه c و انتقال انرژی به بخش F₁ میشود. -
بخش F₁ (یرونغشایی یا ماتریکسی(
این بخش در ماتریکس میتوکندری قرار گرفته و متشکل از زیرواحدهای α، β، γ، δ و ε است. بخش F₁ فعالیت کاتالیزوری دارد و مسئول سنتز واقعی ATP از ADP و Pi )فسفات غیرآلی) است.
نحوه عملکرد: تبدیل انرژی گرادیان پروتون به ATP
فرآیند تولید ATP توسط ATP سنتاز در سه مرحله کلی صورت میگیرد:
-
عبور پروتونها از طریق F₀ :
پروتونهایی که در فضای بینغشایی تجمع یافتهاند، از طریق کانال F₀ به داخل ماتریکس بازمیگردند. -
ایجاد حرکت چرخشی (Rotational Catalysis) :
عبور پروتونها موجب چرخش حلقه c و محور γ در بخش F₁ میشود. این چرخش باعث تغییرات ساختاری در زیرواحدهای β میگردد. -
سنتز ATP :
در اثر چرخش محور γ، زیرواحدهای β وارد سه وضعیت ساختاری متفاوت میشوند:-
حالت باز (Open): اتصال ADP و Pi
-
حالت بسته (Tight): سنتز ATP
-
حالت آزادسازی (Loose): آزادسازی ATP سنتزشده
-
در هر چرخش کامل ATP سنتاز، سه مولکول ATP تولید میشود.
تنظیم فعالیت ATP Synthase در شرایط فیزیولوژیکی و پاتولوژیکی
ATP سنتاز تحت کنترلهای پیچیده سلولی عمل میکند. عواملی مانند نسبت ATP/ADP ، اختلاف پتانسیل غشایی، میزان اکسیژن، سطح گلوکز، و pH محیط، همگی میتوانند بر فعالیت این آنزیم تأثیر بگذارند. در شرایط کمبود اکسیژن یا استرس اکسیداتیو، فعالیت ATP سنتاز ممکن است کاهش یافته یا به طور معکوس عمل کند و باعث هدررفت ATP به جای تولید آن شود.
ATP سنتاز بهعنوان هدف دارویی
با پیشرفت تحقیقات، ATP سنتاز بهعنوان هدفی برای درمان بیماریهایی چون سرطان، عفونتها، دیابت، و بیماریهای عصبی مورد توجه قرار گرفته است. برخی ترکیبات دارویی مانند اولیگومایسین (Oligomycin) به طور اختصاصی بخش F₀ را مهار میکنند و از چرخش محور γ جلوگیری مینمایند. همچنین، مهارکنندههای جدید ATP سنتاز در درمان تومورها که وابستگی زیادی به OXPHOS دارند، در حال بررسی هستند.
ناهنجاریهای ژنتیکی مربوط به ATP Synthase
جهشهای ژنتیکی در ژنهای کد کننده زیرواحدهای ATP سنتاز میتواند منجر به بیماریهای میتوکندریایی شود. برخی از این اختلالات با کاهش تولید انرژی، ضعف عضلانی، نارسایی قلبی و نقص در رشد مغزی همراه هستند.
همولوژی و حفظ ساختار در طول تکامل
ATP سنتاز در میان ارگانیسمهای مختلف، از باکتریها تا انسان، ساختار بسیار مشابهی دارد. این حفظ ساختار طی تکامل، نشاندهنده اهمیت بالای عملکرد آن در بقاء سلولی است. حتی در گیاهان، ATP سنتاز نقش مشابهی در کلروپلاستها برای تولید ATP از نور ایفا میکند.
نتیجهگیری
ATP سنتاز، موتور نهایی تولید انرژی در بدن ماست. درک ساختار دقیق و عملکرد دینامیک این آنزیم، نه تنها کلید فهم عملکرد میتوکندری است، بلکه افقهای جدیدی برای درمان بیماریهایی که با اختلال انرژی در سطح سلولی همراه هستند، میگشاید. مهار یا تحریک این آنزیم بسته به بافت هدف، میتواند تأثیر درمانی شگرفی داشته باشد.
نظریه شیمیاسمزی (Mitchell Theory) و تکامل آن
درک مدرن ما از تولید ATP در میتوکندری بهطور بنیادی مدیون نظریه شیمیاسمزی است؛ نظریهای انقلابی که توسط پیتر میچل (Peter Mitchell) در دهه ۱۹۶۰ ارائه شد و بعدها جایزه نوبل شیمی سال ۱۹۷۸ را برای او به ارمغان آورد. این نظریه، دیدگاه قبلی که بر سنتز ATP از طریق انتقال مستقیم گروه فسفات تأکید داشت را به چالش کشید و با ارائه مدلی که به گرادیان پروتون وابسته بود، تحول عمیقی در بیوشیمی سلولی ایجاد کرد.
اصول کلیدی نظریه شیمیاسمزی
در قلب این نظریه، دو مفهوم اصلی وجود دارد:
-
ایجاد گرادیان پروتون در غشای داخلی میتوکندری
با عبور الکترونها از زنجیره انتقال الکترون (ETC)، انرژی آزاد شده برای پمپاژ فعال پروتونها (H⁺) از ماتریکس میتوکندری به فضای بینغشایی استفاده میشود. این فرآیند منجر به ایجاد یک شیب الکتروشیمیایی پروتونها در دو طرف غشای داخلی میتوکندری میشود. -
استفاده از انرژی گرادیان پروتون برای تولید ATP
بازگشت پروتونها به داخل ماتریکس، از طریق ATP سنتاز انجام میشود. انرژی آزاد شده از این حرکت "شیمیاسمزی" برای سنتز ATP از ADP و فسفات معدنی مورد استفاده قرار میگیرد.
این نظریه ساده و در عین حال قدرتمند، مدل جدیدی از تولید انرژی زیستی را تعریف کرد که کاملاً متفاوت از دیدگاههای قبلی بود.
مدارک تجربی تأییدکننده نظریه میچل
پس از ارائه این نظریه، مطالعات متعددی برای تأیید آن انجام شد. مهمترین شواهد شامل:
-
اندازهگیری مستقیم اختلاف پتانسیل غشایی و pH دو طرف غشای داخلی میتوکندری؛
-
مهار سنتز ATP با استفاده از یونوفورها و تخریب گرادیان پروتون؛
-
بررسی عملکرد مجدد ATP سنتاز در سیستمهای مصنوعی (liposome reconstitution)؛
-
مطالعه عملکرد پروتئینهای حامل پروتون مانند یونوفورهای یون H⁺ مثل FCCP) و DNP)
همه این دادهها، مدل میچل را بهعنوان چارچوب پذیرفتهشده تولید انرژی در ارگانیسمهای هوازی تثبیت کردند.
گسترش و تکامل نظریه: «Extended Mitchell Theory»
با گذر زمان و پیشرفت تکنیکهای زیستمولکولی، نظریه شیمیاسمزی نیز بسط یافت. مفاهیم تکمیلی شامل موارد زیر بودند:
-
مدل چرخشی ATP سنتاز: ارائه مکانیسم چرخشی برای تولید ATP (rotational catalysis) که توسط Paul Boyer و John Walker توسعه یافت و جایزه نوبل 1997 را برای آنان به همراه داشت.
-
نقش سوپراسمولها: (Supercomplexes) کشف اینکه پروتئینهای ETC در غشا بهصورت مجزا عمل نمیکنند، بلکه ساختارهای فوقمولکولی پایداری تشکیل میدهند که بهرهوری انتقال الکترون و پمپاژ پروتون را افزایش میدهد.
-
مفهوم "جریان جانبی پروتونها": (Lateral Proton Transfer) بررسی نحوه حرکت پروتونها در سطح غشاء و نقش لیپیدهای خاص مانند کاردیولیپین در این فرآیند.
بازنگریهای نوین و چالشها
با وجود استحکام نظریه میچل، برخی مطالعات جدید پیشنهاد کردهاند که در سلولهای خاص (مانند سلولهای توموری یا شرایط کماکسیژنی)، مسیرهای جایگزین برای تولید ATP از جمله فسفریلاسیون در سطح سوبسترا یا وابستگی کمتر به گرادیان پروتون نیز ممکن است وجود داشته باشند.
همچنین، در شرایط پاتولوژیکی مانند سپسیس، بیماریهای نورودژنراتیو یا کمبود اکسیژن مزمن، تخریب گرادیان پروتون یا تغییر در ساختار ATP سنتاز میتواند نظریه کلاسیک شیمیاسمزی را به چالش بکشد.
اهمیت نظریه شیمیاسمزی در علم مدرن
نظریه میچل نهتنها راه را برای درک بهتر تولید ATP باز کرد، بلکه بنیانی برای مفاهیم مدرن در ترابری فعال، الکتروفیزیولوژی سلولی، نورو بیوشیمی و حتی سنتز مصنوعی انرژی زیستی ایجاد کرد.
نظریه شیمیاسمزی بهعنوان یک دستاورد انقلابی در زیستشناسی سلولی باقی مانده است. با وجود برخی چالشها و تکاملهای مفهومی، مدل میچل همچنان بهعنوان سنگبنای فهم فسفریلاسیون اکسیداتیو شناخته میشود. شناخت این نظریه برای هر متخصص علوم زیستی، پزشکی، و بیوفیزیک ضروری است، چرا که درک درست آن به تحلیل بهتر مکانیسمهای سلولی در شرایط سلامتی و بیماری کمک میکند.
نقش فسفریلاسیون اکسیداتیو در شرایط فیزیولوژیکی و پاتولوژیکی
فسفریلاسیون اکسیداتیو (OXPHOS) بهعنوان یک فرآیند مرکزی در متابولیسم سلولی، نقشی تعیینکننده در حفظ تعادل انرژی و عملکرد حیاتی سلولها ایفا میکند. این فرآیند نه تنها در شرایط فیزیولوژیکی عادی مانند تولید انرژی برای تقسیم سلولی و انقباض عضلانی اهمیت دارد، بلکه در بسیاری از بیماریهای مزمن و حاد نیز دچار اختلال میشود. درک چگونگی تنظیم OXPHOS در شرایط طبیعی و پاتولوژیکی، برای شناخت مکانیسمهای بیماری و توسعه درمانهای هدفمند ضروری است.
نقش OXPHOS در شرایط فیزیولوژیکی
-
تولید انرژی مؤثر برای بافتهای پرمصرف
فسفریلاسیون اکسیداتیو در قلب، مغز، کبد و عضلات اسکلتی بسیار فعال است؛ زیرا این اندامها نیاز مداوم به ATP دارند. کارایی بالای این مسیر در تولید ATP نسبت به گلیکولیز (تقریباً 15 برابر بیشتر) آن را به منبع اصلی انرژی در بافتهای هوازی تبدیل کرده است. -
تولید گرما در بافت قهوهای (Thermogenesis)
در سلولهای چربی قهوهای، پروتئینهای جدا کننده (UCPs) گرادیان پروتون را بدون تولید ATP تخلیه میکنند، و انرژی حاصل را به صورت گرما آزاد مینمایند. این عملکرد به تنظیم دمای بدن، به ویژه در نوزادان و در مواجهه با سرما کمک میکند. -
نقش در سیگنالینگ سلولی و تنظیم مرگ برنامهریزیشده
محصولات جانبی ETC مانند گونههای فعال اکسیژن (ROS) در دوزهای پایین نقش سیگنالینگ دارند و در تنظیم مسیرهای مانند آپوپتوز و تمایز سلولی مشارکت میکنند.
تنظیم OXPHOS در پاسخ به نیازهای متابولیکی
-
میزان اکسیژن و در دسترس بودن سوبستراها (گلوکز، اسیدهای چرب، کتونها) نقش مهمی در کنترل فعالیت ETC دارند.
-
تنظیمات توسط آنزیمهای کلیدی، مانند کمپلکس I و IV، توسط فسفریلاسیون، تغییر بیان ژنی، یا هموستاز یونهای کلسیم و NADH انجام میشود.
-
فاکتور HIF-1α در پاسخ به هیپوکسی (کماکسیژنی) با کاهش فعالیت OXPHOS و افزایش گلیکولیز، تعادل را در شرایط بحرانی حفظ میکند.
اختلال در OXPHOS در بیماریها
OXPHOS نه تنها در عملکرد طبیعی سلول مؤثر است، بلکه اختلال در آن منجر به طیف وسیعی از بیماریها میشود:
اختلالات میتوکندریال مادرزادی
جهش در ژنهای هستهای یا میتوکندریایی کد کننده پروتئینهای ETC میتواند به بیماریهای مادرزادی مانند سندرم MELAS، Leigh یا LHON منجر شود. این بیماریها اغلب در سیستم عصبی و عضلات بروز میکنند.
التهاب و سپسیس
مطالعات نشان دادهاند که در شرایط التهابی شدید مانند سپسیس، عملکرد ETC مختل شده و تولید ATP کاهش مییابد. این پدیده به ویژه در اندامهایی مانند کلیه، قلب و ریه دیده میشود و میتواند منجر به نارسایی چند عضوی شود. همچنین، تولید بیش ازحد ROS در این شرایط به آسیب سلولی شدید منجر میشود.
بیماریهای متابولیکی و دیابت نوع ۲
در بیماران دیابتی، مقاومت به انسولین با کاهش فعالیت OXPHOS در عضلات اسکلتی مرتبط است. کاهش بیوژنز میتوکندری و اختلال در عملکرد کمپلکسهای زنجیره تنفسی در پاتوفیزیولوژی دیابت نقش دارند.
نارسایی قلبی
در نارسایی مزمن قلبی، اختلال در زنجیره انتقال الکترون و کاهش ظرفیت فسفریلاسیون اکسیداتیو، منجر به کاهش کارایی عضله قلب و پیشرفت بیماری میشود.
بیماریهای نورودژنراتیو
در شرایطی مانند آلزایمر، پارکینسون و ALS، آسیب به کمپلکسهای ETC و افزایش استرس اکسیداتیو نقش کلیدی در مرگ نورونی دارد. مطالعات نشان داده اند که کمپلکس I به ویژه در نورونهای دوپامینرژیک بسیار حساس است.
سرطان
در برخی تومورها مانند گلیوبلاستوما، مسیر فسفریلاسیون اکسیداتیو بهطور غیرعادی فعال است و نقش مهمی در تأمین انرژی، حفظ پتانسیل غشایی و مقاومت به درمان ایفا میکند. سلولهای سرطانی ممکن است به طور دینامیک بین گلیکولیز و OXPHOS جابهجا شوند (Plasticity Metabolic).
انعطافپذیری OXPHOS در پاسخ به شرایط محیطی
جالب است بدانیم که OXPHOS مسیر سخت گیرانهای نیست؛ بلکه در بسیاری از سلولها با گلیکولیز یا مسیرهای جایگزین مانند فسفریلاسیون در سطح سوبسترا تعامل دارد. این ویژگی امکان سازگاری متابولیکی در شرایطی مانند کمبود اکسیژن، استرس تغذیهای یا فشار اسمزی را فراهم میآورد.
نتیجهگیری
فسفریلاسیون اکسیداتیو در مرکز هماهنگی متابولیک سلول قرار دارد. عملکرد صحیح آن ضامن بقا و فعالیت طبیعی سلول است و هرگونه اختلال در آن میتواند مسیر بیماری را تسریع کند. درک پیچیدگیهای تنظیم این مسیر در فیزیولوژی و پاتولوژی، فرصتهای جدیدی برای درمانهای هدفمند میتوکندریایی فراهم میسازد.
فسفریلاسیون اکسیداتیو و سرطان (بهویژه گلیوبلاستوما و سرطان تخمدان)
برای مدتها، این باور وجود داشت که بیشتر سلولهای سرطانی عمدتاً از گلیکولیز هوازی (اثر واربورگ) برای تولید انرژی استفاده میکنند، حتی در حضور اکسیژن کافی. اما پژوهشهای نوین نشان دادهاند که بسیاری از سلولهای سرطانی، بهویژه در تومورهای تهاجمی مانند گلیوبلاستوما و سرطان تخمدان، همچنان از مسیر فسفریلاسیون اکسیداتیو (OXPHOS) بهره میگیرند یا بهطور دینامیک بین گلیکولیز و OXPHOS جابجا میشوند. این پدیده به انعطافپذیری متابولیک (metabolic plasticity) معروف است و در بقای سلولهای سرطانی نقش مهمی ایفا میکند.
گلیوبلاستوما: استفاده از فسفریلاسیون در سطح سوبسترا و OXPHOS
گلیوبلاستوما، توموری بسیار تهاجمی در سیستم عصبی مرکزی، بهدلیل محیط کماکسیژن و نیاز بالا به انرژی، از مکانیسمهای متابولیکی متنوعی بهره میبرد. مطالعهای با عنوان “Mitochondrial Substrate-Level Phosphorylation as Energy Source for Glioblastoma: Review and Hypothesis” نشان داده که در این نوع سرطان، حتی در شرایط مهار OXPHOS، سلولها میتوانند از فسفریلاسیون در سطح سوبسترا در ماتریکس میتوکندری برای تولید ATP استفاده کنند. این قابلیت باعث مقاومت متابولیکی بالا در برابر داروهای مهارکننده زنجیره تنفسی میشود.
نکات کلیدی:
-
سلولهای گلیوبلاستوما معمولاً دارای میتوکندریهای فعال با ساختار حفظشده هستند.
-
آنها توانایی استفاده از کتونها، گلوتامین و لاکتات را در کنار گلوکز دارند.
-
استفاده همزمان از گلیکولیز و OXPHOS باعث افزایش زندهمانی و رشد تومور میشود.
سرطان تخمدان: وابستگی به OXPHOS و هدفگیری درمانی
سرطان تخمدان، بهویژه در مراحل پیشرفته، اغلب به OXPHOS وابسته است. مطالعهای منتشرشده در مجله Cancers (MDPI) با عنوان “Oxidative Phosphorylation: A Target for Novel Therapeutic Strategies Against Ovarian Cancer” نشان داده که:
-
زیرگروهی از سلولهای بنیادی سرطانی (CSCs) در سرطان تخمدان دارای سطح بالای فعالیت میتوکندریایی هستند.
-
این سلولها به OXPHOS وابستهاند و نسبت به مهارکنندههای کمپلکس I مانند metformin یا phenformin حساساند.
-
ترکیب درمانی داروهای مهارکننده OXPHOS با شیمیدرمانی میتواند اثربخشی درمانی را افزایش دهد و عود مجدد تومور را کاهش دهد.
نکته مهم دیگر اینکه مقاومت دارویی در سرطان تخمدان، گاه با افزایش فعالیت OXPHOS مرتبط است. به عبارت دیگر، وقتی سلولهای سرطانی در برابر داروی خاصی مقاومت پیدا میکنند، مسیر OXPHOS را برای تأمین انرژی جایگزین فعالتر میکنند.
انعطافپذیری متابولیک در تومورها: یک چالش درمانی
در حالی که برخی سلولهای سرطانی بهشدت به گلیکولیز متکیاند، برخی دیگر مانند تومورهای تخمدان و مغز دارای انعطافپذیری متابولیکی بالایی هستند. این انعطافپذیری باعث میشود تا در برابر درمانهایی که فقط یک مسیر متابولیکی را هدف میگیرند مثل مهار گلیکولیز یا OXPHOS مقاومت ایجاد شود.
پاسخ درمانی موفق نیاز به درک دینامیک متابولیسم درون تومور دارد. در بسیاری از موارد، ترکیب مهارکنندههای OXPHOS با داروهایی که مسیرهای سیگنالدهی (مثل mTOR، PI3K یا HIF-1α) را هدف میگیرند، میتواند نتایج بهتری داشته باشد.
فرصتهای درمانی جدید با هدفگیری OXPHOS
-
مهارکنندههای کمپلکس I مانند IACS-010759، metformin و phenformin، در حال حاضر در آزمایشهای بالینی هستند.
-
استفاده از ترکیب مهارکنندههای OXPHOS با شیمیدرمانی سنتی یا مهارکنندههای PARP در سرطان تخمدان نتایج امیدوارکنندهای داشتهاند.
-
هدفگیری سلولهای بنیادی سرطانی وابسته به OXPHOS میتواند خطر بازگشت تومور را کاهش دهد.
-
استفاده از زیستنشانگرهای متابولیکی برای پیشبینی پاسخ به درمان، یک رویکرد جدید در پزشکی شخصیشده است.
نتیجهگیری
مطالعات نوین نشان دادهاند که فسفریلاسیون اکسیداتیو برخلاف تصور قبلی، نقش کلیدی در رشد و بقاء بسیاری از تومورها ایفا میکند. بهویژه در تومورهایی مانند گلیوبلاستوما و سرطان تخمدان، فعالیت OXPHOS میتواند به مقاومت دارویی، بقاء سلولهای بنیادی سرطانی و عود بیماری منجر شود. بنابراین، هدفگیری OXPHOS بهعنوان بخشی از استراتژی درمان ترکیبی، میتواند گامی مؤثر در درمان سرطانهای مقاوم باشد.
فسفریلاسیون اکسیداتیو و بیماریهای نورودژنراتیو
سیستم عصبی مرکزی برای عملکرد طبیعی خود به سطح بالایی از انرژی نیاز دارد، و این انرژی عمدتاً از طریق فسفریلاسیون اکسیداتیو (OXPHOS) در میتوکندری تأمین میشود. مغز، با اینکه تنها حدود ۲٪ از وزن بدن را تشکیل میدهد، اما بیش از ۲۰٪ از اکسیژن بدن را مصرف میکند. در نتیجه، هرگونه اختلال در عملکرد زنجیره انتقال الکترون یا کاهش ظرفیت ATP سنتاز، میتواند بهطور مستقیم بر سلامت نورونها تأثیر بگذارد و در بروز بیماریهای تخریب عصبی نقش داشته باشد.
اختلال در عملکرد میتوکندری و آغاز نورودژنراسیون
میتوکندریها نهتنها منبع اصلی تولید ATP در نورونها هستند، بلکه در تنظیم آپوپتوز (مرگ برنامهریزیشده سلول)، هموستاز کلسیم و مدیریت استرس اکسیداتیو نیز نقش اساسی دارند. زمانیکه عملکرد فسفریلاسیون اکسیداتیو مختل شود، تولید گونههای فعال اکسیژن (ROS) افزایش مییابد که میتواند به آسیب اکسیداتیو به لیپیدها، پروتئینها و DNA منجر شود.
طبق مقالهی منتشر شده در Journal of Bioenergetics and Biomembranes، عنوان شده است که آسیب به کمپلکس I یا کمپلکس IV زنجیره انتقال الکترون، میتواند اولین مرحله از شروع پاتولوژی در بیماریهای نورودژنراتیو باشد.
بیماری آلزایمر (AD) و اختلال در OXPHOS
در بیماران مبتلا به آلزایمر، کاهش فعالیت کمپلکسهای میتوکندریایی و افزایش سطح ROS مشاهده میشود. مهمترین ویژگیهای مرتبط با OXPHOS در آلزایمر عبارتند از:
-
کاهش فعالیت کمپلکس IV (سیتوکروم c اکسیداز) در نورونها.
-
تغییر در توزیع میتوکندری در آکسونها و دندریتها که بر انتقال سیگنال عصبی اثر میگذارد.
-
افزایش آسیب اکسیداتیو به mtDNA که خود باعث چرخهی تخریب بیشتر میتوکندری میشود.
علاوه براین، پروتئینهای آمیلوئید-بتا و tau که در پاتولوژی آلزایمر نقش دارند، با عملکرد میتوکندریایی تداخل کرده و حتی ممکن است باعث باز شدن منافذ انتقالی میتوکندری (mPTP) و آپوپتوز نورونی شوند.
بیماری پارکینسون (PD) و نقش کمپلکس I
در بیماری پارکینسون، تخریب انتخابی نورونهای دوپامینساز در جسم سیاه مغز (Substantia nigra) یکی از ویژگیهای کلیدی است. مطالعات نشان دادهاند که:
-
کاهش شدید در فعالیت کمپلکس I زنجیره تنفسی در این نورونها وجود دارد.
-
برخی از سموم محیطی مانند MPTP و rotenone، که مدلهای آزمایشگاهی پارکینسون ایجاد میکنند، دقیقاً از طریق مهار کمپلکس I عمل میکنند.
-
موتاسیون در ژنهایی مانند PINK1، Parkin، DJ-1 که با عملکرد میتوکندریایی در ارتباطاند، باعث بروز شکلهای ارثی پارکینسون میشوند.
به طور خلاصه، میتوان گفت اختلال در فسفریلاسیون اکسیداتیو هم میتواند علت و هم پیامد در زوال عملکرد نورونی در پارکینسون باشد.
بیماریهای دیگر مرتبط با اختلال OXPHOS
-
ALS (اسکلروز جانبی آمیوتروفیک): در این بیماری، آسیب میتوکندری در نورونهای حرکتی با افزایش ROS و نقص در سنتز ATP همراه است.
-
Huntington’s Disease (HD) : کاهش فعالیت کمپلکسهای II و III و استرس اکسیداتیو نقش مهمی در مرگ سلولی در HD ایفا میکنند.
-
: Ataxia برخی از انواع آتاکسیهای ارثی، بهویژه آتاکسی میتوکندریایی، مستقیماً از نقص در عملکرد کمپلکسهای OXPHOS ناشی میشوند.
درمانهای هدفگیری میتوکندری در بیماریهای نورودژنراتیو
با توجه به نقش کلیدی فسفریلاسیون اکسیداتیو در سلامت نورونی، رویکردهای درمانی متعددی برای حمایت یا بازسازی عملکرد میتوکندری مطرح شدهاند:
-
آنتیاکسیدانهای هدفگیرنده میتوکندری مانند MitoQ و SkQ1 برای کاهش ROS.
-
داروهای تقویتکننده بیوژنز میتوکندری مثل PGC-1α agonists.
-
مهارکنندههای باز شدن mPTP که مانع از آپوپتوز میشوند.
-
ترکیبات افزایشدهنده کمپلکس I یا IV برای بهبود کارایی زنجیره تنفسی.
-
درمان ژنی برای جایگزینی ژنهای معیوب در موارد ارثی.
جمعبندی
در بیماریهای نورودژنراتیو، اختلال در فسفریلاسیون اکسیداتیو هم یک علت اصلی و هم یک تشدیدکننده پاتولوژی است. کاهش ظرفیت تولید ATP، افزایش ROS، و نقص در پاکسازی میتوکندریهای آسیبدیده از عوامل کلیدی در آسیب نورونی هستند. لذا شناخت دقیق مسیرهای مرتبط با OXPHOS در نورونها و توسعه داروهای هدفگیرنده میتوکندری، میتواند راهگشای درمانهای مؤثرتر در بیماریهای تحلیلبرنده عصبی باشد.
نقش فسفریلاسیون اکسیداتیو در پیری و استرس اکسیداتیو
فرآیند پیری یکی از پیچیدهترین پدیدههای زیستی است که در آن تغییرات تدریجی در ساختار و عملکرد سلولها به کاهش عملکرد فیزیولوژیکی و افزایش خطر ابتلا به بیماریهای مزمن منجر میشود. یکی از مهمترین نظریههایی که امروزه در مورد پیری مطرح است، نظریه میتوکندریایی پیری (Mitochondrial Theory of Aging) است. این نظریه نقش محوری را برای فسفریلاسیون اکسیداتیو (OXPHOS) و محصولات جانبی آن یعنی گونههای فعال اکسیژن (ROS) در نظر میگیرد.
میتوکندری و پیری: ارتباطی دوطرفه
میتوکندریها هم تولید کننده ATP و هم منبع اصلی تولید ROS درونسلولی هستند. در طول عمر، میزان تولید ROS افزایش یافته و توانایی سلول برای دفع این مولکولهای مخرب کاهش مییابد. این ROSها به DNA میتوکندری (mtDNA)، پروتئینها و لیپیدها آسیب میزنند و موجب کاهش عملکرد زنجیره تنفسی میشوند. این کاهش عملکرد باعث تولید بیشتر ROS شده و یک چرخه معیوب ایجاد میکند که به پیری سلولی دامن میزند.
مطالعات منتشرشده در Redox Biology و Trends in Cell Biology به وضوح نشان دادهاند که با افزایش سن، فعالیت کمپلکس I و IV کاهش مییابد و بیان ژنهای دخیل در OXPHOS نیز افت میکند. همچنین، موتاسیونهای تجمعیافته در mtDNA در افراد مسن بیشتر دیده میشوند که نشانهی بارز پیری سلولی است.
استرس اکسیداتیو و تخریب عملکرد OXPHOS
استرس اکسیداتیو حالتی است که در آن تعادل بین تولید ROS و ظرفیت دفاع آنتیاکسیدانی بدن برهم میخورد. در شرایط استرس اکسیداتیو:
-
ساختار ATP سنتاز ممکن است تغییر کند و توانایی آن در تولید ATP کاهش یابد.
-
آسیب به فسفولیپیدهای غشای داخلی میتوکندری منجر به نشت پروتونها و کاهش شیب پروتون میشود.
-
پروتئینهای کمپلکس I، III و IV اکسیده شده و عملکرد زنجیره انتقال الکترون مختل میشود.
نتیجهی همه این فرآیندها، کاهش تولید انرژی در سلولها و بروز علائم پیری است.
پیری، OXPHOS و بافتهای پرمصرف انرژی
برخی از بافتها که به ATP وابستهاند، مانند مغز، عضلات قلبی و اسکلتی، بهشدت از کاهش کارایی OXPHOS در طول پیری آسیب میبینند. شایعترین تغییرات عبارتند از:
-
کاهش توده میتوکندریایی در سلولهای عضلانی.
-
افت در ظرفیت تنفس سلولی در نورونهای پیریافته.
-
افزایش میزان آپوپتوز در سلولهای کبدی، کلیوی و قلبی.
همچنین در پوست، که نمایانترین عضو برای مشاهده روند پیری است، افت عملکرد میتوکندریایی با کاهش سنتز کلاژن و افزایش چینوچروکها همراه است.
نقش آنتیاکسیدانها و سبک زندگی در مهار پیری میتوکندریایی
با درک نقش OXPHOS در پیری، توجه زیادی به راهکارهای مقابله با این روند معطوف شده است. برخی رویکردهای مؤثر شامل:
-
آنتیاکسیدانهای هدفگیرنده میتوکندری مانند MitoQ، CoQ10 و SkQ1 که مستقیماً وارد میتوکندری شده و ROS را خنثی میکنند.
-
مداخلات تغذیهای مانند محدودیت کالری (Caloric Restriction) و روزهداری متناوب (Intermittent Fasting) که با تحریک مسیرهای AMPK و SIRT1 باعث افزایش بیوژنز میتوکندری و کاهش ROS میشوند.
-
ورزشهای هوازی که با افزایش بیان PGC-1α تولید میتوکندری جدید را افزایش میدهند.
-
ترکیبات تحریککننده اتوفاژی میتوکندری (Mitophagy) مانند spermidine و rapamycin که به پاکسازی میتوکندریهای آسیبدیده کمک میکنند.
درمانهای هدفمند برای پیری وابسته به میتوکندری
درمانهایی که مستقیماً عملکرد OXPHOS را هدف قرار میدهند، در حال بررسی هستند. برای مثال:
-
NAD⁺ boosters مانند نیکوتینآمید ریبوزید (NR) و NMN میتوانند سطح انرژی را در سلولهای پیر افزایش دهند.
-
استفاده از مولکولهای کوچک برای بازسازی عملکرد کمپلکس I و IV در بافتهای آسیب دیده.
-
درمانهای ژنی برای اصلاح جهشهای mtDNA که در حال حاضر در مرحله آزمایش حیوانی قرار دارند.
نتیجهگیری
پیری بهعنوان فرآیندی چندعاملی، بهطور عمیق با اختلال در فسفریلاسیون اکسیداتیو و افزایش استرس اکسیداتیو در ارتباط است. با شناسایی نقش کلیدی میتوکندریها در این روند، امروزه تمرکز علمی بر مداخلات هدفمند برای بهبود عملکرد OXPHOS و کاهش ROS افزایش یافته است. پیشرفت در این حوزه میتواند به افزایش طول عمر سالم و کاهش بار بیماریهای مرتبط با سن کمک کند.
مداخلات درمانی هدفگیری فسفریلاسیون اکسیداتیو (OXPHOS): داروها و استراتژیهای جدید
فسفریلاسیون اکسیداتیو (OXPHOS) بهعنوان یکی از حیاتیترین مسیرهای تولید انرژی در سلولهای یوکاریوتی، بهویژه در بافتهایی با متابولیسم بالا مانند مغز، قلب، عضله و کبد، از دیر باز مورد توجه پژوهشگران بوده است. اما در سالهای اخیر، این مسیر نه تنها در فیزیولوژی طبیعی بلکه در پاتولوژی بیماریهایی همچون سرطان، بیماریهای متابولیک، عفونتهای حاد و بیماریهای تحلیلبرنده عصبی به عنوان یک هدف درمانی بالقوه مطرح شده است.
مهارکنندههای کمپلکسهای زنجیره انتقال الکترون
برخی از داروها بهصورت اختصاصی یکی از کمپلکسهای زنجیره انتقال الکترون را مهار کرده و از این طریق فعالیت OXPHOS را کاهش میدهند. این دسته از داروها بیشتر در درمان سرطانهای وابسته به OXPHOS مورد استفاده یا آزمایش قرار گرفتهاند.
-
IACS-010759 : یک مهارکننده قدرتمند کمپلکس I که در درمان سرطانهای مغزی مانند گلیوبلاستوما و برخی لنفومها مورد بررسی قرار گرفته است.
-
Phenformin و Metformin : داروهای ضد دیابت که با مهار کمپلکس I، استرس متابولیک را افزایش داده و از رشد سلولهای سرطانی جلوگیری میکنند.
-
Atovaquone : یک داروی ضد مالاریا که کمپلکس III را مهار میکند و در برخی سرطانها اثرات ضد تکثیری از خود نشان داده است.
تقویت عملکرد میتوکندری با مولکولهای انرژیزا
برخلاف رویکرد مهاری، در برخی شرایط پاتولوژیک (مانند بیماریهای نورودژنراتیو یا قلبی)، هدف، افزایش عملکرد OXPHOS است.
-
: Coenzyme Q10 (CoQ10) یکی از اجزای کلیدی زنجیره انتقال الکترون است که در بیماریهای عضلانی، نورودژنراتیو و سندرمهای میتوکندریایی بهعنوان مکمل تجویز میشود.
-
Idebenone : آنالوگ سنتتیک CoQ10 است که با قابلیت نفوذ بهتر به سلول، برای درمان بیماریهایی مانند Ataxia Friedreich پیشنهاد شده است.
-
EPI-743 (vatiquinone) : یک آنتیاکسیدان قوی که عملکرد OXPHOS را بهبود داده و در بیماریهای نادر ژنتیکی با اختلال در تنفس سلولی در حال بررسی بالینی است.
تحریک بیوژنز میتوکندری و PGC-1α
یکی از راهکارهای مدرن در تقویت OXPHOS، افزایش تعداد و کارایی میتوکندریها در سلول است. این هدف عمدتاً از طریق فعالسازی مسیرهای سیگنالدهی نظیر AMPK–SIRT1–PGC-1α انجام میشود.
-
Resveratrol : پلیفنول موجود در انگور که با فعالسازی SIRT1 باعث افزایش بیان PGC-1α و تقویت بیوژنز میتوکندری میشود.
-
AICAR : فعالکننده AMPK که در مطالعات پیشبالینی توانسته ظرفیت OXPHOS را در سلولهای عضلانی و کبدی افزایش دهد.
-
Exercise mimetics (مانند GW501516) : داروهایی که اثرات متابولیکی ورزش را تقلید میکنند و باعث افزایش عملکرد میتوکندریایی میشوند.
اصلاح ژنتیکی و درمانهای هدفمند mtDNA
با پیشرفت ابزارهای ویرایش ژن، رویکردهای نوینی برای اصلاح جهشهای بیماریزای DNA میتوکندریایی (mtDNA) توسعه یافتهاند.
-
MitoTALENs و : ZFNs آنزیمهایی که بهطور اختصاصی میتوانند جهشهای mtDNA را هدف قرار داده و حذف کنند.
-
Peptide Nucleic Acids (PNAs) : مولکولهای سنتتیکی که میتوانند به mtDNA متصل شوند و بیان ژنهای جهشیافته را مهار کنند.
-
در کنار اینها، استفاده از RNA دارویی هدفمند میتوکندری (mtRNA therapeutics) نیز در مرحله تحقیقاتی قرار دارد.
مهارکنندههای ATP سنتاز
گرچه سنتز ATP هدف ارزشمندی است، اما مهار آن نیازمند دقت بالاست؛ چراکه در تمام سلولهای بدن انجام میشود. با این حال، در سرطانهایی با وابستگی شدید به OXPHOS، ATP سنتاز هدف مناسبی تلقی میشود.
-
Oligomycin : مهارکننده سنتی ATP سنتاز که در محیط آزمایشگاهی باعث توقف تولید ATP و مرگ سلول میشود.
-
: Bedaquiline داروی ضد سل که بهتازگی بهعنوان مهارکننده انتخابی ATP سنتاز در سلولهای سرطانی مورد بررسی قرار گرفته است.
-
IF1 mimetics : یک مهارکننده فیزیولوژیک ATP سنتاز است و استفاده از مولکولهای مشابه آن میتواند تولید ATP در شرایط خاصی مانند تومورها کاهش دهد.
آنتیاکسیدانهای هدفگیرنده میتوکندری
برای شرایطی مانند پیری، بیماریهای نورودژنراتیو یا قلبی که افزایش ROS مشکلساز است، استفاده از آنتیاکسیدانهایی که بهطور اختصاصی وارد میتوکندری میشوند، رویکردی موفق بوده است.
-
MitoQ : مشتق از CoQ10 که با عبور از غشای داخلی میتوکندری، مستقیماً در محل تولید ROS اثر میگذارد.
-
SkQ1 : آنتیاکسیدان حاوی یون فسفونیوم که برای مهار پراکسیداسیون لیپیدها طراحی شده است.
-
Elamipretide (SS-31) : پپتیدی که با غشای داخلی میتوکندری برهمکنش میکند و عملکرد زنجیره تنفسی را تقویت میکند.
کاربرد در طب شخصی (Personalized Medicine)
پیشرفتهای اخیر در پروفایلینگ متابولیک تومورها و بیماران نورولوژیک نشان دادهاند که وابستگی به OXPHOS میتواند فرد به فرد متفاوت باشد. این یافتهها بستری فراهم کردهاند برای:
-
انتخاب داروهای مهارکننده OXPHOS برای تومورهایی با وابستگی متابولیکی بالا به فسفریلاسیون اکسیداتیو.
-
شناسایی بیماران با جهشهای خاص mtDNA جهت درمان هدفمند.
-
تعیین دوز مناسب مکملهای انرژیزا در بیماریهای میتوکندریایی مادرزادی.
جمعبندی
با درک عمیقتر از نقش مرکزی OXPHOS در فیزیولوژی و پاتوفیزیولوژی، طیف وسیعی از داروها و رویکردهای درمانی جدید برای بهبود یا مهار این مسیر متابولیکی توسعه یافتهاند. این مداخلات نه تنها چشمانداز درمان بیماریهای مزمن را روشنتر کردهاند، بلکه به افزایش طول عمر و ارتقاء کیفیت زندگی نیز کمک میکنند. آینده درمانهای هدفمند OXPHOS در گرو ادغام دانش میتوکندری، ژنتیک، داروسازی و طب دقیق خواهد بود.
فسفریلاسیون اکسیداتیو در گیاهان: شباهتها و تفاوتها با انسان
فسفریلاسیون اکسیداتیو (OXPHOS) نه تنها در سلولهای جانوری بلکه در سلولهای گیاهی نیز به عنوان مکانیزمی کلیدی برای تولید انرژی عمل میکند. اما برخلاف موجودات یوکاریوتی بدون کلروپلاست، گیاهان دارای دو ارگانل تولیدکننده انرژی هستند: میتوکندری و کلروپلاست. این دو اندامک اگرچه از نظر عملکردی با یکدیگر تعامل دارند، اما مسیرهای متابولیکی متفاوتی را دنبال میکنند. بررسی OXPHOS در گیاهان، تفاوتها و سازگاریهای جالبی را نسبت به سیستم انسانی آشکار میسازد.
ساختار و عملکرد زنجیره انتقال الکترون در گیاهان
زنجیره انتقال الکترون میتوکندریایی در گیاهان از لحاظ ساختار کلی مشابه انسان است، اما دارای اجزای منحصربهفردی نیز میباشد:
-
کمپلکسهای I تا V در گیاهان وجود دارند، اما علاوه بر آنها، مسیرهای جایگزین (Alternative Pathways ) نیز فعال هستند.
-
یکی از مهمترین این مسیرها شامل آنزیم AOX (Alternative Oxidase) است که الکترونها را مستقیماً از UQH₂ به اکسیژن منتقل میکند، بدون آنکه با کمپلکسهای III و IV تعامل داشته باشد.
-
این مسیر جایگزین برخلاف مسیر اصلی OXPHOS باعث تولید ATP نمیشود، اما به گیاه در شرایط استرس (مانند دمای بالا، کمبود اکسیژن یا وجود سموم) کمک میکند با جلوگیری از تولید ROS اضافی، زنده بماند.
حضور مسیرهای جایگزین در گیاهان
برخلاف سلولهای انسانی که به مسیر کلاسیک زنجیره تنفسی وابسته هستند، گیاهان دارای دو مسیر اضافی هستند:
-
AOX (Alternative Oxidase): در پاسخ به استرس اکسیداتیو فعال میشود و نقش تنظیمی در کنترل میزان ROS و حفظ تعادل رداکس ایفا میکند.
-
NDH (Type II NAD(P)H Dehydrogenases): گروهی از آنزیمها هستند که میتوانند NADH را به زنجیره انتقال الکترون وارد کنند، بدون نیاز به کمپلکس I.
این مسیرها انعطاف متابولیکی بیشتری به گیاهان میدهند و در سازگاری با محیط زیست نقش کلیدی دارند.
تعامل بین کلروپلاست و میتوکندری
در گیاهان، کلروپلاستها محل اصلی فتوسنتز و تولید NADPH و ATP در روز هستند، در حالی که میتوکندریها وظیفه تولید ATP را در شب و در شرایط غیرنوری به عهده دارند. اما این دو اندامک ارتباط نزدیکی با هم دارند:
-
میتوکندری با اکسید کردن NADH حاصل از فتوسنتز، به تنظیم تعادل انرژی در روز کمک میکند.
-
کلروپلاستها با تولید قند، زمینه را برای فعالسازی مسیرهای تنفسی میتوکندری در شب فراهم میکنند.
-
این همکاری باعث تقسیم کار انرژی و افزایش بهرهوری متابولیکی در سلولهای گیاهی میشود.
نقش OXPHOS در رشد و پاسخ به تنشهای زیستی و محیطی
در گیاهان، فسفریلاسیون اکسیداتیو علاوه بر تأمین انرژی برای رشد و توسعه، در پاسخ به عوامل تنشزا مانند خشکی، سرما، شوری، عفونتهای قارچی و باکتریایی نیز نقش دارد:
-
در شرایط تنش، مسیر AOX فعال شده و با کاهش تولید ROS، از آسیب اکسیداتیو به سلولها جلوگیری میکند.
-
برخی تنظیمکنندههای ژنی مانند ABI4 و ANAC017 نیز با تنظیم بیان ژنهای OXPHOS و AOX، پاسخ به تنش را کنترل میکنند.
-
مطالعات نشان دادهاند گیاهانی با بیان بالاتر AOX تحمل بهتری در برابر تنش دارند.
کاربردهای تحقیقاتی و بیوتکنولوژیک
درک عملکرد OXPHOS در گیاهان نه تنها در علوم پایه بلکه در کشاورزی و زیستفناوری نیز اهمیت دارد:
-
افزایش بهرهوری فتوسنتزی و تنفسی با مهندسی مسیرهای تنفسی برای تولید گیاهان مقاومتر به شرایط اقلیمی.
-
استفاده از مهارکنندههای AOX برای بررسی اثرات ROS در رشد گیاه.
-
تنظیم بیان ژنهای مربوط به زنجیره تنفسی برای بهبود تولید زیستتوده در گیاهان صنعتی و دارویی.
جمعبندی
فسفریلاسیون اکسیداتیو در گیاهان شباهت زیادی به فرآیند مشابه در انسان دارد، اما وجود مسیرهای جایگزین، تعامل با کلروپلاست و انعطافپذیری بالاتر در شرایط محیطی، وجه تمایز مهمی را ایجاد میکند. درک این تفاوتها میتواند به طراحی گیاهان مقاوم، افزایش بهرهوری انرژی و حتی توسعه داروهای جدید الهامبخش باشد.
نتیجهگیری و پاسخ به سوالات متداول متخصصان
فسفریلاسیون اکسیداتیو (OXPHOS) در میتوکندری، فرایندی کلیدی و پیچیده است که نقش اصلی را در تولید انرژی سلولی ایفا میکند. این فرایند متکی بر تعامل هماهنگ بین زنجیره انتقال الکترون، ATP سنتاز و سایر پروتئینهای مرتبط است. در طول مقاله، به شرح مفصل ساختار، عملکرد، و اهمیت فسفریلاسیون اکسیداتیو در شرایط فیزیولوژیکی و پاتولوژیکی پرداختیم و تأثیر آن در بیماریهایی مانند سرطان، بیماریهای نورودژنراتیو، پیری و استرس اکسیداتیو را بررسی کردیم.
همچنین تفاوتها و شباهتهای فسفریلاسیون اکسیداتیو در گیاهان و انسان را مطرح کردیم و کاربردهای بیوتکنولوژیک این دانش را توضیح دادیم. با پیشرفتهای اخیر در درک این فرایند، روشهای درمانی هدفمند علیه اختلالات مرتبط با OXPHOS در حال توسعه هستند که نویدبخش بهبود کیفیت زندگی بیماران میباشند.
پاسخ به سوالات متداول
۱. فسفریلاسیون اکسیداتیو چگونه ATP تولید میکند؟
فرآیند OXPHOS با انتقال الکترونها از NADH و FADH₂ به زنجیره انتقال الکترون آغاز میشود، که منجر به پمپاژ پروتونها به فضای بینمیتوکندریایی میگردد. این اختلاف غلظت پروتونها باعث ایجاد یک گرادیان الکتروشیمیایی شده و انرژی حاصل از آن توسط ATP سنتاز برای سنتز ATP از ADP و فسفات آزاد مصرف میشود.
۲. تفاوت اصلی بین فسفریلاسیون اکسیداتیو در گیاهان و انسان چیست؟
گیاهان علاوه بر مسیر کلاسیک OXPHOS، دارای مسیرهای جایگزین مانند AOX هستند که در شرایط استرس از تولید ROS جلوگیری میکند. همچنین کلروپلاستها در گیاهان نقش مهمی در تامین انرژی دارند که در انسان وجود ندارد.
۳. فسفریلاسیون اکسیداتیو چگونه در بیماریها نقش دارد؟
اختلال در OXPHOS میتواند منجر به کاهش تولید ATP، افزایش تولید گونههای فعال اکسیژن (ROS)، و آسیب سلولی شود که در بیماریهای مختلف مانند سرطان، نورودژنراتیوها و بیماریهای متابولیک دیده میشود.
۴. آیا میتوان فسفریلاسیون اکسیداتیو را به صورت هدفمند درمان کرد؟
بله، داروها و استراتژیهای نوینی در حال توسعه هستند که با هدفگیری مسیرهای خاص OXPHOS، میتوانند به درمان بیماریهایی مانند سرطان کمک کنند. مهندسی ژنتیکی و داروهای مهارکننده ATP سنتاز نمونههایی از این رویکردها هستند.
۵. نقش فسفریلاسیون اکسیداتیو در فرایند پیری چیست؟
افزایش استرس اکسیداتیو و کاهش کارایی OXPHOS با بالا رفتن سن همراه است که منجر به کاهش تولید ATP و آسیب به بافتها میشود، بنابراین فسفریلاسیون اکسیداتیو به طور مستقیم در فرایند پیری و کاهش عملکرد سلولی نقش دارد.
سخن پایانی
فسفریلاسیون اکسیداتیو یکی از مهمترین فرایندهای زیستی است که در تأمین انرژی سلولی نقش محوری دارد و به شدت تحت تأثیر شرایط فیزیولوژیکی و پاتولوژیکی قرار میگیرد. شناخت عمیقتر این فرایند و مکانیسمهای تنظیمی آن، چشماندازهای جدیدی برای درمان بیماریها و بهبود سلامت عمومی ایجاد کرده است. امید است که این مقاله توانسته باشد تصویری جامع و کامل از فسفریلاسیون اکسیداتیو ارائه دهد و پاسخگوی سوالات متخصصان و پژوهشگران حوزه زیستشناسی و پزشکی باشد.




