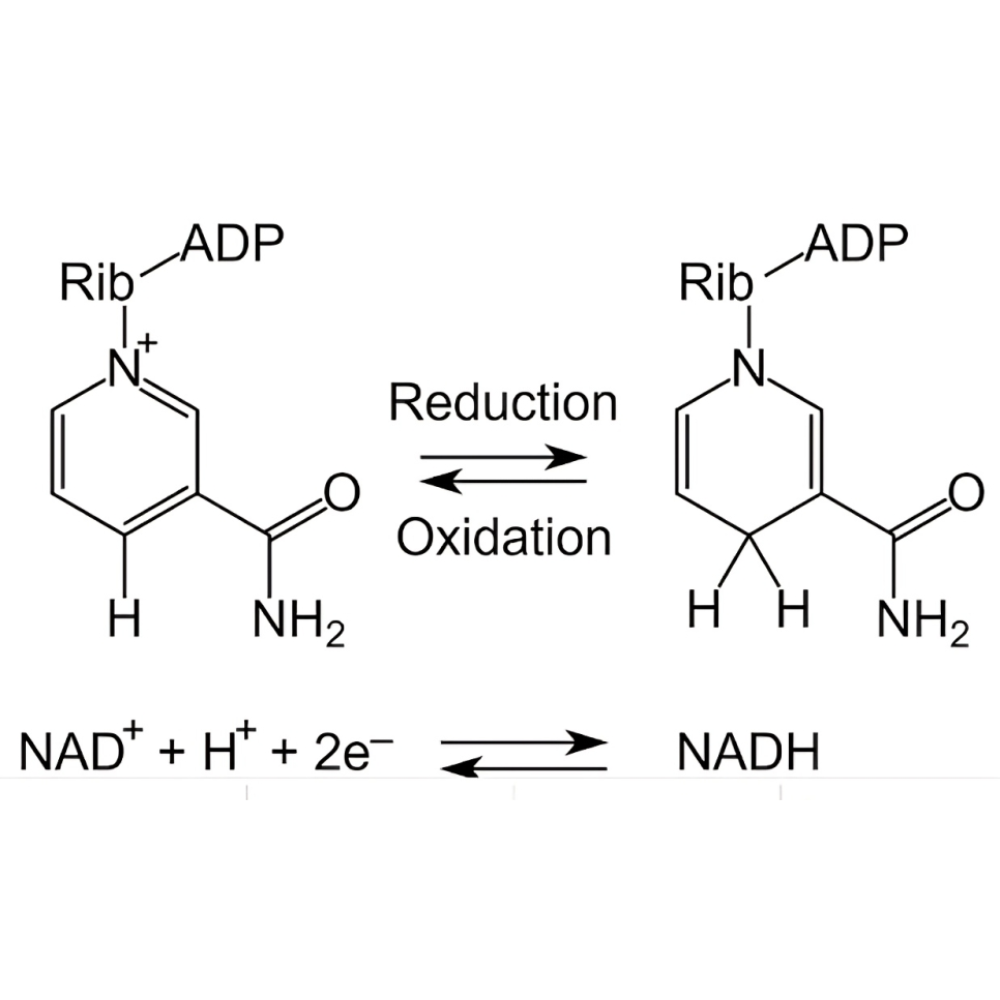
چگونه redox balance (NADH/NAD+) عملکرد متابولیک را تنظیم میکند؟
مقدمه
تعادل اکسایش–کاهش (Redox Balance) یکی از بنیادیترین مفاهیم در زیستشناسی سلولی و بیوشیمی متابولیک است. در قلب این تعادل، زوج کوآنزیمی NAD⁺/NADH قرار دارد؛ مولکولهایی که بهعنوان حاملهای الکترون در صدها واکنش بیوشیمیایی در بدن عمل میکنند. نقش حیاتی این کوفاکتورها در تنظیم تولید انرژی، کنترل استرس اکسیداتیو، تنظیم مسیرهای آنابولیک و کاتابولیک و حتی عملکرد ژنها بهقدری گسترده است که هرگونه برهمخوردگی در نسبت NAD⁺ به NADH میتواند پیامدهای متابولیکی جدی، از جمله بروز یا پیشرفت بیماریهای مزمن، داشته باشد.
در شرایط طبیعی، سلول با تنظیم دقیق نسبت NADH/NAD⁺، بین نیاز به انرژی (ATP) و حفظ هموستاز اکسیداتیو تعادل ایجاد میکند. این نسبت نهتنها بر فعالیت آنزیمهای کلیدی اثر میگذارد بلکه نقش تنظیمی در مسیرهای حیاتی مانند گلیکولیز، چرخه کربس، فسفریلاسیون اکسیداتیو و اکسیداسیون اسیدهای چرب ایفا میکند. همچنین، NAD⁺ بهعنوان پیشساز برخی آنزیمهای سیگنالدهی و اصلاح ژنتیکی نظیر PARP و sirtuins عمل میکند که در فرآیندهایی چون ترمیم DNA، پیری سلولی و تنظیم بیان ژن نقش کلیدی دارند.
بااینحال، در بسیاری از اختلالات متابولیکی مانند دیابت نوع ۲، کبد چرب، بیماریهای کلیوی، و حتی سرطان، تعادل NAD⁺/NADH بههم میریزد و منجر به افزایش NADH (وضعیت احیایی) یا کاهش NAD⁺ (وضعیت اکسیداتیو) میشود. این شرایط میتواند نهتنها تولید ATP را مختل کند، بلکه با افزایش تولید گونههای فعال اکسیژن (ROS)، استرس اکسیداتیو شدیدی به سلول وارد کرده و مسیرهای سیگنالی حیاتی را نیز دچار اختلال کند.
در این مقاله، به بررسی جامع و علمی نحوه عملکرد سیستم NAD⁺/NADH در تنظیم متابولیسم خواهیم پرداخت. از مکانیسمهای سلولی برای حفظ تعادل رداکس گرفته تا نقش این سیستم در بروز بیماریها و نیز راهکارهای درمانی مبتنی بر بازگرداندن این تعادل. هدف آن است که دیدگاهی چندبُعدی و مبتنی بر آخرین پژوهشهای علمی ارائه شود تا متخصصان زیستی، دارویی و پزشکی بتوانند از آن در تحلیل و طراحی راهکارهای نوین استفاده کنند.
این بررسی نهتنها پایهای قوی برای درک روابط بین تعادل رداکس و عملکرد متابولیک فراهم میآورد، بلکه بستری مناسب برای طراحی درمانهای هدفمند و ارتقاء سلامت عمومی از طریق کنترل سطح NAD⁺ فراهم میسازد.
نقش مولکولهای NAD⁺ و NADH در مسیرهای متابولیک اصلی
در سیستم متابولیک بدن انسان، مولکولهای NAD⁺ (نیکوتینآمید آدنین دینوکلئوتید اکسیدشده) و NADH (فرم احیاءشدهی آن) بهعنوان کلید واژههایی حیاتی شناخته میشوند. این دو شکل، یک جفت کوفاکتور هستند که در بسیاری از واکنشهای آنزیمی حضور دارند و نقش حیاتی در انتقال الکترون، تولید انرژی و تنظیم مسیرهای زیستی بازی میکنند. توانایی آنها در پذیرش و اهدا الکترون باعث میشود که قلب تپندهی فرآیندهای متابولیکی در سلول باشند.
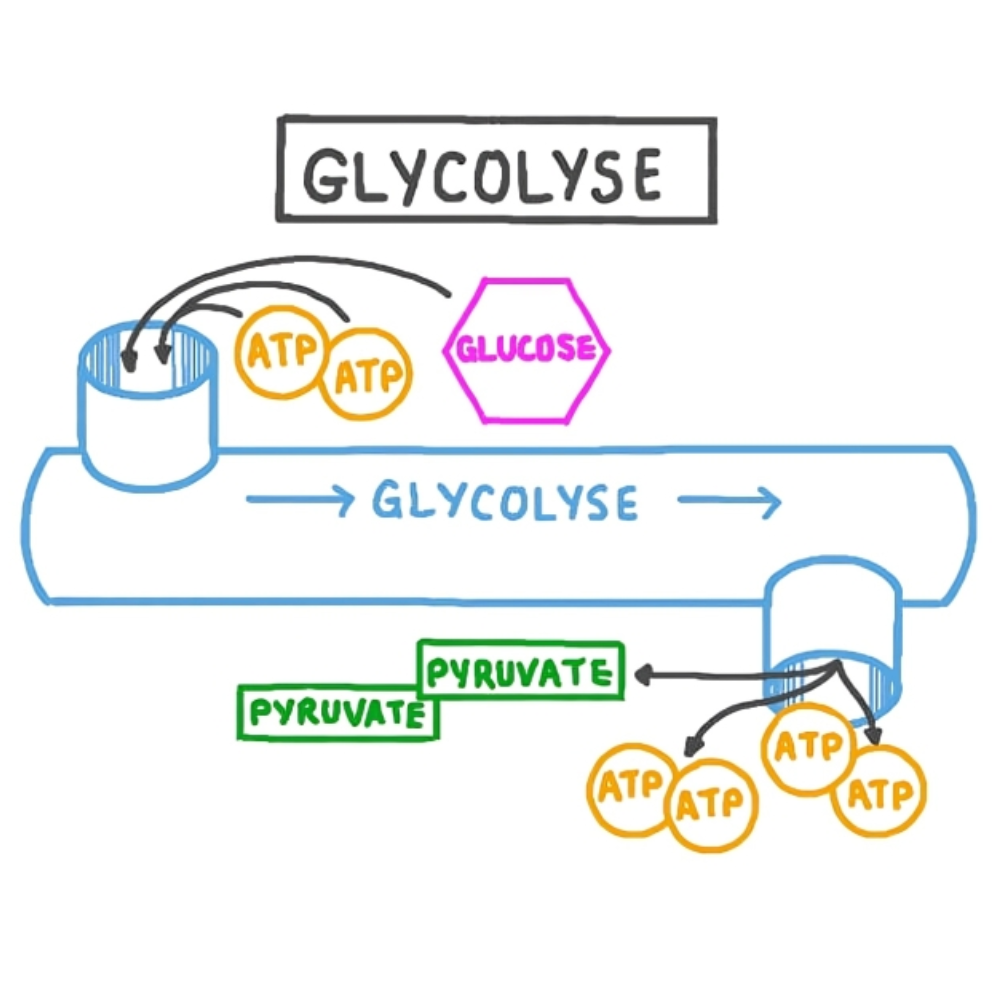
نقش در گلیکولیز
در مسیر گلیکولیز که در سیتوزول سلول رخ میدهد، گلوکز به پیرووات تجزیه میشود و طی این فرآیند، NAD⁺ بهعنوان کوفاکتور کلیدی در واکنش کاتالیزشده توسط آنزیم گلیسرآلدهید-۳-فسفات دهیدروژناز (GAPDH) شرکت میکند. در این واکنش، یک مولکول NAD⁺ یک الکترون دریافت کرده و به NADH تبدیل میشود. این مرحله نهتنها برای ادامه مسیر گلیکولیز حیاتی است بلکه ذخیرهای از انرژی الکترونی را در قالب NADH فراهم میکند که در شرایط هوازی وارد میتوکندری میشود.
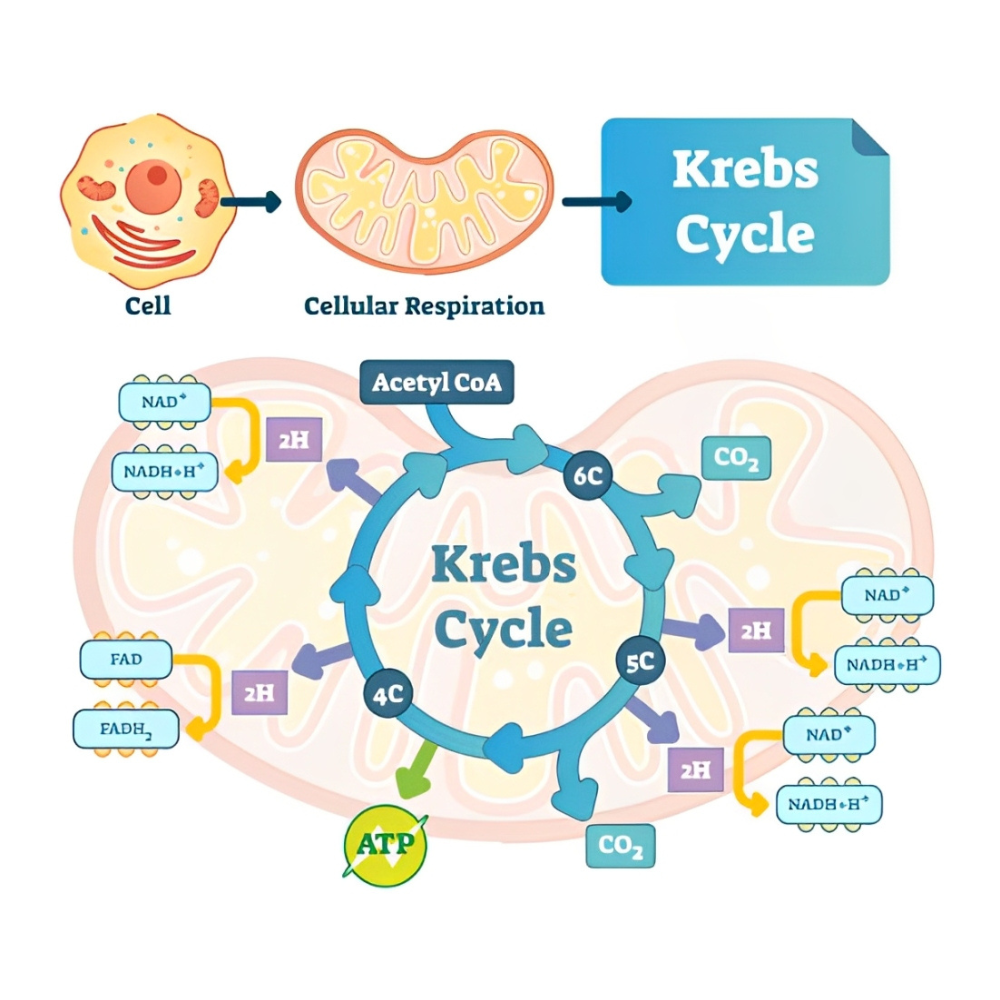
نقش در چرخه اسید سیتریک (چرخه کربس)
در ماتریکس میتوکندری، چرخه اسید سیتریک یا چرخه کربس اجرا میشود؛ فرآیندی که طی آن مولکولهای پیرووات حاصل از گلیکولیز به استیل-CoA تبدیل شده و وارد چرخه میشوند. در چندین مرحله کلیدی این چرخه، از جمله واکنشهای کاتالیزشده توسط ایزوسیترات دهیدروژناز، آلفا-کتوگلوتارات دهیدروژناز و مالات دهیدروژناز، مولکول NAD⁺ با گرفتن الکترون به NADH تبدیل میشود. این NADH های تولیدشده سپس به زنجیره انتقال الکترون هدایت میشوند.
نقش در زنجیره انتقال الکترون و تولید ATP
نقش اصلی NADH در مرحله بعدی، یعنی زنجیره انتقال الکترون است. NADH الکترونهای خود را به کمپلکس I (NADH:Ubiquinone oxidoreductase) در غشای داخلی میتوکندری میدهد. این الکترونها از طریق مجموعهای از کمپلکسهای غشایی منتقل میشوند و در این مسیر، باعث پمپ شدن پروتونها به فضای بینغشایی میشوند. این گرادیان پروتونی انرژی لازم برای ATP سنتاز را فراهم میکند تا مولکولهای ATP تولید شوند. در پایان، الکترونها به اکسیژن منتقل شده و آب تولید میشود. بنابراین، NADH مستقیماً در فرآیند فسفریلاسیون اکسیداتیو مشارکت دارد.
تفاوت عملکردی NAD⁺ و NADH در شرایط هوازی و بیهوازی
در شرایط هوازی، NADH حاصل از گلیکولیز و چرخه کربس وارد میتوکندری میشود و در زنجیره انتقال الکترون شرکت میکند. اما در شرایط بیهوازی (مانند درون عضله در حین ورزش شدید یا در بافتهایی با اکسیژن پایین)، انتقال الکترون به اکسیژن امکانپذیر نیست. در این شرایط، سلول باید راهی برای بازیافت NAD⁺ بیابد تا بتواند گلیکولیز را ادامه دهد. این وظیفه را فرآیند تخمیر بر عهده میگیرد؛ بهطوریکه پیرووات به لاکتات تبدیل میشود و NADH به NAD⁺ اکسید میشود، تا مسیر گلیکولیز فعال باقی بماند. این سیستم، گرچه منجر به تولید بسیار کمتر ATP میشود، اما برای بقا در شرایط هیپوکسی حیاتی است.
عملکرد بهعنوان حسگر انرژی در سلول
یکی دیگر از جنبههای کمتر شناختهشده اما بسیار حیاتی NAD⁺، نقش آن بهعنوان حسگر سطح انرژی در سلول است. آنزیمهایی نظیر SIRT1 و AMPK که به تغییرات سطح NAD⁺ حساس هستند، در واکنش به نسبت NAD⁺/NADH، مسیرهایی مانند اکسیداسیون اسیدهای چرب، گلوکونئوژنز، و بیوسنتز NAD⁺ را فعال یا مهار میکنند. بنابراین، NAD⁺ تنها یک حامل الکترون نیست بلکه بخشی از یک شبکه پیچیده تنظیمی در پاسخ به شرایط متابولیکی مختلف است.
کوفاکتور مشترک در بیش از ۴۵۰ واکنش آنزیمی
براساس مطالعات بیوشیمیایی، NAD⁺ و NADH در بیش از ۴۵۰ واکنش آنزیمی مختلف شرکت دارند که شامل مسیرهای متابولیک پایه مانند چرخه اوره، مسیر پنتوز فسفات، سنتز نوکلئوتیدها، و متابولیسم لیپیدها میشود. این گستردگی استفاده نشان میدهد که اختلال در نسبت NAD⁺/NADH میتواند اثری چنددامنهای بر کل متابولیسم داشته باشد.
مفهوم تعادل Redox و تأثیر آن بر هموستاز سلولی
درون هر سلول زنده، مجموعهای بیوقفه از واکنشهای اکسیداسیون و احیا (Redox) جریان دارد که پایه و اساس متابولیسم، سیگنالینگ سلولی، و تولید انرژی را تشکیل میدهد. تعادل بین حالت اکسیدشده مانند ( NAD⁺) و حالت احیاشده (مانند (NADH تحت عنوان تعادل رداکس شناخته میشود و این نسبت بهعنوان یکی از شاخصهای کلیدی وضعیت فیزیولوژیک سلول عمل میکند. در واقع، سلولها همواره در تلاش هستند تا این تعادل حساس را حفظ کنند، چرا که هرگونه برهمخوردن این توازن میتواند منجر به اختلالات متابولیکی، افزایش استرس اکسیداتیو و در نهایت مرگ سلولی شود.
نسبت NADH/NAD⁺؛ معیاری کلیدی در سلامت سلول
نسبت بین NADH و NAD⁺ بهعنوان شاخصی دقیق برای ارزیابی وضعیت Redox سلولی به کار میرود. در سلولهای سالم، این نسبت بهطور دینامیک و تنظیمشده باقی میماند. بهعنوان مثال، در سیتوزول نسبت NADH/NAD⁺ حدود 1 به 700 است، در حالیکه در میتوکندری این نسبت میتواند به 1 به 8 یا بیشتر برسد. این تفاوت در نسبتها بین محفظههای سلولی، نشاندهنده تنظیم موضعی مسیرهای متابولیکی است. حفظ این گرادیان برای کارکرد مناسب آنزیمهایی مانند دهیدروژنازها، آنزیمهای زنجیره انتقال الکترون، و تنظیمکنندههای متابولیسم حیاتی است.
تنظیم متابولیسم بر اساس وضعیت رداکس
بسیاری از آنزیمها و مسیرهای متابولیکی تنها در شرایط خاص رداکس فعال یا غیرفعال میشوند. برای نمونه، در شرایطی که نسبت NADH بالا باشد (وضعیت احیایی)، مسیرهایی مانند گلیکولیز تحریک شده و فعالیت چرخه کربس کاهش مییابد. از سوی دیگر، زمانیکه نسبت NAD⁺ بالاتر باشد، مسیرهای آنابولیک مانند گلوکونئوژنز، اکسیداسیون اسیدهای چرب، و فعالیت SIRT1 افزایش مییابد. به همین دلیل، نسبت NADH/NAD⁺ بهنوعی نقش ترموستات انرژی و متابولیسم سلولی را ایفا میکند.
تأثیر بر تنفس سلولی و تولید انرژی
در سطح میتوکندری، NADH منبع اصلی الکترون برای زنجیره انتقال الکترون است که از طریق آن ATP تولید میشود. اما زمانیکه میزان NADH بیش از حد بالا رود و NAD⁺ کاهش یابد، این زنجیره ممکن است دچار احتقان شود، چون بازسازی NAD⁺ از طریق فسفریلاسیون اکسیداتیو متوقف میشود. این مسئله نهتنها باعث کاهش تولید ATP میشود بلکه تولید گونههای فعال اکسیژن (ROS) نیز افزایش مییابد که زمینهساز آسیب به DNA ، پروتئینها و لیپیدهای سلولی است.
ارتباط با سیگنالینگ سلولی و بیان ژن
NAD⁺ تنها یک کوفاکتور متابولیکی نیست، بلکه یک مولکول سیگنالدهنده نیز هست. بسیاری از پروتئینهای تنظیمی مانند sirtuins، PARP1، و CD38 برای فعالیت خود نیاز به NAD⁺ دارند. برای مثال، sirtuins که دیاستیلازهای وابسته به NAD⁺ هستند، نقش مهمی در تنظیم بیان ژن، پیری سلولی، و پاسخ به استرس دارند. درصورتیکه سطح NAD⁺ کاهش یابد، عملکرد این آنزیمها مختل میشود و مسیرهای مرتبط با بازسازی سلول، ترمیم DNA، و تنظیم چرخه سلولی تحت تأثیر قرار میگیرند.
نقش در حفظ هموستاز آنتیاکسیدانی
تعادل NADH/NAD⁺ با تعادل NADPH/NADP⁺ نیز در ارتباط است و از طریق مسیر پنتوز فسفات و آنزیمهایی مانند مالیک آنزیم بر بازسازی گلوتاتیون احیایی (GSH) و دیگر آنتیاکسیدانها تأثیر میگذارد. در صورتی که نسبت NADH بالا رود، مسیر بازسازی NADPH نیز ممکن است دچار اختلال شده و توان آنتیاکسیدانی سلول کاهش یابد. این حالت باعث بروز استرس اکسیداتیو ثانویه و تخریب ساختارهای حیاتی سلول خواهد شد.
سیستمهای جبرانی برای حفظ تعادل
سلولها برای مقابله با اختلال در تعادل رداکس از مسیرهای متعددی بهره میبرند. از جمله:
-
سیستم لاکتات دهیدروژناز در شرایط بیهوازی که NAD⁺ را بازیافت میکند؛
-
مبدلهای سیستمی مانند shuttle malate-aspartate که نسبتهای رداکس را بین سیتوزول و میتوکندری تنظیم میکنند؛
-
فعالسازی AMPK که مصرف ATP را محدود و تولید NAD⁺ را افزایش میدهد.
این مسیرها نشان میدهند که تعادل رداکس نهتنها وابسته به شرایط متابولیکی بلکه به شبکه پیچیدهای از تنظیمات فیزیولوژیکی وابسته است.
Redox Imbalance : پیامدهای متابولیکی و بیماریزا
در شرایط فیزیولوژیک، نسبت بین NADH و NAD⁺ بهشکل دقیقی توسط سلول کنترل میشود تا واکنشهای متابولیکی، سیگنالدهی سلولی، و تولید انرژی بهدرستی انجام گیرد. اما در بسیاری از شرایط پاتولوژیک، این تعادل بههم میخورد و پدیدهای بهنام عدم تعادل رداکس (Redox Imbalance) یا اختلال در نسبت NADH/NAD⁺ رخ میدهد. این عدم تعادل، پیامدهای متعددی برای متابولیسم سلولی دارد و میتواند به شکلگیری اختلالات مزمن و تخریب ساختارهای زیستی بینجامد.
افزایش NADH و کاهش NAD⁺؛ زمینهساز وضعیت احیایی مخرب
یکی از رایجترین حالتهای عدم تعادل رداکس، افزایش غیرطبیعی سطح NADH در مقایسه با NAD⁺ است. این وضعیت که "Reductive Stress" یا استرس احیایی نام دارد، منجر به اختلال در بسیاری از مسیرهای متابولیک میشود. سطح بالای NADH میتواند فعالیت آنزیمهایی مانند دهیدروژنازها را مهار کرده، مسیرهای آنابولیک را سرکوب کند، و ظرفیت احیای NAD⁺ را کاهش دهد. این وضعیت در بیماریهایی مانند دیابت، نارسایی کلیوی و بیماریهای عضلانی بهوضوح مشاهده شده است.
تولید بیش از حد گونههای فعال اکسیژن (ROS)
یکی از پیامدهای اصلی Redox Imbalance، افزایش تولید ROS در میتوکندری است. زمانیکه NADH بیش از حد تولید شود و زنجیره انتقال الکترون دچار اشباع گردد، الکترونها ممکن است نشت کرده و با اکسیژن مولکولی واکنش دهند و رادیکالهای سوپراکسید تولید کنند. این گونههای فعال اکسیژن به DNA، پروتئینها و غشای سلولی آسیب میزنند و موجب استرس اکسیداتیو گسترده میشوند. از اینرو، Redox Imbalance میتواند همزمان منجر به استرس احیایی و استرس اکسیداتیو شود؛ دو وضعیت که هر دو برای عملکرد سلولی زیانبارند.
نارسایی میتوکندری و افت تولید ATP
عدم تعادل NADH/NAD⁺ بهطور مستقیم عملکرد میتوکندری را هدف قرار میدهد. در شرایطی که میزان NAD⁺ کاهش یابد، آنزیمهای وابسته به NAD⁺ مانند کمپلکس I و دهیدروژنازهای چرخه کربس قادر به فعالیت بهینه نخواهند بود. نتیجه این فرآیند، کاهش ظرفیت سلول برای تولید ATP از طریق فسفریلاسیون اکسیداتیو است. در چنین حالتی، سلولها به مسیرهای کمتر کارآمد مانند گلیکولیز وابسته میشوند که خود موجب تجمع لاکتات، کاهش pH و افزایش آسیبهای متابولیکی ثانویه میشود.
اختلال در مسیرهای سیگنالی وابسته به NAD⁺
NAD⁺ تنها یک کوفاکتور متابولیکی نیست، بلکه در تنظیم مسیرهای سیگنالینگ حیاتی نیز نقش ایفا میکند. کاهش سطح NAD⁺ باعث مهار فعالیت آنزیمهایی نظیر:
-
SIRT1 ( مهم در تنظیم پیری سلولی، بیان ژن و پاسخ به گرسنگی سلولی)
-
PARP1 (مهم در ترمیم DNA )
-
CD38 (درگیر در کلسیم سیگنالینگ و ایمنی(
میشود. کاهش فعالیت این آنزیمها منجر به اختلال در چرخه سلولی، افزایش آسیبهای ژنتیکی، و تشدید پاسخهای التهابی میشود که همگی در بروز بیماریهای مزمن مانند سرطان، آلزایمر و اختلالات متابولیک نقش دارند.
نقش Redox Imbalance در دیابت و سندرم متابولیک
مطالعات متعددی نشان دادهاند که در بیماران مبتلا به دیابت نوع ۲، سطح NAD⁺ کاهش و سطح NADH افزایش مییابد. این تغییر نهتنها در تنظیم گلوکز و انسولین اختلال ایجاد میکند، بلکه با افزایش تولید ROS، باعث آسیب به سلولهای بتای پانکراس، تسریع در مقاومت به انسولین و تخریب بافتهای هدف (کلیه، چشم، اعصاب محیطی) میشود. همچنین مسیر پلیال (Polyol Pathway) که در شرایط هایپرگلیسمی فعال میشود، با مصرف NADPH و افزایش NADH، نقش مهمی در تشدید Redox Imbalance در دیابت دارد.
افزایش آسیب به DNA و مرگ سلولی
افزایش استرس اکسیداتیو ناشی از عدم تعادل رداکس میتواند آسیب گستردهای به DNA هستهای و میتوکندریایی وارد کند. این آسیبها منجر به فعالسازی بیش از حد PARP1 میشوند که از NAD⁺ بهعنوان سوبسترا برای ترمیم DNA استفاده میکند. استفاده مفرط از NAD⁺ توسط PARP1 میتواند ذخایر NAD⁺ سلولی را خالی کند، و در نهایت منجر به فروپاشی متابولیسم و مرگ برنامهریزیشده سلول (Apoptosis) گردد.
تخریب پیشرونده بافتها و تسریع روند پیری
عدم تعادل پایدار در نسبت NADH/NAD⁺ نهتنها به ایجاد بیماریهای حاد میانجامد، بلکه در درازمدت باعث کاهش ظرفیت ترمیم بافتها، افزایش التهاب مزمن، و تسریع روند پیری بیولوژیکی میشود. سطح پایین NAD⁺ در سالمندان با کاهش عملکرد میتوکندری، افزایش خستگی، اختلال در ترمیم عضلات و افزایش احتمال بروز بیماریهای تحلیلبرنده عصبی مرتبط است.
نقش تعادل NADH/NAD⁺ در بیماریهای متابولیک
تعادل دقیق میان NAD⁺ و NADH برای حفظ سلامت سلولی، عملکرد اندامها و تنظیم متابولیسم ضروری است. برهمخوردن این تعادل در بسیاری از بیماریهای مزمن نقش مرکزی دارد، بهویژه در اختلالات متابولیکی که با مقاومت به انسولین، التهاب مزمن و استرس اکسیداتیو همراه هستند. در این بخش، به تحلیل نقش نسبت NAD⁺/NADH در بروز و پیشرفت برخی از مهمترین بیماریهای متابولیک میپردازیم.
دیابت نوع ۲ و عدم تعادل رداکس
در بیماران دیابتی، بهویژه دیابت نوع ۲، هموستاز NAD⁺/NADH بهشدت مختل میشود. افزایش سطح گلوکز خون، منجر به فعال شدن مسیرهای متابولیکی خاصی مانند مسیر پلیال میشود که در آن گلوکز به سوربیتول و سپس به فروکتوز تبدیل میشود. این مسیر با مصرف NADPH و تولید NADH، نسبت NADH/NAD⁺ را بهطور غیرطبیعی افزایش میدهد. نتیجه این فرآیند، استرس احیایی، افزایش ROS، آسیب میتوکندریایی و در نهایت، اختلال در ترشح انسولین و پاسخ سلولهای هدف به آن است.
افزون بر این، نسبت پایین NAD⁺ بر فعالیت آنزیمهایی مانند SIRT1 که در تنظیم حساسیت به انسولین نقش دارند، اثر منفی میگذارد. مطالعات نشان دادهاند که افزایش سطح NAD⁺ یا استفاده از پیشسازهای آن مانند NMN میتواند حساسیت به انسولین را بهبود دهد و متابولیسم گلوکز را تنظیم کند.
نفروپاتی دیابتی و اختلال در متابولیسم کلیوی
در کلیههای بیماران دیابتی، تجمع NADH و کاهش نسبی NAD⁺ منجر به اختلال در عملکرد میتوکندری سلولهای اپیتلیالی و آسیب گلومرولی میشود. سطح بالای گلوکز همچنین باعث افزایش متابولیسم در مسیر پلیال و افزایش استیلدار شدن پروتئینها از طریق مهار SIRT1 میشود که این عوامل با افزایش التهاب، فیبروز و نارسایی تدریجی کلیه در ارتباط هستند.
مطالعهای منتشرشده در Biomolecules نشان داد که بازگرداندن تعادل NAD⁺/NADH در مدلهای حیوانی دیابت توانسته تا حدی عملکرد کلیوی را بهبود بخشد و بیان ژنهای مرتبط با استرس اکسیداتیو و فیبروز را تعدیل کند. این یافتهها بر نقش محوری NAD⁺ در سلامت بافت کلیه تأکید دارد.
بیماری کبد چرب الکلی و غیرالکلی
در کبد، نسبت NAD⁺/NADH یکی از عوامل کلیدی در تنظیم متابولیسم لیپیدها، گلوکز و متابولیسم اتانول است. مصرف مزمن الکل یا دریافت بیشازحد انرژی از رژیم غذایی، منجر به تجمع NADH میشود که مانع از اکسیداسیون اسیدهای چرب و افزایش سنتز چربیها در سلولهای کبدی میگردد. نتیجه این فرآیند، تجمع چربی در کبد و ایجاد حالت کبد چرب الکلی یا غیرالکلی است.
در حالت نرمال، NAD⁺ بهعنوان کوفاکتور اصلی برای آنزیمهایی مانند SIRT1 و AMPK عمل کرده و متابولیسم چربی را هدایت میکند. کاهش NAD⁺ باعث اختلال در این مسیرها و افزایش التهاب کبدی، استئاتوز و مقاومت به انسولین میشود. پژوهشها حاکی از آن هستند که تقویت مسیرهای تولید NAD⁺ از طریق مکملهای تغذیهای یا اصلاح سبک زندگی، میتواند در کنترل یا پیشگیری از پیشرفت کبد چرب مؤثر باشد.
بیماریهای عضلانی و اختلال در تولید انرژی
در بافتهای عضلانی، بهویژه در بیماریهایی مانند میوپاتیهای میتوکندریایی، دیستروفی عضلانی یا خستگی مزمن، عدم تعادل NADH/NAD⁺ یکی از عوامل پاتولوژیک مهم است. سطح پایین NAD⁺ منجر به کاهش فعالیت کمپلکسهای زنجیره تنفسی، افت تولید ATP و آسیب به فیبرهای عضلانی میشود.
همچنین، فعالیت sirtuinها و آنزیمهایی مانند PGC-1α که در تنظیم بیوژنز میتوکندری نقش دارند، با کاهش NAD⁺ مهار میشود. این موضوع باعث افت ظرفیت اکسیداتیو عضله و کاهش تحمل به فعالیت فیزیکی میگردد. بازسازی سطح NAD⁺ در این بیماران، پتانسیل بالقوهای برای بهبود عملکرد عضله و افزایش کیفیت زندگی دارد.
پیری سلولی و بیماریهای تحلیلبرنده عصبی
پیری و بسیاری از بیماریهای نورودژنراتیو مانند آلزایمر، پارکینسون و ALS نیز با کاهش سطح NAD⁺ و افزایش استرس رداکس مرتبط هستند. این بیماریها با کاهش فعالیت آنزیمهای ترمیم DNA، کاهش فعالیت میتوکندری و افزایش التهاب مزمن همراهند. نقش NAD⁺ در فعالسازی آنزیمهایی مانند SIRT1، PARP1 و CD38 که در تنظیم زندهمانی نورونها مؤثرند، بهخوبی در مطالعات حیوانی و بالینی به اثبات رسیده است.
مکانیزمهای سلولی برای حفظ تعادل NADH/NAD⁺
نسبت NAD⁺/NADH یکی از شاخصهای کلیدی وضعیت رداکس درونسلولی است و حفظ آن برای عملکرد صحیح متابولیسم، تنظیم بیان ژن، حفظ انرژی و مقابله با استرسهای اکسیداتیو حیاتی است. سلولها بهمنظور تنظیم این نسبت، از مجموعهای از مکانیزمهای بیوشیمیایی، آنزیمی و تنظیمی بهره میبرند که شامل تنظیم مسیرهای تولید و مصرف، بازچرخش NAD⁺، و تنظیم فعالیتهای میتوکندری و آنزیمهای مرتبط با رداکس است.
مسیرهای بازیابی NAD⁺ از پیشسازها
یکی از اصلیترین راهکارهای سلول برای حفظ سطح NAD⁺، استفاده از مسیرهای نجاتدهنده یا salvage pathways است. در این مسیرها، پیشسازهایی مانند نیکوتینامید (NAM)، نیکوتینیک اسید (NA) و نیکوتینامید ریبوزید (NR) وارد سلول شده و از طریق آنزیمهای اختصاصی مانند NAMPT (برای NAM) و (NAPRT (برای NA به NAD⁺ ) تبدیل میشوند. این مسیرها بهویژه در بافتهایی با سرعت مصرف بالای NAD⁺، مانند مغز و عضله، نقش مهمی ایفا میکنند.
در شرایطی که مصرف NAD⁺ افزایش مییابد – مانند هنگام فعالیت آنزیمهایی نظیر PARP یا CD38 در پاسخ به استرس – این مسیرهای نجاتدهنده برای بازسازی NAD⁺ فعال میشوند و از افت شدید سطح آن جلوگیری میکنند. مطالعات بالینی نیز نشان دادهاند که مکملسازی با NR یا NMN میتواند سطح NAD⁺ را بهطور مؤثر در بدن افزایش دهد.
نقش مسیرهای تنفسی در بازسازی NAD⁺
در سلولهای هوازی، سیستم زنجیره انتقال الکترون در میتوکندری نقش کلیدی در بازسازی NAD⁺ ایفا میکند. در این فرآیند، NADH الکترونهای خود را به کمپلکس I منتقل کرده و به NAD⁺ اکسید میشود. این فرآیند به تولید ATP و حفظ سطح بالای NAD⁺ درون ماتریکس میتوکندری منجر میشود.
در شرایطی که عملکرد میتوکندری مختل شود – مانند در پیری، بیماریهای متابولیک یا استرس اکسیداتیو – میزان بازسازی NAD⁺ کاهش یافته و نسبت NADH/NAD⁺ بهطور خطرناکی تغییر میکند. به همین دلیل، حفظ سلامت میتوکندری برای تنظیم رداکس و انرژی سلولی ضروری است.
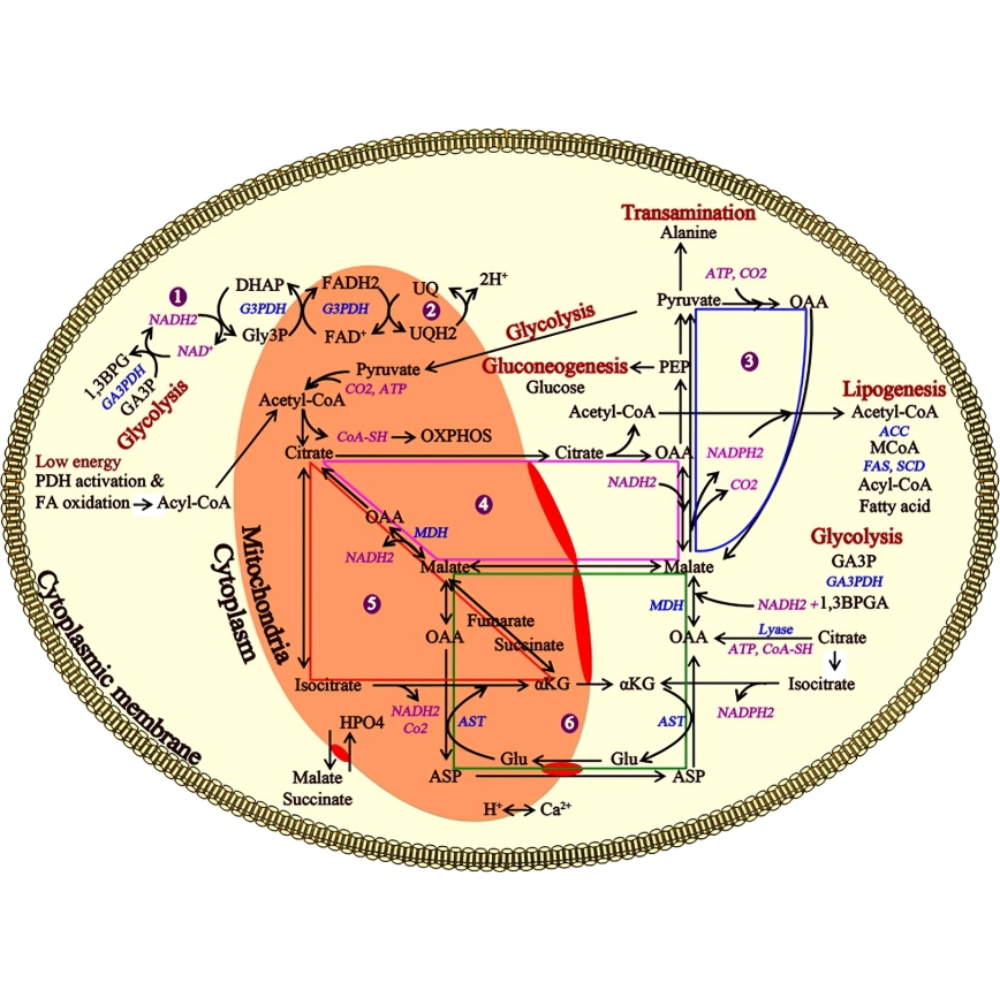
انتقالدهندههای Redox بین سیتوزول و میتوکندری
از آنجا که غشای داخلی میتوکندری نسبت به NAD⁺ و NADH نفوذناپذیر است، سلول از شاتلهای انتقال الکترون برای حفظ تعادل بین دو محیط استفاده میکند. از مهمترین این شاتلها میتوان به شاتل مالات-آسپارتات و شاتل گلیسرول-فسفات اشاره کرد. این سیستمها امکان انتقال غیرمستقیم الکترونها از NADH سیتوزولی به میتوکندری را فراهم میکنند و در تنظیم تعادل NADH/NAD⁺ نقش اساسی دارند.
در سلولهایی مانند نورونها و سلولهای کبدی، این شاتلها در پاسخ به نوسانات شدید در تقاضای انرژی فعال میشوند و از تجمع NADH در سیتوزول و اختلال در گلیکولیز جلوگیری میکنند.
تنظیم فعالیت آنزیمهای وابسته به NAD⁺
سلولها از مکانیسمهای تنظیمی خاصی برای مهار یا فعالسازی آنزیمهای مصرفکننده NAD⁺ استفاده میکنند. برای مثال، SIRT1، که به NAD⁺ وابسته است، در صورت کاهش سطح NAD⁺ فعالیتش کاهش مییابد و این موضوع میتواند به تنظیم منفی مسیرهایی مانند التهاب، متابولیسم چربی و پیری سلولی منجر شود. از سوی دیگر، آنزیمهایی مانند CD38 و PARP که مقادیر زیادی NAD⁺ را در پاسخ به آسیب DNA یا تحریکات ایمنی مصرف میکنند، در شرایط استرس مزمن فعالتر شده و ذخایر NAD⁺ را بهسرعت کاهش میدهند.
تعدیل فعالیت این آنزیمها از طریق بازخورد منفی، تنظیم بیان ژن، یا استفاده از مهارکنندههای دارویی یکی از استراتژیهای سلولی برای حفظ تعادل NAD⁺/NADH است.
نقش روزهداری، ورزش و سبک زندگی
مطالعات نشان دادهاند که روزهداری متناوب، فعالیت فیزیکی منظم و محدودیت کالری میتوانند سطح NAD⁺ را افزایش دهند و به فعالسازی مسیرهای SIRT1 و افزایش سلامت متابولیکی منجر شوند. این عوامل با بهبود عملکرد میتوکندری، افزایش بیان آنزیمهای بازیاب NAD⁺، و مهار مسیرهای التهابی مرتبط هستند.
این یافتهها نشان میدهند که علاوه بر فرآیندهای درونسلولی، شرایط محیطی و سبک زندگی نیز تأثیر قابلتوجهی بر تعادل NAD⁺/NADH دارند.
پاسخ سلولی به اختلال در تعادل رداکس
سلولها برای حفظ هموستاز رداکس بهشدت به نسبت دقیق NAD⁺/NADH وابسته هستند. اما در شرایط پاتولوژیک یا استرسزا، این تعادل ممکن است بههم بخورد و بهدنبال آن، واکنشهای پیچیدهای در سطح سلولی فعال شود. این پاسخها با هدف جبران استرس اکسیداتیو، بازگرداندن تعادل انرژی، ترمیم آسیبهای مولکولی و جلوگیری از مرگ سلولی طراحی شدهاند. در ادامه، مهمترین محورهای واکنش سلولی به اختلال در تعادل رداکس بررسی میشود.
فعالسازی مسیر پاسخ به استرس اکسیداتیو
یکی از نخستین واکنشهای سلول به اختلال در تعادل رداکس، فعال شدن مسیر Nrf2-Keap1 است. Nrf2 (nuclear factor erythroid 2–related factor 2) یک فاکتور رونویسی کلیدی در تنظیم پاسخ آنتیاکسیدانی است. در حالت عادی، Keap1 از تجمع Nrf2 جلوگیری میکند، اما در شرایط اکسیداتیو، Keap1 اکسیده شده و Nrf2 آزاد میشود و به هسته منتقل میگردد. در آنجا، بیان ژنهای آنتیاکسیدانی مانند HO-1، NQO1 و GCLC را القا میکند.
این پاسخ باعث افزایش ظرفیت آنتیاکسیدانی سلول، تسهیل در بازسازی گلوتاتیون و کاهش ROS میشود. اگرچه این مکانیسم محافظتی است، اما در مواجهه با استرس شدید یا مزمن، ممکن است کفایت نکند.
تنظیم مسیرهای متابولیکی برای بازگرداندن نسبت NAD⁺/NADH
سلولها در شرایط کاهش شدید NAD⁺ یا تجمع NADH، اقدام به بازآرایی مسیرهای متابولیکی میکنند. برای مثال:
-
کاهش گلیکولیز هوازی و هدایت پیروات به لاکتات، که منجر به اکسیداسیون NADH به NAD⁺ در سیتوزول میشود.
-
افزایش β-اکسیداسیون اسیدهای چرب در میتوکندری، که با بهبود نسبت NAD⁺/NADH همراه است.
-
مهار چرخه TCA در شرایطی که NAD⁺ کم باشد، برای جلوگیری از تجمع NADH اضافی.
این تنظیمات متابولیکی موقتی بوده و با هدف جبران تغییرات کوتاهمدت در نسبت رداکس انجام میگیرد.
آغاز مکانیسمهای ترمیم DNA و کنترل چرخه سلولی
عدم تعادل رداکس میتواند به آسیب DNA منجر شود که بهنوبه خود، پاسخهایی مانند فعالسازی آنزیم PARP و توقف چرخه سلولی از طریق p53 را بهدنبال دارد. PARP با استفاده از NAD⁺ برای افزودن زنجیرههای ADP-ribose به پروتئینهای ترمیمی، نقش مهمی در پاسخ به آسیب DNA دارد. با این حال، فعالیت بیشازحد PARP میتواند ذخایر NAD⁺ را تخلیه کرده و خود به تشدید اختلال منجر شود.
در چنین شرایطی، سلول ممکن است با ورود به فاز G1 یا G2/M چرخه سلولی، زمان لازم برای ترمیم را فراهم کند. در صورتی که آسیب ترمیمناپذیر باشد، مسیرهای آپوپتوز یا اتوفاژی فعال میشوند.
القای مسیرهای مرگ برنامهریزیشده یا خودخوری
در مواجهه با اختلال پایدار در رداکس و ناتوانی در بازگرداندن تعادل، سلول بهطور برنامهریزیشده به سوی مرگ سوق داده میشود. دو مکانیسم اصلی در این زمینه عبارتاند از:
-
آپوپتوز: که با فعال شدن کاسپازها و آزادسازی سیتوکروم c از میتوکندری همراه است.
-
اتوفاژی: (autophagy) که با هدف حذف میتوکندریهای آسیبدیده و بازیافت اجزای سلولی انجام میشود. این فرآیند ممکن است به بقا یا مرگ سلولی منجر شود بسته به شدت استرس.
اتوفاژی نقش حیاتی در حذف میتوکندریهای با عملکرد ناقص (mitophagy) دارد که منبع اصلی تولید ROS هستند. بنابراین، تقویت این مسیر میتواند راهبردی در کاهش آسیبهای ناشی از اختلال رداکس باشد.
تعامل با سیستم ایمنی و التهاب
اختلال رداکس میتواند با فعالسازی NLRP3 inflammasome و افزایش تولید سایتوکاینهای پیشالتهابی مانند IL-1β و TNF-α، پاسخهای ایمنی و التهابی را تشدید کند. این فرآیند بهویژه در بیماریهای مزمن مانند دیابت نوع ۲ یا کبد چرب غیرالکلی دیده میشود، جایی که التهاب مزمن و اختلال رداکس یکدیگر را تقویت میکنند.
همچنین، در سلولهای ایمنی مانند ماکروفاژها و لنفوسیتها، نسبت NAD⁺/NADH بر قطبیت عملکردی آنها تأثیر میگذارد. برای مثال، کاهش NAD⁺ میتواند تمایل به پاسخ التهابی (M1) را تقویت کند و از پاسخ ضدالتهابی (M2) بکاهد.
نقش مسیرهای جایگزین برای بازسازی NAD⁺
نسبت NAD⁺/NADH یکی از حساسترین شاخصهای وضعیت متابولیک و اکسیدو-احیایی سلول است. در شرایطی که این نسبت بههم بخورد، حفظ سطح مناسب NAD⁺ بهویژه برای عملکرد مناسب آنزیمهایی مانند SIRTUINها، PARPها، و آنزیمهای چرخه TCA حیاتی است. از آنجا که سنتز de novo NAD⁺ از اسید آمینه تریپتوفان فرایندی انرژیبر و کند است، سلولها عمدتاً از مسیرهای جایگزین برای بازسازی سریعتر آن بهره میبرند. این مسیرها از پیشسازهای مختلفی مانند نیکوتینآمید، نیکوتینیک اسید، و ریبوزید نیکوتینآمید استفاده میکنند.
مسیر بازیافت نیکوتینآمید (salvage pathway)
مهمترین و سریعترین مسیر بازسازی NAD⁺ در اکثر سلولهای یوکاریوتی، مسیر بازیافت نیکوتینآمید است. در این مسیر:
-
نیکوتینآمید (NAM)، که محصول جانبی واکنشهای مصرف NAD⁺ توسط آنزیمهایی نظیر PARP و sirtuin است، توسط آنزیم نیکوتینآمید فسفوریبوزیل ترانسفراز (NAMPT) به نیکوتینآمید مونو نوکلئوتید (NMN) تبدیل میشود.
-
NMN سپس توسط NMN آدنیلیل ترانسفراز (NMNAT) به NAD⁺ تبدیل میگردد.
این مسیر نقش محوری در حفظ سطح NAD⁺ بهویژه در شرایط استرس متابولیک، پیری، و فعالسازی بیشازحد PARP دارد. فعالیت NAMPT، بهویژه در بافتهایی مانند مغز، عضله و کبد، تنظیمکننده اصلی دینامیک NAD⁺ محسوب میشود.
مسیر نیکوتینیک اسید (Preiss-Handler Pathway)
در این مسیر، نیکوتینیک اسید (NA) یا نیاسین به NAD⁺ تبدیل میشود:
-
نیکوتینیک اسید توسط آنزیم نیکوتینیک اسید فسفوریبوزیل ترانسفراز (NAPRT) به نیکوتینیک اسید مونو نوکلئوتید (NaMN) تبدیل میشود.
-
NaMN سپس به NAD⁺ تبدیل میشود، مشابه مرحله نهایی در مسیر salvage .
این مسیر بیشتر در شرایطی فعال میشود که نیکوتینآمید ناکافی است یا مسیر salvage دچار اختلال شده است. همچنین، نیکوتینیک اسید یکی از ویتامینهای B3 است و مصرف غذایی آن نقش حمایتی در حفظ ذخایر NAD⁺ دارد.
مسیر نیکوتینآمید ریبوزید (NR Pathway)
نیکوتینآمید ریبوزید (NR) یک پیشساز نوظهور و جذاب برای بازسازی NAD⁺ است که از طریق:
-
تبدیل به NMN توسط نیکوتینآمید ریبوزید کیناز (NRK)،
-
و سپس تبدیل به NAD⁺ توسط NMNAT ،
در بازسازی سریع ذخایر NAD⁺ نقش دارد.
این مسیر در سالهای اخیر بسیار مورد توجه تحقیقات پزشکی و ضدپیری قرار گرفته و مکملهای NR بهعنوان عوامل افزایشدهنده سطح NAD⁺ معرفی شدهاند. ویژگی کلیدی این مسیر، قابلیت جذب مستقیم NR از رژیم غذایی یا مکملها و تبدیل سریع آن به NAD⁺ بدون دخالت نیکوتینآمید است.
مسیر سنتز de novo از تریپتوفان
اگرچه این مسیر انرژیبر و چندمرحلهای است، اما در برخی شرایط خاص مانند کمبود ویتامینهای B3 یا در بافتهایی با فعالیت بالای سنتزی (مانند کبد)، مسیر de novo برای تولید NAD⁺ از تریپتوفان فعال میشود. این مسیر به مسیر کینورنین معروف است و در فرآیندهای ایمنی، نوروتراسمیترها، و حتی پیشرفت برخی سرطانها نیز نقش دارد.
مزایا و محدودیتهای مسیرهای جایگزین
|
مزیتها |
محدودیتها |
مسیر |
|
سریع، انرژیکم، فراگیر |
محدود به فعالیت NAMPT، سرکوب در پیری |
مسیر بازیافت NAM |
|
مستقل از NAMPT، پشتیبان در کمبود NAM |
نیاز به NAPRT، کارایی پایینتر در برخی سلولها |
مسیر NA |
|
جذب بالا، مکملپذیر |
نیاز به NRK، هنوز در حال مطالعه بالینی |
مسیر NR |
|
مستقل از ویتامینها |
پیچیده، انرژیبر، کند |
مسیر de novo |
در مجموع، مسیرهای جایگزین بازسازی NAD⁺ به سلولها این امکان را میدهند که در شرایط متنوع، ذخایر NAD⁺ را حفظ کرده و پاسخ مؤثری به استرس اکسیداتیو یا متابولیکی بدهند. بهرهگیری از این مسیرها نهتنها در سطح سلولی، بلکه بهعنوان هدفهای درمانی در بیماریهایی نظیر دیابت، سرطان، نورودژنراسیون و پیری مورد توجه روزافزون قرار گرفته است.
تعادل رداکس در سلولهای غیر انسانی
موجودات غیر انسانی نیز مانند سلولهای انسانی با چالش حفظ تعادل میان اکسیدانها و احیاکنندهها مواجه هستند. با این حال، استراتژیها و مسیرهای تنظیمی آنها، بسته به شرایط محیطی و نوع متابولیسم، تفاوتهایی بنیادین دارد. در این بخش، سه گروه مهم یعنی قارچها، باکتریها و گیاهان بررسی میشوند.
قارچها: تعادل رداکس و سازگاری با محیط
قارچها مانند Saccharomyces cerevisiae یا Candida albicans در شرایط محیطی متغیر، تعادل رداکس را از طریق مکانیسمهای دقیق کنترل میکنند. این سازوکارها به آنها امکان رشد در محیطهایی با سطح پایین اکسیژن یا در مواجهه با استرس اکسیداتیو شدید را میدهند.
مهمترین ویژگیهای تنظیم رداکس در قارچها:
-
استفاده از مسیرهای جایگزین مانند تنفس آئرابیک/آنائرابیک و تخمیر اتانولی برای بازسازی NAD⁺ از NADH.
-
تنظیم آنزیمهای احیاکننده مانند گلوتاتیون ردوکتاز، تیوردوکسین سیستم و کاتالازها برای مقابله با ROS .
-
استفاده از گیرندههای رداکس وابسته به NAD⁺ بهعنوان تنظیمکننده بیان ژن در پاسخ به تغییرات محیطی.
قارچها از این مکانیسمها نهتنها برای بقاء بلکه برای تغییر شکل (مورفولوژی) و تهاجم در میزبان انسانی نیز بهره میگیرند. به همین دلیل، در تحقیقات مرتبط با بیماریزایی قارچها، مسیرهای رداکس بهعنوان اهداف درمانی مطرح هستند.
باکتریها: انعطافپذیری متابولیک و تعادل رداکس
در باکتریها، بهویژه در گونههایی مانند Escherichia coli یا Lactobacillus spp.، تعادل NADH/NAD⁺ یکی از عناصر کلیدی در تنظیم مسیرهای کاتابولیک و آنابولیک است. باکتریها با استفاده از مسیرهای متنوع انرژیزایی، قادر به بازسازی NAD⁺ حتی در غیاب اکسیژن هستند.
ویژگیهای کلیدی:
-
تخمیر لاکتیک، اتانولی، بوتیریک و سایر مسیرهای تخمیری برای مصرف NADH و بازسازی NAD⁺.
-
استفاده از تنفس نیتراتی یا سولفاتی بهعنوان جایگزین تنفس هوازی.
-
فعالیت آنزیمهایی مانند NADH dehydrogenase و ferredoxin-NAD⁺ reductase برای تنظیم پویای نسبت NAD⁺/NADH .
در باکتریهای فتوسنتزکننده، مانند Rhodobacter, حتی تعادل رداکس در چرخه نوری و تاریکی تنظیم میشود تا از تولید بیشازحد ROS جلوگیری گردد.
در زمینه بیوتکنولوژی، تغییر مسیرهای بازسازی NAD⁺ در باکتریها یکی از روشهای مؤثر در افزایش بازده تولید متابولیتهای صنعتی نظیر اسید لاکتیک، اتانول یا پلیهیدروکسیآلکانوآتها محسوب میشود.
گیاهان: تعادل رداکس و تنظیم رشد و پاسخ به استرس
در گیاهان، تعادل رداکس نقش محوری در تنظیم فتوسنتز، تنفس، رشد سلولی و پاسخ به استرسهای زیستی و غیرزیستی ایفا میکند. بر خلاف حیوانات، گیاهان از دو منبع انرژی اصلی یعنی کلروپلاست و میتوکندری بهره میبرند که هر دو نیازمند کنترل دقیق نسبت NADH/NAD⁺ و NADPH/NADP⁺ هستند.
برخی ویژگیهای مهم:
-
در کلروپلاست، NADPH محصول نهایی فتوسیستم I است که برای سنتز مواد آلی و احیای ROS مورد استفاده قرار میگیرد.
-
در میتوکندری، NADH حاصل از گلیکولیز و چرخه TCA وارد زنجیره انتقال الکترون شده و NAD⁺ بازسازی میشود.
-
سیستمهای آنتیاکسیدانی مانند آسکوربات-گلوتاتیون، پراکسیدازها و سوپراکسید دیسموتاز بهطور فعال تعادل رداکس را حفظ میکنند.
تغییر در تعادل رداکس در گیاهان نهتنها بهعنوان یک علامت هشدار برای استرس (مانند کمآبی، سرما یا شوری) عمل میکند، بلکه میتواند بیان ژنهای دفاعی، تنظیم رشد، و حتی برنامهریزی مرگ سلولی (PCD) را القا کند.
در مجموع، موجودات غیر انسانی مانند قارچها، باکتریها و گیاهان هر یک با بهرهگیری از مکانیسمهای متناسب با زیستمحیط خود، تعادل رداکس را تنظیم میکنند. درک این مسیرها به پژوهشگران کمک میکند تا استراتژیهای نوینی برای بهبود فرآیندهای زیستی، مبارزه با پاتوژنها، یا افزایش مقاومت گیاهان به استرسهای محیطی توسعه دهند.
اهمیت تنظیم نسبت NAD⁺/NADH در مهندسی متابولیک
مهندسی متابولیک شاخهای از زیستفناوری است که با هدف بازطراحی مسیرهای متابولیکی سلولها، عملکردهای زیستی را به منظور تولید بهتر و مؤثرتر مواد شیمیایی، داروها، سوختهای زیستی و محصولات ارزشمند صنعتی بهینه میکند. در این میان، تعادل کوآنزیمهای احیاکننده مانند NAD⁺ و NADH یکی از عوامل تعیینکننده در موفقیت مهندسی مسیرها محسوب میشود.
تنظیم نسبت NAD⁺/NADH و بازده متابولیکی
-
نقش در مسیرهای انرژیزایی: بسیاری از مسیرهای متابولیکی کلیدی، به ویژه آنهایی که به تولید انرژی میانجامند (مانند گلیکولیز، چرخه اسید سیتریک و زنجیره انتقال الکترون) مستقیماً وابسته به تعادل NAD⁺/NADH هستند. عدم تعادل در این نسبت میتواند باعث تجمع NADH شود که به توقف یا کاهش فعالیت آنزیمهای کلیدی منجر میگردد.
-
جلوگیری از تجمع محصولات جانبی : در مهندسی متابولیک، انباشت NADH منجر به افزایش تولید گونههای اکسیژن فعال (ROS) میشود که سلول را دچار استرس اکسیداتیو کرده و ممکن است به مرگ سلولی بیانجامد. تنظیم این نسبت، از این آسیبها جلوگیری میکند و سلامت سلول را حفظ میکند.
-
بهبود بازده تولید متابولیتها : در تولید بیوشیمیایی مانند تولید اتانول، لاکتات، اسیدهای آلی یا پلیمرهای زیستی، تنظیم نسبت NAD⁺/NADH به بهینهسازی مسیرهای تخمیری و اکسیداتیو کمک کرده و باعث افزایش بهرهوری محصول نهایی میشود.
روشهای مهندسی برای تنظیم نسبت NAD⁺/NADH
-
بازطراحی مسیرهای تنفسی و تخمیری : مهندسان متابولیک با اصلاح مسیرهای تخمیری یا اضافه کردن مسیرهای تنفسی جایگزین، تلاش میکنند تا مصرف NADH و تولید NAD⁺ را بهینه کنند.
-
مهندسی آنزیمهای کلیدی : با استفاده از فناوریهای نوین ژندرمانی و ویرایش ژن (مانند CRISPR)، آنزیمهایی مانند NADH دیهیدروژناز یا لاکتات دهیدروژناز اصلاح میشوند تا نرخ بازسازی NAD⁺ افزایش یابد.
-
ایجاد مسیرهای بازسازی جایگزین : مسیرهای مصنوعی یا طبیعی که به بازسازی NAD⁺ کمک میکنند (مثلاً مسیرهای مربوط به آنزیمهای NADH اکسیداز یا الکل دهیدروژناز) در سلولها تعبیه میشوند.
-
استفاده از کوفاکتورهای جایگزین : بهرهگیری از کوفاکتورهای مصنوعی که توانایی انتقال الکترون را دارند، میتواند به بهبود تعادل رداکس کمک کند و فشار متابولیکی روی NADH/NAD⁺ را کاهش دهد.
کاربردهای صنعتی و تحقیقاتی
-
تولید سوختهای زیستی : بهینهسازی نسبت NAD⁺/NADH به تولید با بازده بالاتر اتانول و بوتانول منجر میشود، که در صنایع انرژی اهمیت فراوانی دارد.
-
سنتز دارو و مواد شیمیایی: مهندسی میکروارگانیسمها برای تولید ترکیبات دارویی پیچیده (مانند آنتیبیوتیکها، ویتامینها و آنزیمها) نیازمند حفظ تعادل رداکس برای اطمینان از فعالیت مناسب مسیرهای biosynthetic است.
-
بهبود مقاومت سلولی : حفظ تعادل NAD⁺/NADH به سلولها کمک میکند تا در مقابل استرسهای متابولیکی و اکسیداتیو مقاومتر شوند، که در کشت سلولی و بیوراکتورها اهمیت دارد.
با توجه به اهمیت این موضوع، مهندسی تعادل NAD⁺/NADH یکی از محورهای اصلی در طراحی سیستمهای زیستی پیشرفته است که قابلیت انطباق با شرایط مختلف زیستی و صنعتی را دارد.
رویکردهای درمانی برای بازگرداندن تعادل NAD⁺/NADH
تعادل NAD⁺/NADH نقش حیاتی در حفظ سلامت سلولی و عملکرد بهینه مسیرهای متابولیک ایفا میکند. اختلال در این تعادل، به ویژه کاهش سطح NAD⁺ یا افزایش NADH، میتواند منجر به بروز بیماریهای متابولیک، پیری سلولی و اختلالات عصبی شود. از این رو، بازگرداندن این تعادل بهعنوان یک هدف درمانی مهم مورد توجه قرار گرفته است.
مکملهای پیشساز NAD⁺
-
نیکوتینآمید ریبوزید (NR) و نیکوتینآمید مونونوکلئوتید: (NMN) این دو ترکیب بهعنوان پیشسازهای مستقیم NAD⁺ شناخته میشوند و در مطالعات حیوانی و انسانی نشان دادهاند که میتوانند سطح NAD⁺ را افزایش داده و فعالیت آنزیمهای وابسته به NAD⁺ مانند سیرتوئینها را بهبود بخشند. مصرف این مکملها موجب بهبود متابولیسم انرژی، افزایش مقاومت به استرس اکسیداتیو و بهبود عملکرد سلولی میشود.
-
ویتامین B3) )نیاسین : نوع دیگری از پیشساز NAD⁺ است که در دوزهای مشخص به درمان اختلالات متابولیکی کمک میکند، اگرچه عوارض جانبی آن در دوز بالا ممکن است محدودیت ایجاد کند.
فعالسازی آنزیمهای وابسته به NAD⁺
-
سیرتوئینها: (Sirtuins) این خانواده از آنزیمها که نقش مهمی در تنظیم فرآیندهای پیری، متابولیسم و پاسخ به استرس سلولی دارند، برای عملکرد به NAD⁺ نیاز دارند. استفاده از فعالکنندههای سیرتوئینها مانند رزوراترول در ترکیب با افزایش سطح NAD⁺ میتواند تعادل رداکس را بهبود بخشد و اثرات محافظتی در سلولها داشته باشد.
-
PARP (Poly ADP-ribose polymerase) : آنزیمی که در پاسخ به آسیب DNA فعال میشود و مصرف NAD⁺ زیادی دارد. مهارکنندههای PARP میتوانند با کاهش مصرف NAD⁺ در فرآیندهای ترمیمی، به حفظ تعادل NAD⁺ کمک کنند.
رویکردهای کاهش تولید NADH و بهبود بازسازی NAD⁺
-
تقویت مسیرهای جایگزین بازسازی NAD⁺ : همانطور که در بخشهای قبلی اشاره شد، افزایش فعالیت آنزیمهای NADH اکسیداز یا آنزیمهای دخیل در بازسازی NAD⁺ میتواند تعادل رداکس را بهبود بخشد.
-
کاهش استرس اکسیداتیو : استفاده از آنتیاکسیدانها و عوامل ضد التهابی به کاهش تولید گونههای اکسیژن فعال که میتوانند تعادل NADH/NAD⁺ را مختل کنند کمک میکند.
درمانهای نوین و داروهای هدفمند
-
داروهای بازسازیکننده NAD⁺ : توسعه داروهای جدید که بتوانند به صورت هدفمند NAD⁺ را افزایش دهند یا آنزیمهای کلیدی در مسیرهای NAD⁺/NADH را تنظیم کنند، از جمله رویکردهای نوین در حال پیشرفت است.
-
ژندرمانی و ویرایش ژن : در آینده، تغییرات ژنتیکی برای افزایش بیان آنزیمهای کلیدی در مسیرهای بازسازی NAD⁺ یا مهار آنزیمهایی که منجر به کاهش NAD⁺ میشوند، میتواند راهکار درمانی مهمی باشد.
بازگرداندن تعادل NAD⁺/NADH با این رویکردها میتواند اثرات چشمگیری بر کنترل بیماریهای مزمن، ارتقاء سلامت سلولی و افزایش طول عمر داشته باشد. مطالعات بالینی و تحقیقاتی در این حوزه همچنان در حال توسعه است و پتانسیل بسیار بالایی برای کاربردهای پزشکی آینده دارد.
رویکردهای درمانی برای بازگرداندن تعادل NAD⁺/NADH
تعادل NAD⁺ و NADH یکی از شاخصهای حیاتی در عملکرد سلولی و سلامت متابولیکی است. اختلال در این تعادل موجب بروز بیماریهای مزمن، اختلالات متابولیک و پیری زودرس میشود. بنابراین، بهبود و بازگرداندن تعادل NAD⁺/NADH به یکی از اهداف مهم درمانی تبدیل شده است. روشهای متنوعی برای بازگردانی این تعادل به کار گرفته میشود که در ادامه به آنها پرداخته میشود.
افزایش سطح NAD⁺ با پیشسازهای طبیعی و مکملها
-
پیشسازهای NAD⁺ مانند نیکوتینآمید ریبوزید (NR) و نیکوتینآمید مونونوکلئوتید (NMN) : این ترکیبات میتوانند به سرعت سطح NAD⁺ در سلول را افزایش دهند. مطالعات حیوانی و انسانی نشان دادهاند که مصرف این پیشسازها موجب بهبود متابولیسم، افزایش انرژی سلولی، و کاهش استرس اکسیداتیو میشود.
-
ویتامین B3 یا نیاسین : نیاسین از پیشسازهای NAD⁺ است که میتواند در دوزهای مشخص برای افزایش سطح NAD⁺ در درمان برخی اختلالات استفاده شود. اما مصرف دوزهای بالا نیازمند نظارت دقیق به علت عوارض احتمالی است.
فعالسازی آنزیمهای وابسته به NAD⁺ برای بهبود عملکرد سلولی
-
فعالکنندههای سیرتوئینها : سیرتوئینها آنزیمهایی وابسته به NAD⁺ هستند که در کنترل فرآیندهای پیری، تنظیم متابولیسم و پاسخ به استرس نقش دارند. ترکیباتی مانند رزوراترول باعث افزایش فعالیت سیرتوئینها میشوند و در کنار افزایش NAD⁺، عملکرد محافظتی سلولی را تقویت میکنند.
-
مهار آنزیم PARP : آنزیم PARP نقش کلیدی در ترمیم DNA دارد و در شرایط آسیب، مصرف زیادی از NAD⁺ دارد. مهار PARP میتواند مصرف NAD⁺ را کاهش داده و به حفظ تعادل NAD⁺/NADH کمک کند.
تقویت مسیرهای جایگزین بازسازی NAD⁺
-
افزایش فعالیت آنزیمهای اکسید کننده NADH : برخی آنزیمها مانند NADH اکسیدازها میتوانند NADH را اکسید کرده و NAD⁺ تولید کنند، بدین ترتیب تعادل رداکس را بهبود میبخشند. تحریک این مسیرها یکی از روشهای مهم درمانی است.
-
کاهش استرس اکسیداتیو : آنتیاکسیدانها و عوامل ضد التهابی با کاهش گونههای واکنشی اکسیژن، فشار اکسیداتیو را کم کرده و در نتیجه از اختلال تعادل NAD⁺/NADH جلوگیری میکنند.
رویکردهای نوین و درمانهای هدفمند
-
داروهای بازسازیکننده: NAD⁺ داروهایی که به طور مستقیم یا غیرمستقیم موجب افزایش سطح NAD⁺ میشوند، به عنوان یکی از درمانهای نوین مطرح هستند و در حال توسعه و ارزیابی بالینیاند.
-
ژندرمانی و فناوریهای ویرایش ژن : در آینده نزدیک، دستکاری ژنتیکی برای افزایش بیان آنزیمهای کلیدی در مسیرهای سنتز NAD⁺ یا کاهش فعالیت آنزیمهای مصرفکننده NAD⁺ میتواند راهکارهای موثری در بازیابی تعادل NAD⁺/NADH باشد.
بازگرداندن تعادل NAD⁺/NADH از طریق این رویکردها، علاوه بر کنترل بیماریهای متابولیک، میتواند در بهبود سلامت کلی سلولها و افزایش طول عمر موثر باشد. مطالعات علمی در این حوزه رو به رشد بوده و نوید بخش پیشرفتهای مهم در درمانهای بالینی است.
جمعبندی و چشمانداز آینده
تعادل بین NAD⁺ و NADH یکی از پایههای حیاتی حفظ عملکرد صحیح سلولی و سلامت متابولیکی است. در این مقاله به طور جامع نقش کلیدی این دو کوآنزیم در مسیرهای متابولیک مختلف، اهمیت تعادل رداکس و پیامدهای اختلال در آن بررسی شد. همچنین مکانیزمهای سلولی برای حفظ این تعادل، پاسخهای سلولی به اختلالات و رویکردهای درمانی نوین جهت بازگرداندن تعادل NAD⁺/NADH مورد بحث قرار گرفت.
اختلال در تعادل رداکس نه تنها موجب کاهش کارایی فرآیندهای انرژیزایی و متابولیکی میشود بلکه زمینهساز بروز بیماریهای مزمن متعددی از جمله دیابت، بیماریهای قلبی، اختلالات عصبی و حتی پیری زودرس است. بنابراین، شناخت دقیق این تعادل و توسعه روشهای بهبود آن از اهمیت بالایی برخوردار است.
در آینده، پیشرفتهای فناوریهای زیستپزشکی و بیوانفورماتیک، به همراه توسعه داروهای هدفمند و رویکردهای نوین مانند ژندرمانی و مهندسی متابولیک، افقهای جدیدی را در بهبود تعادل NAD⁺/NADH و مقابله با بیماریهای مرتبط با اختلال رداکس باز خواهد کرد. همچنین، مطالعات عمیقتر روی مسیرهای جایگزین بازسازی NAD⁺ و نقش آنها در سلولهای مختلف، به خصوص در بافتهای آسیبدیده، میتواند راهکارهای درمانی دقیقتر و مؤثرتری فراهم آورد.
افزون بر این، افزایش آگاهی عمومی نسبت به اهمیت سبک زندگی سالم، رژیم غذایی غنی از پیشسازهای NAD⁺ و فعالیتهای بدنی منظم، میتواند به عنوان مکملی قوی در حفظ تعادل رداکس و پیشگیری از بیماریها عمل کند.
در نهایت، ترکیب دانش پایهای با فناوریهای پیشرفته، نویدبخش دورهای جدید در مدیریت سلامت متابولیکی و ارتقای کیفیت زندگی خواهد بود. ادامه تحقیقات در این حوزه، به ویژه در راستای یافتن روشهای دقیقتر و ایمنتر برای تنظیم تعادل NAD⁺/NADH، از مهمترین اولویتهای پژوهشی آینده است.