مسیر PPP (Pentose Phosphate Pathway)؛ نقش در بیوسنتز و آنتیاکسیدانی
مقدمهای بر مسیر PPP و اهمیت آن در متابولیسم سلولی
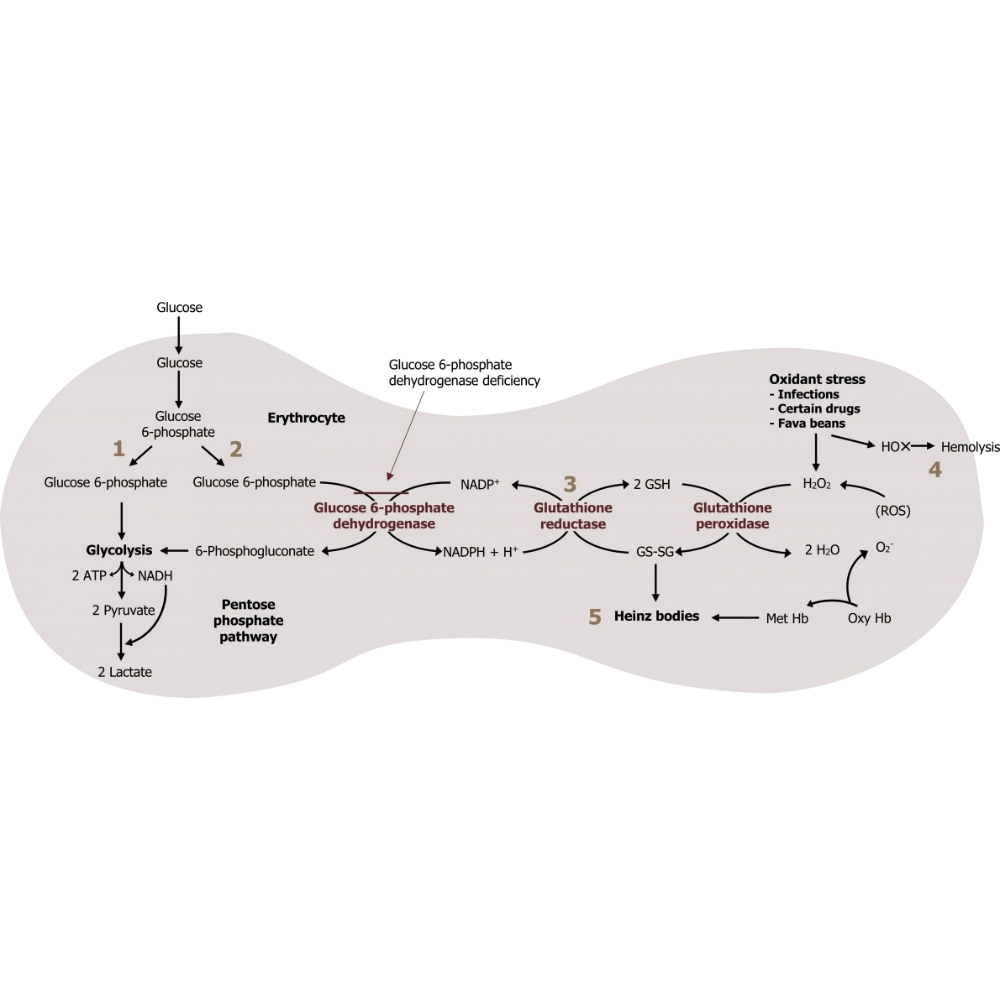
مسیر فسفات پنتوز یا مسیر PPP (Pentose Phosphate Pathway) یکی از مسیرهای کلیدی و در عین حال کمتر شناختهشده در متابولیسم سلولی است که به موازات گلیکولیز در سیتوزول سلولها فعالیت میکند. برخلاف مسیرهای کلاسیک تولید انرژی مانند گلیکولیز و چرخه کربس که عمدتاً بر تولید ATP متمرکز هستند، هدف اصلی مسیر PPP تولید ترکیباتی با نقش ساختاری و دفاعی در سلول است، بهویژه NADPH و ریبوز-5-فسفات. این ترکیبات برای بیوسنتز لیپیدها، اسیدهای نوکلئیک، و خنثیسازی رادیکالهای آزاد حیاتیاند.
نخستین فاز این مسیر، موسوم به فاز اکسیداتیو، به تولید NADPH میانجامد؛ ترکیبی که بهعنوان کوفاکتور احیاکننده در واکنشهای آنابولیک از جمله سنتز اسیدهای چرب و کلسترول، و نیز در محافظت آنتیاکسیدانی از سلول نقشآفرین است. فاز دوم، که غیر اکسیداتیو نام دارد، بیشتر در بازسازی قندهای پنتوز و اتصال دوباره آنها به مسیرهای گلیکولیتیک یا سنتز نوکلئوتیدها شرکت دارد.
اهمیت مسیر PPP فراتر از نقشهای متابولیک آن است. این مسیر در تنظیم پاسخ سلولی به استرسهای اکسیداتیو، دفاع ایمنی، و حتی تقسیم سلولی نقش دارد و در بافتهایی مانند کبد، سلولهای ایمنی، مغز و بافتهای سرطانی از اهمیت خاصی برخوردار است. بهویژه در شرایطی مانند سرطان، دیابت، عفونت یا کمبود اکسیژن، فعالسازی یا مهار این مسیر میتواند پیامدهای مهمی برای بقا یا مرگ سلولها به همراه داشته باشد.
امروزه مسیر PPP بهعنوان یکی از مسیرهای هدف در مطالعات درمانی مدرن شناخته میشود، چراکه مهار یا تحریک انتخابی آن میتواند راهکارهای نوینی برای درمان بیماریهای مزمن، تومورها و اختلالات متابولیک فراهم کند. همچنین استفاده از این مسیر در بیوتکنولوژی صنعتی بهمنظور تولید ترکیبات زیستی با ارزش بالا نیز بهشدت مورد توجه قرار گرفته است.
در این مقاله، بهطور جامع به ساختار، عملکرد، تنظیم و نقشهای پاتوفیزیولوژیک مسیر PPP خواهیم پرداخت تا درک دقیقتری از جایگاه آن در زیستشناسی سلولی و پزشکی نوین به دست آوریم.
ساختار کلی مسیر PPP: فاز اکسیداتیو و غیر اکسیداتیو
مسیر فسفات پنتوز (PPP) از دو بخش مجزا اما بههمپیوسته تشکیل شده است: فاز اکسیداتیو و فاز غیر اکسیداتیو. هر یک از این دو فاز، اهداف عملکردی مشخصی دارند و در موقعیتهای مختلف سلولی میتوانند به صورت مستقل یا هماهنگ فعال شوند.
فاز اکسیداتیو: منبع اصلی NADPH
در این فاز، گلوکز-6-فسفات بهعنوان سوبسترای اولیه وارد مسیر شده و طی یک سری واکنشهای آنزیمی، به ریبوز-5-فسفات و NADPH تبدیل میشود. آنزیم کلیدی این بخش، گلوکز-6-فسفات دهیدروژناز (G6PD) است که واکنش اولیه را آغاز کرده و نقش تنظیمی حیاتی ایفا میکند. مراحل اصلی شامل:
-
اکسیداسیون گلوکز-6-فسفات به 6-فسفوگلوکونو-δ-لاکتون با تولید یک مولکول NADPH
-
هیدرولیز لاکتون به 6-فسفوگلوکونات
-
دکربوکسیلاسیون 6-فسفوگلوکونات به ریبولوز-5-فسفات همراه با تولید دومین مولکول NADPH
نکته مهم در فاز اکسیداتیو این است که با تولید NADPH، سلول میتواند نیازهای خود برای واکنشهای احیایی مانند سنتز لیپیدها و خنثیسازی گونههای فعال اکسیژن (ROS) را پاسخ دهد. این فاز برگشتناپذیر است و بیشتر در شرایط نیاز به NADPH فعال میشود.
فاز غیر اکسیداتیو: انعطافپذیری در متابولیسم قندها
برخلاف فاز اکسیداتیو، مرحله غیر اکسیداتیو برگشتپذیر است و وظیفه اصلی آن تبدیل قندهای پنجکربنه به قندهای سهکربنه، چهارکربنه، ششکربنه یا هفتکربنه است. در این فاز، ریبولوز-5-فسفات بهوسیله ایزومرازها و ترانسآلدولازها به ترکیباتی مانند گلیسرآلدئید-3-فسفات و فروکتوز-6-فسفات تبدیل میشود که قابل ورود مجدد به مسیر گلیکولیز هستند. این فاز به سلول اجازه میدهد تا در شرایط کمبود یا مازاد قندهای پنجکربنه، تعادل مناسبی برقرار کند.
اگر هدف سلول تولید نوکلئوتید باشد، مسیر به سمت سنتز ریبوز-5-فسفات پیش میرود؛ اما اگر هدف سلول بازیابی گلوکز یا ورود به مسیرهای انرژیزا باشد، قندهای پنجکربنه به ترکیبات گلیکولیتیک بازمیگردند.
تعامل بین دو فاز در شرایط سلولی متفاوت
یکی از ویژگیهای منحصر بهفرد مسیر PPP، قابلیت تطبیقپذیری آن با نیازهای متغیر سلول است. بهعنوان مثال:
-
در شرایط استرس اکسیداتیو یا سنتز فعال اسیدهای چرب، فاز اکسیداتیو بیش از پیش فعال شده و NADPH بیشتری تولید میشود.
-
در تقسیم سریع سلولی یا سنتز نوکلئوتید، فاز غیر اکسیداتیو با جهتگیری به تولید ریبوز-5-فسفات غالب میشود.
-
در برخی موارد نیز هر دو فاز همزمان برای تولید ترکیبات واسطه گلیکولیتیک فعال میشوند تا انرژی و مواد پیشساز فراهم گردد.
در مجموع، ساختار مسیر PPP نشاندهنده طراحی هوشمندانهای است که به سلول امکان میدهد بهطور پویا بین تولید انرژی، سنتز زیستی، و دفاع اکسیداتیو تعادل برقرار کند.
نقش مسیر PPP در تولید نوکلئوتیدها و اجزای بیوسنتزی
مسیر فسفات پنتوز (PPP) علاوه بر نقش کلیدی در تأمین NADPH، یکی از منابع اصلی تولید پیشسازهای قند پنجکربنه مورد نیاز برای سنتز نوکلئوتیدها و اسیدهای نوکلئیک محسوب میشود. عملکرد این مسیر در تأمین ریبوز-5-فسفات، نقشی اساسی در حفظ چرخه زیستی سلولهای در حال رشد، تقسیم و ترمیم ایفا میکند.
تأمین ریبوز-5-فسفات برای سنتز نوکلئوتیدها
ریبوز-5-فسفات یکی از مهمترین محصولات مسیر PPP است که مستقیماً در ساختار نوکلئوتیدهای ریبونوکلئیک و دئوکسیریبونوکلئیک بهکار میرود. این قند پنجکربنه ستون فقرات مولکولهای ATP، GTP، NAD⁺، FAD، RNA و DNA را تشکیل میدهد. در سلولهایی که در حال تقسیم سریع هستند مانند سلولهای مغز استخوان، سلولهای جنینی یا سلولهای سرطانی، تولید بالای ریبوز-5-فسفات برای پشتیبانی از سنتز شدید DNA و RNA ضروری است.
مسیر غیر اکسیداتیو PPP با انعطافپذیری بالا قادر است حتی در غیاب NADPH، ریبوز-5-فسفات را از گلوکز یا ترکیبات گلیکولیتیک مشتق کند و نیاز سلول به پیشسازهای نوکلئوتیدی را بهخوبی پاسخ دهد.
مشارکت در بیوسنتز کوفاکتورها و ویتامینهای انرژیزا
ترکیبات مشتق از PPP در ساخت کوفاکتورهایی چون NAD⁺، NADP⁺ و FAD نیز نقش دارند. این کوفاکتورها که خود مشتقاتی از نوکلئوتیدها هستند، در واکنشهای اکسیداسیون-احیا، متابولیسم انرژی، و تبدیلهای آنزیمی گسترده در سراسر متابولیسم سلولی مشارکت میکنند. تولید پایههای پورینی و پیریمیدینی با اتکا بر ریبوز-5-فسفات بهعنوان اسکلت قندی امکانپذیر است، و هرگونه اختلال در این مسیر میتواند بر تمام واکنشهای وابسته به انرژی تأثیر بگذارد.
تعادل بین انرژی و سنتز زیستی در شرایط متغیر
سلول در شرایطی مانند کمبود منابع تغذیهای، نیاز به تقسیم سریع یا قرار گرفتن در معرض تنش، میان مسیر گلیکولیز و PPP تعادل برقرار میکند. هنگامیکه اولویت با سنتز نوکلئوتید است، آنزیمهای مسیر غیر اکسیداتیو به سمت تولید ریبوز-5-فسفات جهتگیری میکنند؛ اما زمانی که نیاز سلول به NADPH افزایش یابد (مثلاً در سنتز لیپید یا مقابله با استرس اکسیداتیو)، فاز اکسیداتیو PPP فعال میشود.
درواقع مسیر PPP یکی از معدود مسیرهای متابولیکی است که میتواند همزمان به نیازهای انرژی، سنتز زیستی، و حفاظت اکسیداتیو پاسخ دهد، و نقش آن در فراهمسازی نوکلئوتیدها بهویژه در سلولهایی با نرخ بالای سنتز DNA یا RNA بسیار برجسته است.
تنظیم مسیر PPP در شرایط فیزیولوژیک و پاتولوژیک
مسیر فسفات پنتوز (PPP) یکی از مسیرهای متابولیکی انعطافپذیر و تنظیمپذیر در بدن انسان است که با توجه به نیازهای سلولی در شرایط گوناگون، دستخوش تغییرات قابل توجهی میشود. تنظیم دقیق این مسیر برای حفظ هموستاز، مقابله با استرس اکسیداتیو، و پاسخدهی به نیازهای بیوسنتزی سلول حیاتی است.
تنظیم آنزیمی در حالت طبیعی
در حالت فیزیولوژیک، تنظیم مسیر PPP بهویژه در گامهای آغازین آن توسط آنزیم گلوکز-6-فسفات دهیدروژناز (G6PD) انجام میشود. این آنزیم سرعتسنج اصلی مسیر اکسیداتیو PPP است و بهواسطه غلظت NADP⁺ فعال میشود. زمانیکه سطح NADPH در سلول پایین باشد، NADP⁺ افزایش یافته و G6PD فعال میشود، در نتیجه تولید NADPH و ریبوز-5-فسفات تقویت میگردد. این سیستم بازخورد مثبت، نقش کلیدی در پاسخ سریع به نیازهای بیوشیمیایی سلول دارد.
همچنین، تنظیم فاز غیر اکسیداتیو مسیر PPP عمدتاً توسط تعادل بین گلیکولیز و نیاز به سنتز نوکلئوتیدها صورت میگیرد. در مواقعی که تقاضای بالایی برای نوکلئوتید وجود دارد، جریان متابولیتها به سمت تولید ریبوز-5-فسفات منحرف میشود.
پاسخ به استرس اکسیداتیو و شرایط متابولیکی خاص
در مواجهه با شرایطی نظیر استرس اکسیداتیو، التهاب، تابش یونیزه، یا حضور ترکیبات اکسیدکننده، سلولها برای خنثیسازی رادیکالهای آزاد به مقادیر زیادی NADPH نیاز دارند. در این شرایط، فعالیت G6PD و سایر آنزیمهای مسیر PPP بهطور چشمگیری افزایش مییابد تا پاسخ آنتیاکسیدانی سلول حفظ شود. سلولهای فاقد G6PD کارآمد، مانند برخی گلبولهای قرمز در بیماران مبتلا به کمبود آنزیمی، مستعد همولیز در مواجهه با تنش اکسیداتیو هستند.
همچنین در شرایط هیپوکسی، تکثیر سلولی سریع (مانند رشد جنینی یا تومور)، یا فعالیت شدید سیستم ایمنی، مسیر PPP نقش حمایتی مهمی در تأمین NADPH و ریبوز-5-فسفات ایفا میکند.
تنظیم در سرطان و بیماریهای متابولیکی
در بسیاری از سلولهای سرطانی، مسیر PPP بهویژه فاز اکسیداتیو آن بیشفعال میشود. این تغییر بخشی از بازبرنامهریزی متابولیکی سلولهای سرطانی است که نیاز به افزایش سنتز نوکلئوتیدها، اسیدهای چرب، و مکانیزمهای دفاعی در برابر استرس اکسیداتیو دارند. تنظیم مثبت این مسیر در تومورها اغلب از طریق افزایش بیان G6PD ، تغییر در سیگنالینگ PI3K/AKT/mTOR، و سایر مسیرهای مرتبط با رشد انجام میشود.
در بیماریهایی مانند دیابت، چاقی، و سندرم متابولیک، اختلال در عملکرد انسولین میتواند تعادل بین گلیکولیز و مسیر PPP را بر هم بزند، که به تولید بیشازحد رادیکالهای آزاد، التهاب مزمن، و آسیب سلولی منجر میشود. در این شرایط، تنظیم هدفمند مسیر PPP بهعنوان راهبرد درمانی بالقوه مطرح شده است.
ارتباط مسیر PPP با بیماریهای متابولیک: دیابت، سندرم متابولیک و کبد چرب
مسیر فسفات پنتوز (PPP) بهدلیل نقش حیاتی خود در تولید NADPH ، ریبوز-5-فسفات و تنظیم استرس اکسیداتیو، بهصورت مستقیم و غیرمستقیم در بروز، پیشرفت و درمان بیماریهای متابولیکی دخالت دارد. اختلال در تعادل عملکرد این مسیر میتواند منجر به تغییرات متابولیک و التهابی عمیق در بافتهایی مانند کبد، عضله، پانکراس و بافت چربی شود.
نقش PPP در دیابت و مقاومت به انسولین
در دیابت نوع دوم و مراحل اولیه مقاومت به انسولین، استرس اکسیداتیو ناشی از افزایش گلوکز خون باعث فعالسازی مسیر PPP، بهویژه فاز اکسیداتیو آن، میشود. هدف اصلی در این شرایط، تولید NADPH برای بازسازی گلوتاتیون احیاشده و حفظ تعادل رداکس سلولی است. اما این فعالسازی مزمن، اگر بدون تنظیم دقیق انجام شود، میتواند منجر به تولید واسطههای متابولیکی ناخواسته، از جمله قندهای پنجکربنه اضافی و محصولات نهایی گلیکاسیون (AGEs) شود که خود موجب آسیب بیشتر به سلولهای پانکراس و اندوتلیوم میگردند.
همچنین در برخی بیماران دیابتی، دیده شده که بیان آنزیمهای کلیدی PPP مانند گلوکز-6-فسفات دهیدروژناز دچار کاهش میشود که میتواند ظرفیت سلول برای مقابله با استرس اکسیداتیو را تضعیف کرده و پیشرفت بیماری را تسریع بخشد.
پیوند PPP با سندرم متابولیک و التهاب مزمن
در سندرم متابولیک که با چاقی شکمی، مقاومت به انسولین، دیسلیپیدمی و التهاب مزمن خفیف مشخص میشود، مسیر PPP بهعنوان یکی از منابع اصلی NADPH برای پاسخهای التهابی ماکروفاژها شناخته میشود. NADPH تولیدشده در این مسیر برای فعالیت آنزیم NADPH اکسیداز ضروری است؛ آنزیمی که در تولید رادیکالهای آزاد نقش دارد و در فعالسازی فاکتورهای التهابی مانند NF-κB مشارکت میکند.
افزایش مزمن NADPH و متابولیتهای PPP در سلولهای ایمنی و بافت چربی میتواند به تقویت التهاب، افزایش تولید سایتوکاینهای التهابی و وخامت مقاومت به انسولین منجر شود. این رابطه دوطرفه بین متابولیسم و التهاب زمینهساز آسیب اندامها در سندرم متابولیک است.
مسیر PPP در بیماری کبد چرب غیرالکلی (NAFLD)
کبد بهعنوان یکی از اندامهای اصلی متابولیسم، به شدت به مسیر PPP وابسته است. در شرایطی مانند تغذیه پرکربوهیدرات یا مقاومت به انسولین، فعالیت بیش از حد G6PD در کبد باعث افزایش تولید NADPH و در پی آن افزایش لیپوژنز (سنتز اسیدهای چرب) میشود. این فرآیند منجر به تجمع تریگلیسرید در کبد و پیشرفت بیماری کبد چرب غیرالکلی میشود.
مطالعات نشان دادهاند که مهار آنزیمهای کلیدی PPP در مدلهای حیوانی مبتلا به کبد چرب، میتواند از تجمع چربی در سلولهای کبدی بکاهد و التهاب و فیبروز کبدی را مهار کند. بنابراین، مسیر PPP هم در مرحله ابتدایی لیپوژنز و هم در مراحل پیشرفتهتر آسیب بافتی کبد نقش کلیدی دارد.
چشمانداز درمانی
درک بهتر از چگونگی تعامل PPP با بیماریهای متابولیکی راه را برای مداخلات درمانی هدفمند باز میکند. مهار انتخابی G6PD یا تنظیم دقیق تعادل بین فازهای اکسیداتیو و غیر اکسیداتیو مسیر PPP ممکن است به بهبود وضعیت متابولیکی و کاهش التهاب کمک کند. با این حال، از آنجا که این مسیر در حفظ تعادل اکسیداتیو و عملکرد سلولی سالم نیز نقش دارد، تنظیم آن باید با دقت و بر اساس شرایط بافتی خاص صورت گیرد.
مشارکت مسیر PPP در تنظیم ایمنی و عملکرد ماکروفاژها
مسیر فسفات پنتوز (PPP) نه تنها در فرآیندهای بیوسنتزی و آنتیاکسیدانی نقش دارد، بلکه بهعنوان یک تنظیمکننده کلیدی در عملکرد سیستم ایمنی، بهویژه در سلولهای فاگوسیتی مانند ماکروفاژها، ایفای نقش میکند. ماکروفاژها از جمله سلولهای مهم ایمنی ذاتی هستند که در تشخیص عوامل بیماریزا، پاسخهای التهابی و پاکسازی سلولی مشارکت دارند. متابولیسم گلوکز از طریق PPP، ابزار قدرتمندی برای تنظیم عملکرد این سلولها فراهم میآورد.
نقش NADPH در فعالیتهای ضد میکروبی ماکروفاژها
یکی از محصولات اصلی مسیر PPP، NADPH است که بهصورت مستقیم برای فعالیت آنزیم NADPH اکسیداز در ماکروفاژها مصرف میشود. این آنزیم، در هنگام فعالسازی ماکروفاژ توسط پاتوژنها، باعث تولید گونههای فعال اکسیژن (ROS) میشود؛ مولکولهایی که نقش اساسی در کشتن عوامل عفونی داخل فاگولیزوزوم دارند. بنابراین، کاهش فعالیت PPP میتواند قدرت فاگوسیتی و کشتار میکروبی ماکروفاژ را مختل کند.
مسیر PPP و قطببندی ماکروفاژها (M1/M2)
ماکروفاژها بسته به سیگنالهای محیطی میتوانند به زیرگروههای عملکردی متفاوتی تبدیل شوند. ماکروفاژهای نوع M1 عمدتاً در پاسخهای التهابی و ضد میکروبی نقش دارند، در حالی که نوع M2 با عملکردهای ضدالتهابی، ترمیم بافت و بازسازی همراه است. مطالعات نشان دادهاند که مسیر PPP در ماکروفاژهای M1 فعالتر است، زیرا این سلولها برای تولید ROS و نیتریک اکسید (NO) به NADPH زیادی نیاز دارند.
در مقابل، ماکروفاژهای M2 بیشتر از مسیرهای متابولیسم اکسیداتیو مانند چرخه TCA و فسفوریلاسیون اکسیداتیو استفاده میکنند. این تفاوت متابولیکی نشان میدهد که تنظیم مسیر PPP میتواند به عنوان استراتژی بالقوهای برای تغییر قطب ماکروفاژها و کنترل التهاب مورد استفاده قرار گیرد.
اثر بر بیان سایتوکاینها و مسیرهای التهابی
فعالسازی مسیر PPP علاوه بر تأمین NADPH، بر مسیرهای سیگنالینگ نظیر NF-κB، STAT1 و HIF-1α نیز اثر میگذارد. این مسیرها مسئول تنظیم تولید سایتوکاینهای التهابی مانند IL-1β، TNF-α و IL-6 در ماکروفاژهای فعال هستند. بهعبارت دیگر، متابولیسم گلوکز از طریق PPP با فعالسازی مسیرهای التهابی همسو است و میتواند شدت پاسخ ایمنی را تعیین کند.
در شرایط بیماریهای مزمن التهابی مانند آترواسکلروز، آرتریت روماتوئید یا دیابت، ماکروفاژهای بیشفعال با PPP بالا میتوانند به تداوم التهاب و آسیب بافتی کمک کنند. در چنین مواردی، تعدیل هدفمند مسیر PPP ممکن است به کاهش پاسخهای التهابی کمک نماید.
ملاحظات درمانی و چشماندازهای تحقیقاتی
بررسیهای اخیر بر استفاده از مهارکنندههای انتخابی آنزیم گلوکز-6-فسفات دهیدروژناز (G6PD) بهعنوان نقطه ورود به مسیر PPP، برای کنترل فعالیت ماکروفاژهای التهابی در بیماریهای خودایمنی و متابولیک متمرکز شدهاند. همچنین، تحقیقات بر روی مهندسی متابولیسم ماکروفاژها در محیطهای توموری و عفونی برای افزایش پاسخ ایمنی ضد سرطان یا ضد میکروبی، مسیرهای جدیدی را پیشروی درمانهای ایمنیمحور گشودهاند.
مسیر PPP و نقش آن در پیشرفت سرطان و مقاومت دارویی
سلولهای سرطانی برای حفظ تکثیر سریع، بقا در شرایط استرسزا، و مقابله با اثرات شیمیدرمانی، دستخوش بازبرنامهریزی متابولیکی میشوند. یکی از مسیرهای کلیدی در این بازبرنامهریزی متابولیکی، مسیر فسفات پنتوز (PPP) است. این مسیر با تأمین پیشسازهای نوکلئوتیدی، NADPH و توانایی در کاهش استرس اکسیداتیو، در تنظیم رفتارهای بدخیم نقش مهمی ایفا میکند.
تأمین مواد بیوسنتزی برای تکثیر سلولی
سلولهای نئوپلاستیک به میزان بالایی از نوکلئوتیدها برای همانندسازی DNA و رونویسی RNA نیاز دارند. مسیر PPP، بهویژه فاز غیر اکسیداتیو آن، ریبوز-5-فسفات تولید میکند که پیشساز مستقیم در سنتز پورینها و پیریمیدینهاست. افزایش بیان آنزیمهای کلیدی این مسیر، مانند ترانسکتولاز و ترانسآلدولاز، در بسیاری از تومورها مشاهده شدهاست و مستقیماً با سرعت رشد تومور ارتباط دارد.
نقش NADPH در خنثیسازی استرس اکسیداتیو
شیمیدرمانی و پرتودرمانی عمدتاً با تولید گونههای فعال اکسیژن (ROS) به تخریب سلولهای سرطانی میپردازند. در پاسخ، سلولهای توموری برای محافظت از خود، نیاز به NADPH دارند تا با بازیابی گلوتاتیون احیاشده (GSH) و فعالسازی سیستمهای آنتیاکسیدانی، از آسیبهای اکسیداتیو جلوگیری کنند. NADPH که از طریق فاز اکسیداتیو PPP تولید میشود، نقش اصلی را در این مکانیسم دفاعی ایفا میکند.
افزایش فعالیت آنزیم گلوکز-6-فسفات دهیدروژناز (G6PD) در انواعی از سرطانها مانند سرطان پستان، ریه، کبد و پانکراس دیده شده و با پیشآگهی ضعیفتر و مقاومت به درمان مرتبط است. مهار این آنزیم میتواند حساسیت سلولهای توموری را به داروهای شیمیدرمانی افزایش دهد.
مشارکت در مقاومت دارویی
سلولهای سرطانی تحت فشار انتخابی درمان، مسیرهای متابولیکی جایگزین را فعال میکنند. مسیر PPP یکی از این مسیرهاست که در شرایط کاهش اکسیژن (هیپوکسی)، گرسنگی گلوکز، یا حضور داروهای شیمیدرمانی، فعال میشود. این مسیر از طریق افزایش توان آنتیاکسیدانی و حفظ سنتز بیومولکولها به زندهماندن سلول کمک میکند.
برای مثال، در لوسمیهای مقاوم به دوکسوروبیسین و فلودارابین، افزایش فعالیت آنزیمهای PPP بهعنوان مکانیسم مقاومت شناخته شدهاست. همچنین، در برخی تومورهای جامد، فعالسازی فاکتور HIF-1α به افزایش مسیر PPP منجر میشود که به تطابق سلول با محیط کماکسیژن کمک میکند.
اهداف درمانی جدید در مسیر PPP
از آنجا که مسیر PPP در پیشرفت سرطان و مقاومت دارویی نقش مرکزی دارد، بسیاری از پژوهشها بر شناسایی مهارکنندههای اختصاصی آنزیمهای این مسیر تمرکز کردهاند. مهارکنندههایی مانند DHEA (مهارکننده G6PD) و مهارکنندههای ترانسکتولاز، در مطالعات پیشبالینی نتایج امیدوارکنندهای در افزایش پاسخدهی تومورها به درمان نشان دادهاند.
همچنین، ترکیب مهارکنندههای مسیر PPP با داروهای ضدسرطان استاندارد، میتواند از بروز مقاومت ثانویه جلوگیری کرده و اثربخشی درمان را بهبود بخشد.
نقش مسیر PPP در سیستم عصبی و اختلالات نورودژنراتیو
مسیر فسفات پنتوز (PPP) نقشی حیاتی در حفظ عملکرد صحیح سیستم عصبی مرکزی ایفا میکند. سلولهای عصبی به دلیل متابولیسم بالای انرژی و حساسیت زیاد به استرس اکسیداتیو، به تعادل دقیق بین تولید و خنثیسازی رادیکالهای آزاد نیازمندند. مسیر PPP با تولید NADPH، بهعنوان منبع اصلی قدرت احیاکننده سلول، و تأمین ریبوز-5-فسفات برای سنتز نوکلئوتیدها، به حفظ سلامت و عملکرد نورونها کمک میکند.
محافظت نورونها در برابر استرس اکسیداتیو
مغز به دلیل مصرف بالای اکسیژن و حضور مقادیر زیاد لیپیدهای قابل اکسید شدن، محیطی مستعد برای آسیبهای اکسیداتیو است. NADPH تولید شده توسط فاز اکسیداتیو PPP برای بازیابی فرم فعال گلوتاتیون (GSH) حیاتی است، که یکی از مهمترین آنتیاکسیدانهای سلولی محسوب میشود. کاهش عملکرد مسیر PPP میتواند منجر به افزایش آسیب اکسیداتیو، اختلال در عملکرد میتوکندری و در نهایت مرگ سلولی شود.
مطالعات نشان دادهاند که کاهش فعالیت آنزیم گلوکز-6-فسفات دهیدروژناز (G6PD) در بیماران مبتلا به بیماریهای نورودژنراتیو مانند بیماری آلزایمر، پارکینسون و اسکلروز جانبی آمیوتروفیک (ALS) مشاهده شده است، که نشاندهنده نقش حیاتی مسیر PPP در پیشگیری از پیشرفت این اختلالات است.
تأثیر بر متابولیسم گلوکز و عملکرد نورونها
سلولهای گلیا و نورونها از مسیرهای متابولیکی متفاوتی برای تأمین انرژی و محافظت استفاده میکنند. مسیر PPP در سلولهای گلیا به ویژه آستروسیتها بسیار فعال است و نقش مهمی در حفظ محیط اکسیداتیو مناسب برای نورونها ایفا میکند. اختلال در این مسیر میتواند موجب کاهش تولید NADPH و کاهش توان خنثیسازی رادیکالهای آزاد شده و آسیب به نورونها شود.
مشارکت در بیماریهای نورودژنراتیو
بیماریهای نورودژنراتیو با کاهش تدریجی عملکرد و بقای نورونها مشخص میشوند. استرس اکسیداتیو مزمن و آسیب به اجزای سلولی مانند پروتئینها، لیپیدها و DNA، از عوامل اصلی این بیماریها هستند. مسیر PPP بهعنوان خط دفاعی اول در برابر این آسیبها، نقش کلیدی در کند کردن پیشرفت بیماریها ایفا میکند.
در بیماری آلزایمر، شواهد نشان میدهد که فعالیت PPP کاهش مییابد و این امر به تجمع پروتئینهای آمیلوئید و تاو کمک میکند. در پارکینسون، اختلال در مسیر PPP میتواند باعث افزایش آسیب اکسیداتیو به سلولهای دوپامینی شود. همچنین، در ALS کاهش عملکرد PPP با افزایش مرگ سلولی همراه است.
پتانسیل درمانی هدفگیری مسیر PPP در اختلالات عصبی
تقویت عملکرد مسیر PPP و بهبود تولید NADPH میتواند به کاهش استرس اکسیداتیو و محافظت از سلولهای عصبی کمک کند. برخی از ترکیبات دارویی و آنتیاکسیدانها که مسیر PPP را فعال میکنند یا فعالیت آنزیمهای کلیدی این مسیر را افزایش میدهند، در مطالعات پیشبالینی نتایج امیدوارکنندهای در بهبود علائم بیماریهای نورودژنراتیو نشان دادهاند.
تحقیقات در این زمینه ادامه دارد تا راهکارهای جدیدی برای افزایش ظرفیت آنتیاکسیدانی مغز و کاهش تخریب نورونی از طریق هدفگیری مسیر فسفات پنتوز ارائه شود.
اهمیت مسیر فسفات پنتوز در مقاومت نسبت به تنشهای زیستمحیطی در سلولهای گیاهی
سلولهای گیاهی به طور مداوم در معرض تنشهای مختلف زیستمحیطی مانند خشکی، شوری، گرمای بیش از حد، سرما، و آلودگیهای محیطی قرار دارند که میتوانند عملکرد متابولیکی و رشد گیاه را مختل کنند. مسیر فسفات پنتوز (PPP) به عنوان یک مسیر متابولیکی کلیدی در گیاهان، نقش مهمی در افزایش تحمل به این تنشها ایفا میکند.
تولید NADPH و محافظت در برابر استرس اکسیداتیو
یکی از مهمترین عملکردهای مسیر PPP در سلولهای گیاهی، تولید NADPH است که منبع اصلی قدرت احیاکننده برای فرآیندهای آنتیاکسیدانی به شمار میرود. تنشهای زیستمحیطی باعث افزایش تولید گونههای فعال اکسیژن (ROS) میشوند که میتوانند به ساختارهای سلولی آسیب برسانند. NADPH تولید شده از مسیر PPP، به احیای گلوتاتیون و دیگر مولکولهای آنتیاکسیدانی کمک میکند و از آسیب اکسیداتیو جلوگیری میکند.
تنظیم متابولیسم کربوهیدراتها و سنتز ترکیبات حفاظتی
مسیر PPP علاوه بر تولید NADPH، ریبوز-5-فسفات را برای سنتز نوکلئوتیدها و اسیدهای نوکلئیک فراهم میکند که برای ترمیم DNA و رشد سلولی حیاتی است. همچنین، ترکیبات تولید شده در مسیر PPP به تولید پلیساکاریدهای دیواره سلولی و متابولیتهای ثانویه کمک میکنند که نقش حفاظتی در برابر تنشهای محیطی دارند.
فعالسازی آنزیمهای کلیدی مسیر PPP در پاسخ به تنش
مطالعات نشان دادهاند که آنزیمهای کلیدی مسیر PPP مانند گلوکز-6-فسفات دهیدروژناز (G6PD) تحت شرایط تنشهای مختلف، به ویژه خشکی و شوری، فعالتر میشوند. این افزایش فعالیت آنزیمی باعث افزایش تولید NADPH و تقویت سیستم آنتیاکسیدانی گیاه میشود و به آن کمک میکند تا بهتر با شرایط نامساعد سازگار شود.
نقش مسیر PPP در تنظیم پاسخهای سیگنالینگ
مسیر فسفات پنتوز همچنین در تنظیم مسیرهای سیگنالینگ مرتبط با پاسخ به تنش نقش دارد. NADPH به عنوان کوفاکتور در سنتز ترکیبات سیگنالینگ مانند نیتریک اکسید و ترکیبات فنیل پروپانوئید عمل میکند که در فعالسازی ژنهای پاسخگو به تنش موثرند. این فرآیندها به گیاه امکان میدهند که به سرعت و کارآمد به شرایط زیستمحیطی نامطلوب واکنش نشان دهد.
کاربردهای کشاورزی و بیوتکنولوژیک
با شناخت نقش حیاتی مسیر PPP در مقاومت گیاهان، مهندسی ژنتیکی برای افزایش فعالیت آنزیمهای این مسیر در گونههای کشاورزی، راهکاری مؤثر برای افزایش مقاومت گیاهان به تنشهای زیستمحیطی محسوب میشود. این رویکرد میتواند منجر به افزایش بازدهی محصولات کشاورزی در شرایط سخت و تغییرات اقلیمی شود.
چشماندازهای درمانی: هدف قرار دادن مسیر فسفات پنتوز در بیماریها
مسیر فسفات پنتوز (PPP) به دلیل نقشهای حیاتیاش در تنظیم متابولیسم سلولی، تولید NADPH، و بیوسنتز نوکلئوتیدها، به عنوان هدفی مهم در درمان بیماریهای مختلف مطرح شده است. اصلاح یا مهار این مسیر میتواند تأثیر قابل توجهی در کنترل بیماریهایی مانند سرطان، بیماریهای متابولیک، و اختلالات التهابی داشته باشد.
هدفگیری مسیر PPP در درمان سرطان
سلولهای سرطانی به دلیل افزایش نیاز به نوکلئوتیدها و قدرت احیاکننده برای مقابله با استرس اکسیداتیو، معمولاً مسیر PPP را فعالتر از سلولهای طبیعی نشان میدهند. مهار آنزیم کلیدی گلوکز-6-فسفات دهیدروژناز (G6PD)، که سرعتمحدودکننده در فاز اکسیداتیو مسیر است، میتواند رشد و تکثیر سلولهای سرطانی را کاهش دهد و مقاومت آنها به داروهای شیمیدرمانی را تضعیف کند. در نتیجه، توسعه داروهای مهارکننده G6PD و سایر آنزیمهای PPP ، یکی از رویکردهای مهم در درمان سرطانهای مقاوم به درمان است.
مداخله در بیماریهای متابولیک
در بیماریهای متابولیک مانند دیابت و سندرم متابولیک، اختلال در عملکرد مسیر PPP باعث افزایش استرس اکسیداتیو و التهاب میشود. هدفگیری دقیق این مسیر با استفاده از ترکیباتی که فعالیت آنزیمهای آن را تعدیل کنند، میتواند به بهبود متابولیسم گلوکز و کاهش عوارض ناشی از این بیماریها کمک کند. به علاوه، تنظیم مسیر PPP میتواند به کاهش تجمع چربی در کبد و بهبود کبد چرب غیرالکلی کمک نماید.
نقش مسیر PPP در کنترل پاسخهای التهابی و ایمنی
فعالسازی بیش از حد یا ناکافی مسیر فسفات پنتوز در سلولهای ایمنی مانند ماکروفاژها میتواند منجر به بروز اختلالات التهابی یا نقص در عملکرد ایمنی شود. داروهای هدفمند که بتوانند مسیر PPP را به منظور تعدیل پاسخ ایمنی تنظیم کنند، میتوانند در درمان بیماریهای خودایمنی، عفونتهای مزمن، و حتی برخی بیماریهای عصبی التهابی نقش مؤثری ایفا کنند.
استفاده از ترکیبات طبیعی و سنتزی در تنظیم مسیر PPP
مطالعات اخیر نشان دادهاند که برخی ترکیبات طبیعی مانند پلیفنولها، فلاونوئیدها و ترکیبات آنتیاکسیدانی میتوانند به عنوان مهارکنندههای ملایم آنزیمهای مسیر PPP عمل کنند. این یافتهها باعث شده تا تحقیقات بیشتری در زمینه استفاده از این مواد به عنوان درمانهای تکمیلی یا پیشگیرانه آغاز شود. همچنین، توسعه داروهای سنتزی با هدف خاص آنزیمهای مسیر PPP در مرحله آزمایشهای پیشبالینی و بالینی قرار دارد.
چالشها و فرصتهای پیش رو
اگرچه هدف قرار دادن مسیر PPP در درمان بیماریها پتانسیل بالایی دارد، اما به دلیل نقش گسترده و اساسی این مسیر در متابولیسم سلولی، حفظ تعادل بین مهار مؤثر و جلوگیری از آسیب به سلولهای طبیعی چالشی بزرگ محسوب میشود. توسعه داروهای با قابلیت هدفمندسازی سلولی و تنظیم دقیق فعالیت آنزیمها، کلید موفقیت در این حوزه خواهد بود.
کاربردهای بیوتکنولوژیکی و صنعتی مسیر فسفات پنتوز
مسیر فسفات پنتوز (PPP) به دلیل تولید NADPH و ترکیبات کربوهیدراتی واسطهای، نقش مهمی در بسیاری از فرآیندهای بیوتکنولوژیکی و صنعتی ایفا میکند. این مسیر به عنوان منبع اصلی تأمین قدرت احیاکننده NADPH، در تولید بیوشیمیایی ترکیبات ارزشمند و واکنشهای بیوسنتزی بسیار حیاتی است.
استفاده از مسیر PPP در تولید ترکیبات زیستی ارزشمند
NADPH تولید شده توسط مسیر فسفات پنتوز در واکنشهای کاهش آنزیمی، نظیر سنتز اسیدهای چرب، آمینواسیدها، و ترکیبات آنتیاکسیدانی، نقش حیاتی دارد. این قابلیت، مسیر PPP را به نقطه کانونی در مهندسی زیستی برای تولید زیستسوختها، داروهای طبیعی و آنزیمهای خاص تبدیل کرده است. برای مثال، در تولید بیوترکیباتی همچون پلیهیدروکسیآلکاناتها (PHA) که به عنوان پلاستیکهای زیستتخریبپذیر شناخته میشوند، تامین NADPH برای افزایش بازده تولید بسیار حیاتی است.
مهندسی مسیر PPP در میکروارگانیسمها برای افزایش بهرهوری
در زیستفناوری صنعتی، میکروارگانیسمهایی مانند باکتریها و مخمرها برای تولید مواد شیمیایی و دارویی مهندسی میشوند. تقویت فعالیت مسیر فسفات پنتوز در این ارگانیسمها باعث افزایش تولید NADPH و بهبود راندمان بیوسنتز محصولات میشود. مهندسی ژنتیکی آنزیمهای کلیدی مسیر PPP مانند G6PD، 6-فسفوگلوکونات دهیدروژناز، و ترانسکتولازها، منجر به بهبود عملکرد صنعتی این میکروارگانیسمها در تولید آنتیبیوتیکها، اسیدهای آلی و سایر متابولیتها شده است.
نقش مسیر PPP در بیوسنتز ترکیبات دارویی و آنتیاکسیدانها
مسیر PPP در سنتز ترکیباتی که خواص دارویی و آنتیاکسیدانی دارند، مانند فلاونوئیدها و سایر متابولیتهای ثانویه، نقش واسطهای دارد. مهندسی مسیر PPP میتواند منجر به تولید بهینه این ترکیبات در سیستمهای کشت سلولی و میکروبی شود که به کاهش هزینههای تولید و افزایش خلوص محصولات کمک میکند.
کاربردهای صنعتی در تولید آنزیمها و مواد شیمیایی
NADPH به عنوان یک کوفاکتور حیاتی در واکنشهای کاهشی آنزیمی، کاربرد گستردهای در صنایع داروسازی، تولید مواد شیمیایی دقیق و سنتز بیوشیمیایی دارد. مسیر فسفات پنتوز به طور غیرمستقیم در این فرآیندها نقش دارد و تقویت این مسیر در سلولهای تولیدکننده آنزیمها، افزایش بازده تولید و کاهش هزینهها را به دنبال دارد.
استفاده در صنایع غذایی و کشاورزی
در صنایع غذایی، کاربرد مهندسی مسیر PPP برای تولید ترکیبات آنتیاکسیدانی طبیعی و افزایش مقاومت میکروارگانیسمهای مفید به استرسهای اکسیداتیو بررسی شده است. همچنین، در کشاورزی، تقویت مسیر فسفات پنتوز در گیاهان میتواند منجر به افزایش مقاومت آنها به تنشهای زیستی و غیرزیستی شده و بهرهوری محصولات را ارتقاء دهد.
چشماندازهای آینده در کاربردهای صنعتی
با پیشرفت در فناوریهای زیستی و مهندسی ژنتیک، انتظار میرود که کاربردهای مسیر فسفات پنتوز در تولید ترکیبات پیچیدهتر، بیوسنسورها و سیستمهای کاتالیتیکی بیولوژیکی گسترش یابد. هدفگذاری دقیق و کنترل بیان آنزیمهای مسیر PPP میتواند به تولید محصولات صنعتی با کیفیت بالاتر و هزینه کمتر منجر شود.
جمعبندی و نتیجهگیری نهایی
مسیر فسفات پنتوز به عنوان یکی از مسیرهای کلیدی متابولیکی، نقش محوری در حفظ هموستازی سلولی و تأمین نیازهای بیوشیمیایی مختلف ایفا میکند. این مسیر نه تنها منبع اصلی NADPH مورد نیاز برای واکنشهای احیاکننده است، بلکه به تولید ریبوز-۵-فسفات به عنوان پیشساز نوکلئوتیدها و اجزای حیاتی بیوسنتزی کمک میکند. بررسیهای گسترده نشان دادهاند که مسیر PPP در تنظیم پاسخهای سلولی به استرسهای اکسیداتیو، حفظ تعادل متابولیکی و تنظیم سیستم ایمنی نیز نقش مهمی دارد.
علاوه بر نقشهای بنیادی در سلولهای جانوری و انسانی، اهمیت مسیر فسفات پنتوز در سلولهای گیاهی و میکروبی نیز برجسته است. این مسیر در تنظیم مقاومت به تنشهای زیستمحیطی، تولید ترکیبات آنتیاکسیدانی و حتی در فرایندهای بیوتکنولوژیکی و صنعتی کاربرد فراوان دارد. مهندسی مسیر PPP در میکروارگانیسمها، فرصتهای گستردهای برای تولید مواد زیستی با ارزش افزوده بالا و بهبود فرآیندهای صنعتی فراهم کرده است.
از نظر بالینی، اختلالات مرتبط با مسیر فسفات پنتوز میتوانند زمینهساز بیماریهای متابولیک، التهابی و حتی پیشرفت سرطان باشند. لذا هدفگیری و تنظیم این مسیر در درمانهای نوین اهمیت فزایندهای یافته است.
در نهایت، مسیر فسفات پنتوز نمایانگر یک شاهراه متابولیکی است که به کمک آن سلولها میتوانند نیازهای انرژی، بازسازی اکسیداتیو، و سنتز مولکولهای حیاتی را بهطور متعادل مدیریت کنند. درک عمیقتر مکانیسمهای تنظیمی و کاربردهای مسیر PPP، نه تنها به توسعه درمانهای هدفمند کمک میکند، بلکه به پیشرفت فناوریهای زیستی و صنعتی نیز جهت میدهد.