کاربرد کریسپر
فصل ۱: مقدمهای بر ویرایش ژنوم و سیستم CRISPR
-
مروری کلی بر ویرایش ژنوم
-
تاریخچهی تکامل تکنولوژیهای ویرایش ژنتیکی تا رسیدن به سیستم CRISPR
-
معرفی سیستمهای مختلف CRISPR-Cas شامل Cas9، Cas12، Cas13
-
تعریف مفهومی «مولاجین (Mulagene)
فصل ۲: مکانیزم عملکرد سیستمهای CRISPR-Cas
-
طراحی RNA راهنما (gRNA)
-
معرفی پروتئینهای Cas و گونههای مختلف آنها
-
مفهوم توالیهای PAM
-
تفاوت بین مسیرهای ترمیم وابسته به الگو (HDR) و اتصال غیرهمولوگ انتهاها (NHEJ)
-
بازده و دقت ویرایش
-
روشهای انتقال (تحویل): ویروسی، لیپوزومی، الکتروپوریشن، نانوذرات
فصل ۳: استراتژیهای Knockout با استفاده از CRISPR
-
ایجاد اختلال ژنی با ایندلها (درج و حذفهای کوچک)
-
ایجاد جهشهای شیفت فریم (Frameshift)
-
هدفگیری اگزونها
-
طراحی مؤثر gRNA برای Knockout
-
اعتبارسنجی Knockout با روشهایی مانند PCR، توالییابی Sanger و نسل جدید (NGS)
-
تحلیل اثرات خارج از هدف (Off-target) و روشهای کاهش آن
فصل ۴: غربالگری ژنتیکی مبتنی بر CRISPR
-
مقایسه غربالگریهای تجمعی (Pooled) و غربالگریهای آرایهای (Arrayed)
-
غربالگریهای با انتخاب مثبت و منفی
-
طراحی کتابخانههای gRNA
-
کاربردها در سرطان، ویروسشناسی، متابولیسم و ایمنیشناسی
-
روشهای خوانش: کاهش حضور، گزارشگرها، RNA-seq تکسلولی
-
تحلیل دادهها و تفسیر نتایج
فصل ۵: روشهای ویرایش همزمان چند ژن (Mulagene)
-
ویرایش همزمان چند ناحیه ژنومی
-
طراحی gRNAهای متوالی و پیوسته
-
بیان پلیسیسترونی gRNA
-
استفاده از گونههای Cas برای ویرایش چندهدفی
-
کنترل زمانی و مکانی ویرایش
-
ابزارهای زیستفناوری ترکیبی مانند CRISPRa/i برای اهداف چندگانه
فصل ۶: ملاحظات عملی در ویرایش CRISPR
-
انتخاب مناسبترین سیستم Cas و روش انتقال
-
ویژگیهای خاص سلولهای هدف
-
بهینهسازی شرایط ویرایش
-
رفع مشکلات رایج: بازدهی پایین، سمیت، فنوتیپهای غیرمنتظره
-
مطالعه موردی در مدلهای مختلف زیستی: سلولهای پستانداران، ارگانوئیدها، گورخرماهی، گیاهان
فصل ۷: چالشهای اخلاقی و نظارتی
-
تفاوت بین ویرایش سلولهای زایشی (germline) و بدنی (somatic)
-
بحثهای جنجالی پیرامون ویرایش جنین انسانی
-
چارچوبهای قانونی در جهان: FDA (آمریکا)، EMA (اروپا)، دستورالعملهای سازمان جهانی بهداشت (WHO)
-
نگرانیهای امنیت زیستی و سوءاستفادههای دوگانه
-
مسائل اخلاقی در غربالگریهای پرتوان (high-throughput)
فصل ۸: کاربردهای پیشرفته و مطالعات موردی
-
کاربرد CRISPR در درمان دقیق سرطان
-
درمان ژنی و اصلاح بیماریهای نادر
-
تشخیصهای مبتنی بر CRISPR مانند SHERLOCK و DETECTR
-
ویرایش اپیژنوم و CRISPRi/a
-
استفاده از ژنومیک عملکردی پرتوان در کشف دارو
فصل ۹: جهتگیریها و نوآوریهای آینده
-
ویرایش پایه (Base Editing) و ویرایش نخست (Prime Editing)
-
ترکیب CRISPR با هوش مصنوعی و یادگیری ماشین
-
هدفگیری RNA بهصورت بلادرنگ (Cas13)
-
روشهای نوین انتقال ویرایشگرها
-
حرکت به سمت ویرایش ژنوم در سطح درمانی و کلینیکی
فصل اول: مقدمهای بر ویرایش ژنتیکی و CRISPR
ویرایش ژنتیکی یکی از تحولآفرینترین پیشرفتها در زیستشناسی مولکولی مدرن محسوب میشود. این فناوریها با فراهم کردن امکان تغییرات دقیق در DNA یک موجود زنده، انقلابی در حوزههای ژنتیک، زیستفناوری و پزشکی ایجاد کردهاند. در میان این فناوریها، CRISPR (تکرارهای کوتاه همفاصله خوشهای پالیندروم) به عنوان ابزاری بسیار انعطافپذیر و پراستفاده مطرح شده که سادگی، کارایی و دقت بیسابقهای را ارائه میدهد. این فصل مفاهیم بنیادی ویرایش ژنتیکی را با تمرکز بر سیستم CRISPR-Cas معرفی کرده و زمینه را برای بررسی عمیقتر استراتژیهای کاربردی مانند حذف ژن (Knockout)، غربالگریهای پرتوان و ویرایش چندگانه (Mulagene) در فصلهای بعدی فراهم میکند.
ایدهی دستکاری ژنوم موضوع جدیدی نیست. روشهای اولیه تغییر ژنتیکی مانند تکنولوژی DNA نوترکیب و هدفگیری ژنی با استفاده از نوترکیبی همولوگ، زیرساختهایی برای روشهای امروزی ویرایش ژنوم ایجاد کردند. با این حال، این روشهای اولیه زمانبر، پرهزینه و محدود از نظر دقت و گستره کاربرد بودند. ظهور آنزیمهای نوکلئاز قابل برنامهریزی مانند ZFNها (Zinc Finger Nucleases)، TALENها (Transcription Activator-Like Effector Nucleases) و در نهایت سیستمهای CRISPR-Cas، تحولی عظیم در مهندسی ژنوم بهوجود آوردند. در میان این ابزارها، CRISPR به دلیل سادگی طراحی، سرعت بالا و توانایی هدفگیری تقریباً هر ژنی در هر موجودی که توالی PAM مناسب داشته باشد، برتری ویژهای دارد.
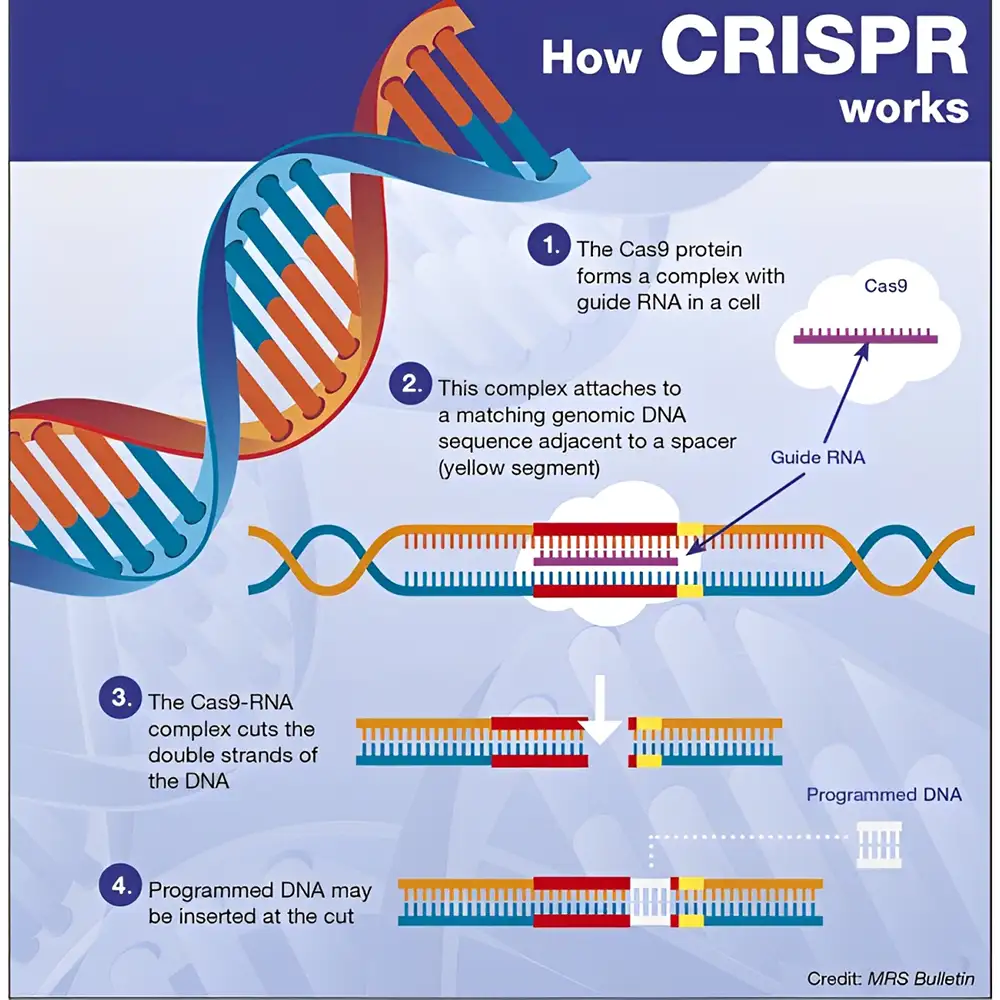
CRISPR در ابتدا به عنوان یک سیستم ایمنی تطبیقی در پروکاریوتها (باکتریها و آرکئاها) کشف شد که به آنها اجازه میداد در برابر ویروسها و پلاسمیدهای مهاجم از خود دفاع کنند. این سیستم با ادغام قطعات کوچکی از DNA خارجی در ژنوم میزبان در محل آرایههای CRISPR عمل میکند. این قطعات به عنوان حافظهی ژنتیکی از عفونتهای گذشته عمل کرده و به RNAهای کوتاهی تبدیل میشوند که پروتئینهای Cas (مانند Cas9) را هدایت میکنند تا در حملات بعدی، توالیهای مشابه را شناسایی و تخریب کنند. این مکانیسم طبیعی، امروزه برای ویرایش ژنوم در آزمایشگاه بازطراحی شده است، به این صورت که با استفاده از gRNAهای مصنوعی، میتوان Cas9 را به نقاط خاصی از ژنوم هدایت کرد تا شکست دو رشتهای در DNA ایجاد شود و سپس توسط سیستمهای ترمیم سلولی بازسازی گردد.
در ویرایش مبتنی بر CRISPR، دو مسیر اصلی ترمیم DNA مورد استفاده قرار میگیرند:
-
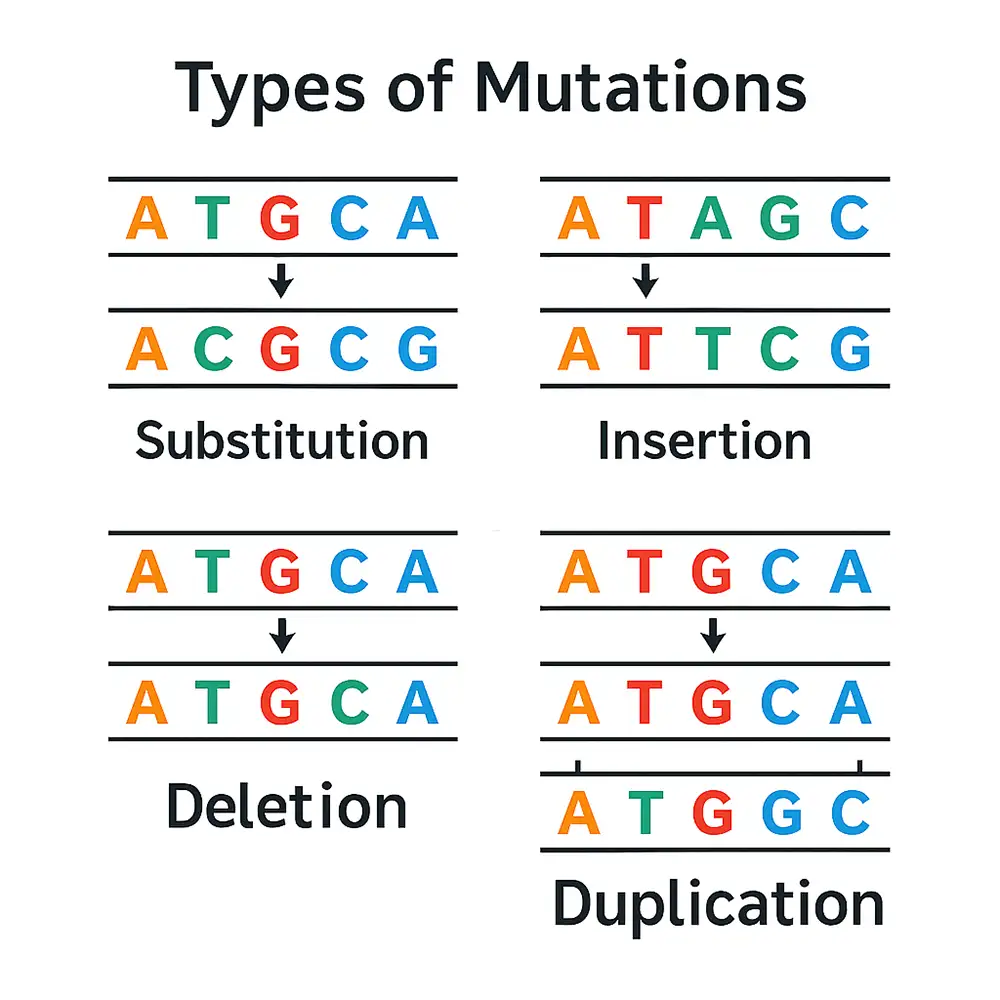
اتصال غیرهمولوگ انتهاها (NHEJ): مسیری غیردقیق است که معمولاً منجر به درج یا حذفهای کوچک (indel) در محل شکست میشود. این فرآیند میتواند عملکرد ژن را مختل کند، که در آزمایشهای Knockout بسیار مطلوب است.
-
ترمیم هدایتشده توسط الگو (HDR): مسیری دقیقتر است که امکان درج یا اصلاح دقیق توالیها را با استفاده از یک الگوی DNA فراهم میکند، اما معمولاً بازدهی کمتری دارد و به شرایط خاصی از نظر نوع سلول و چرخه سلولی نیازمند است.
توانایی استفاده هدفمند از این مسیرهای ترمیم، اساس انطباق CRISPR برای اهداف تحقیقاتی و درمانی مختلف است.
یکی از مفاهیم نوظهور که به کاربردهای پیشرفته CRISPR مرتبط است، ویرایش چندگانه ژنی یا همان چیزی است که در این متن با عنوان "مولاجین (Mulagene)" از آن یاد شده است. این رویکرد شامل هدفگیری همزمان چندین ژن یا ناحیه ژنومی در یک سلول است. این توانایی باعث شده که CRISPR از صرفاً یک ابزار برای خاموش کردن ژنها فراتر برود و بتواند برای مدلسازی تعاملات پیچیده ژنی، مهندسی مسیرهای متابولیکی و غربالگریهای ترکیبی ژنی استفاده شود. در عمل، این کار با طراحی و تحویل چند gRNA بهطور همزمان، معمولاً به صورت پیوسته یا در قالب ساختارهای پلیسیسترونی، در یک سیستم ویرایشی انجام میشود. همانطور که در فصلهای بعدی خواهیم دید، این استراتژی در زمینههایی مانند ژنومیک عملکردی، تحقیقات سرطان و زیستشناسی ترکیبی به یک رکن اساسی تبدیل شده است.
فناوری CRISPR تاکنون هم در آزمایشگاه و هم در حوزه بالینی، نتایج قابلتوجهی بهدست آورده است. در تحقیقات علمی، از آن برای بررسی عملکرد ژنها، مدلسازی بیماریها و مطالعه فرآیندهای رشد و تمایز استفاده میشود. در کشاورزی، CRISPR امکان توسعهی محصولات مقاوم به خشکی، آفات یا با ارزش غذایی بالاتر را فراهم کرده است. در پزشکی نیز، آزمایشهای بالینی در حال انجام است تا با استفاده از CRISPR، جهشهای ژنتیکی مسبب بیماریهایی مانند کمخونی داسیشکل، تالاسمی بتا و نابینایی ارثی اصلاح شوند. علاوه بر این، انعطافپذیری بالای پلتفرم CRISPR منجر به توسعه ابزارهای مشتقی همچون CRISPRi (مهار عملکرد ژن)، CRISPRa (فعالسازی ژن)، ویرایش پایه (Base Editing) و ویرایش نخست (Prime Editing) شده که کاربرد آن را فراتر از ایجاد شکست در DNA بردهاند.
با وجود تمام مزایا، CRISPR با چالشهایی نیز مواجه است. مسائلی مانند:
-
اثرات خارج از هدف (Off-target)
-
پاسخ ایمنی به پروتئینهای Cas
-
تغییرپذیری در بازدهی ویرایش
-
و محدودیتهای انتقال سیستم ویرایشی
باید در کاربردهای آزمایشگاهی و درمانی بهدقت مورد بررسی قرار گیرند. همچنین، مسائل اخلاقی مربوط به ویرایش ژنوم جنینی انسان، بحثهای فراوانی را در محافل علمی و عمومی بهوجود آوردهاند. این چالشها نشان میدهند که وجود مقررات سختگیرانه، نظارت شفاف و نوآوری مسئولانه در توسعهی این فناوری، ضروری است.
هدف این مقاله مرجع، فراتر رفتن از یک مرور کلی و تمرکز بر کاربردهای مسألهمحور CRISPR است. تمرکز اصلی بر استراتژیهای حذف ژن، پلتفرمهای غربالگری تجمعی و آرایهای، و فرآیندهای ویرایش چندگانه (Mulagene) خواهد بود. در فصلهای بعدی، بررسی خواهیم کرد که چگونه CRISPR برای حل مشکلات واقعی زیستی و پزشکی بهینهسازی شده، همراه با دادههای روز، پروتکلها و مطالعات موردی. با تکیه بر مفاهیم ارائهشده در این فصل، تلاش خواهیم کرد که خواننده را به درک نظری عمیق و مهارت عملی در کاربردهای پیشرفتهی CRISPR مجهز کنیم.
فصل دوم: مکانیزم سیستمهای CRISPR-Cas
دقت و انعطافپذیری خارقالعادهی سیستم CRISPR-Cas از مکانیزم مولکولی هماهنگ و دقیقی نشأت میگیرد؛ مکانیزمی که ریشه در پاسخ ایمنی باکتریها دارد اما امروزه بهصورت گسترده برای ویرایش ژنوم در انواع موجودات زنده بازطراحی شده است. درک این سازوکار برای کاربرد مؤثر در ویرایش ژن، آزمایشهای Knockout و غربالگریهای پرتوان بسیار ضروری است. در این فصل، اجزاء اصلی و فرایندهای کلیدی سیستم CRISPR-Cas شامل نقشهای RNA راهنما (gRNA)، آنزیمهای Cas، شناسایی هدف، برش DNA و مسیرهای ترمیم بررسی میشوند. همچنین، به گونهها و اصلاحات مختلف سیستم CRISPR نیز پرداخته خواهد شد که کاربرد آن را فراتر از Cas9 کلاسیک گسترش دادهاند.
در قلب عملکرد سیستم CRISPR-Cas، یک مکانیزم سهجزئی ساده ولی قدرتمند وجود دارد:
-
RNA راهنما (gRNA) قابل برنامهریزی
-
آنزیم نوکلئاز Cas
-
توالی هدف DNA که در مجاورت یک توالی PAM قرار دارد
gRNA طوری طراحی میشود که مکمل ناحیهای خاص از DNA هدف باشد و به عنوان راهنمای مولکولی، پروتئین Cas را به محل دقیق در ژنوم هدایت میکند. PAM یک توالی کوتاه DNA است که در نزدیکی توالی هدف قرار دارد و برای شناسایی و برش توسط Cas حیاتی است. برای پرکاربردترین سیستم یعنی SpCas9 (منشأ گرفته از باکتری Streptococcus pyogenes)، توالی PAM کلاسیک عبارت است از: 5'-NGG-3'. البته نسخههایی از Cas9 با ترجیحات PAM متفاوت نیز توسعه یافتهاند تا گسترهی هدفگیری افزایش یابد.
gRNA معمولاً از دو بخش تشکیل شده است:
-
crRNA: بخشی که شامل توالی مکمل DNA هدف است
-
tracrRNA: بخشی که به تشکیل کمپلکس با Cas کمک میکند
در سامانههای مهندسیشدهی امروزی، این دو RNA در قالب یک RNA راهنمای ترکیبی (sgRNA) به هم متصل میشوند تا طراحی سادهتر و کارایی بالاتر شود. پس از اتصال sgRNA به پروتئین Cas9، کمپلکس حاصل دچار تغییر ساختاری میشود که به آن توانایی اتصال و برش DNA را میدهد. این کمپلکس پس از یافتن توالی PAM در ژنوم، DNA را باز کرده و تطابق آن را با gRNA بررسی میکند. در صورت وجود تطابق کافی، Cas9 شکست دو رشتهای (DSB) در حدود سه نوکلئوتید قبل از PAM ایجاد میکند.
ایجاد شکست دو رشتهای، مرحلهای بحرانی است که مکانیسمهای ترمیم DNA سلولی را فعال میکند و همین مسیرهای ترمیمی، اساس ویرایش ژنتیکی را تشکیل میدهند. دو مسیر اصلی ترمیم عبارتاند از:
-
اتصال غیرهمولوگ انتهاها (NHEJ):
-
مکانیزمی سریع ولی خطادار
-
غالباً منجر به درج یا حذف (indel) در محل شکست میشود
-
ممکن است قابخوانی ژن را مختل کند و باعث غیرفعالسازی عملکرد ژن شود
-
این مسیر در اکثر سلولها غالب است و برای آزمایشهای Knockout بسیار کاربردی است
-
-
ترمیم هدایتشده توسط الگو (HDR):
-
از یک الگوی DNA همولوگ (خواه از کروموزوم خواه از خارج سلول) استفاده میکند
-
امکان ویرایش دقیق مانند اصلاح نقطهای یا درج توالی خاص را فراهم میآورد
-
کارایی پایینتری دارد و فقط در فازهای S و G2 چرخه سلولی فعال است
-
Cas9 تنها نوکلئازی نیست که در CRISPR کاربرد دارد. گونههای دیگر مانند Cas12 (یا Cpf1)، Cas13 و Cas14 نیز با ویژگیهای خاص خود، دامنه کاربرد CRISPR را گسترش دادهاند:
-
Cas12:
-
توالی PAM آن غنی از T است
-
برش دوتایی را با ایجاد انتهای چسبنده ۵' انجام میدهد
-
برای کلونینگ و HDR مفید است
-
-
Cas13:
-
به جای DNA، RNA را هدف میگیرد
-
در کاربردهایی مثل خاموشسازی RNA، ویرایش رونویسی و تشخیص RNA استفاده میشود
-
-
Cas14:
-
نوکلئازی بسیار کوچک است
-
میتواند بدون نیاز به PAM DNA را هدف بگیرد
-
مناسب برای ژنومهایی با محتوای AT بالا است
-
کشف و مهندسی این انواع Cas باعث بهبود چشمگیر در دقت، کارایی و انعطافپذیری CRISPR شده است.
یکی از پیشرفتهای مهم در افزایش دقت CRISPR، توسعهی نسخههای Cas9 با دقت بالا (High-Fidelity) است. نسخه وحشی Cas9 گاهی توالیهایی با تطابق نسبی را هم برش میزند و به این ترتیب اثرات خارج از هدف (Off-target) ایجاد میکند. برای مقابله با این مشکل، نسخههایی مانند:
-
eSpCas9
-
SpCas9-HF1
-
HypaCas9
توسعه یافتهاند که دارای جهشهایی برای کاهش اتصالهای غیرتخصصی به DNA هستند و در عین حال فعالیت دقیق خود را حفظ میکنند. این نسخهها در کاربردهای درمانی اهمیت ویژهای دارند، زیرا ویرایشهای ناخواسته ممکن است عواقب جبرانناپذیری داشته باشند.
همچنین استراتژیهایی مانند استفاده از gRNAهای کوتاهشده یا استفاده از Cas9های دوگانه به عنوان "نیکاز جفتشده" (Paired Nickases)—که بهجای یک برش دوتایی، دو برش تکرشتهای نزدیک به هم ایجاد میکنند—برای کاهش اثرات خارج از هدف به کار میروند.
روش انتقال اجزای ویرایشگر CRISPR به داخل سلول هدف یکی دیگر از ملاحظات مهم در کاربرد آن است. این روشها بسته به نوع سلول، موجود زنده، و هدف آزمایش متفاوتاند و شامل:
-
ناقلهای ویروسی (مانند لنتیویروس یا AAV)
-
الکتروپوریشن
-
نانوذرات لیپیدی
-
روشهای فیزیکی مانند میکروتزریق
هر روش مزایا و معایب خاص خود را دارد:
-
ناقلهای ویروسی دارای راندمان انتقال بالا و بیان طولانیمدت هستند، اما ممکن است باعث ادغام ناخواسته در ژنوم یا واکنش ایمنی شوند
-
روشهای غیرویروسی ایمنتر هستند اما کارایی پایینتری دارند و باید برای هر کاربرد بهینهسازی شوند
پیشرفتهای اخیر CRISPR منجر به توسعه سیستمهای تغییریافته با عملکردهای جایگزین شدهاند. برای مثال:
-
Cas9 غیر فعالشده کاتالیتیکی (dCas9):
-
توانایی برش DNA را ندارد، اما قابلیت اتصال به DNA را حفظ میکند
-
وقتی با فعالکنندهها یا مهارکنندههای رونویسی ترکیب میشود، میتواند بیان ژن را افزایش یا کاهش دهد (در قالب سیستمهای CRISPRa و CRISPRi)
-
این سیستمها امکان تنظیم برگشتپذیر و قابل کنترل بیان ژن را فراهم میکنند بدون تغییر در توالی DNA
-
این ابزارها بهطور گسترده در زمینههای ژنومیک عملکردی، زیستشناسی رشد، و زیستشناسی ترکیبی استفاده میشوند.
فصل سوم: استراتژیهای Knockout ژن با استفاده از CRISPR
حذف ژن (Gene Knockout) با استفاده از سیستم CRISPR-Cas9 به یکی از ابزارهای اساسی در زیستشناسی مولکولی تبدیل شده است. این روش به پژوهشگران امکان میدهد عملکرد دقیق یک ژن خاص را مختل کرده و پیامدهای فنوتیپی آن را با دقت بیسابقهای مطالعه کنند. در این استراتژی، ابتدا شکست دو رشتهای (Double-Strand Break, DSB) در ژن هدف ایجاد میشود و سپس ترمیم آن توسط مسیر خطاپذیر اتصال غیرهمولوگ انتهاها (NHEJ) انجام میگیرد؛ مسیری که غالباً منجر به درج یا حذفهای کوچکی (indels) در محل برش شده و در نتیجه توالی کدکننده ژن را دچار اختلال میکند. این فصل به بررسی مبانی نظری حذف ژن با CRISPR، ملاحظات عملی در طراحی gRNA، روشهای انتقال به سلول، روشهای اعتبارسنجی و خطاهای رایج میپردازد و همچنین به نوآوریهای اخیر اشاره میکند که موجب افزایش کارایی و دقت Knockout ژنی شدهاند.
طراحی gRNA: قلب استراتژی Knockout
در مرکز هر آزمایش CRISPR-Knockout، طراحی دقیق RNA راهنما (sgRNA) قرار دارد؛ همان مولکولی که پروتئین Cas9 را به نقطه هدف در ژنوم هدایت میکند. طراحی مؤثر sgRNA مستلزم شناسایی توالیهایی است که:
-
فعالیت هدفگیری بالا داشته باشند
-
حداقل اثرات خارج از هدف (off-target) را ایجاد کنند
برای این منظور، ابزارهای محاسباتی نظیر CRISPOR، Benchling و CHOPCHOP بهطور گسترده استفاده میشوند. این ابزارها الگوریتمهایی برای پیشبینی عملکرد sgRNA در اختیار کاربر قرار میدهند و معیارهایی مانند کارایی، پایداری ترمودینامیکی و خطرات خارج از هدف را ارزیابی میکنند. با این حال، توصیه میشود چند gRNA مختلف برای هر ژن آزمایش شود، زیرا کارایی آنها ممکن است بسته به نوع سلول و وضعیت سیستم ترمیم DNA متفاوت باشد.
روشهای انتقال CRISPR به سلولها
پس از انتخاب sgRNA مناسب، انتخاب روش انتقال اجزای CRISPR به سلول هدف مرحلهای حیاتی است. روشهای رایج عبارتاند از:
-
ترانسفکشن پلاسمید
-
کمپلکسهای ریبونوکلئوپروتئینی (RNP)
-
ناقلهای ویروسی
-
الکتروپوریشن
هر روش دارای مزایا و معایب خاص خود است:
-
RNPها: عملکرد سریع و گذرا دارند، که باعث کاهش اثرات خارج از هدف میشود
-
ویروسها: کارایی بالا و بیان پایدار دارند؛ مناسب برای سلولهای سختویرایشپذیر یا کاربردهای درونزنده (in vivo)
انتخاب روش انتقال بستگی به نوع سلول (اولیه یا جاودانهشده)، حجم کار (تکسلولی یا پرتوان) و اینکه آیا هدف حذف ژن موقت یا دائمی است، دارد.
اعتبارسنجی حذف ژن: فراتر از برش DNA
پس از انتقال موفق و احتمال ویرایش ژنی، اعتبارسنجی Knockout ضروری است. این اعتبارسنجی از مراحل زیر تشکیل میشود:
-
ژنوتیپگیری: برای تأیید وجود indel در محل هدف
-
روشها: آزمون عدم تطابق T7E1، توالییابی Sanger، و توالییابی نسل جدید (NGS)
-
-
بررسی سطح رونویسی و ترجمه:
-
صرف وجود indel به معنی از بین رفتن عملکرد ژن نیست
-
بررسی با qPCR، RT-PCR و وسترن بلات برای تأیید کاهش یا حذف RNA/پروتئین
-
در بسیاری موارد، آزمایشهای عملکردی نیز لازم هستند تا اطمینان حاصل شود که فنوتیپ مورد نظر واقعاً به حذف ژن مربوط است
-
اثرات خارج از هدف و راههای کاهش آن
یکی از چالشهای مهم در آزمایشهای CRISPR، ایجاد برش در مکانهای غیرهدف (Off-target) است. این برشها معمولاً به دلیل تشابه نسبی توالیها با gRNA رخ میدهند و میتوانند نتایج آزمایش را مخدوش کنند.
روشهای کاهش این اثرات شامل:
-
استفاده از نسخههای با دقت بالاتر Cas9 مانند:
-
SpCas9-HF1
-
eSpCas9
-
-
استفاده از نیکازهای جفتشده (Paired Nickases):
دو Cas9 اصلاحشده بهجای یک شکست دوتایی، دو شکست تکرشتهای مجاور ایجاد میکنند که تنها در صورت اتصال هر دو gRNA برش کامل اتفاق میافتد -
روشهای تجربی برای شناسایی محلهای برش ناخواسته:
-
GUIDE-seq
-
CIRCLE-seq
-
این تکنیکها به نقشهبرداری دقیق از محلهای برش کمک میکنند و اطمینان از اختصاصی بودن Knockout ژن را افزایش میدهند.
Knockout در مقیاس گسترده: غربالگریهای پرتوان
در پروژههای بزرگ، از کتابخانههای CRISPR برای Knockout در مقیاس ژنوم استفاده میشود. این کتابخانهها شامل هزاران gRNA هستند که تقریباً تمام ژنهای کدکننده را هدف میگیرند. این gRNAها بهصورت تجمعی به سلولها تحویل داده میشوند.
آزمونهای انتخابی—مانند بررسی زندهمانی سلول در حضور دارو یا مقاومت به ویروس—نشان میدهند که حذف کدام ژنها باعث ایجاد فنوتیپ خاص شده است. پس از غربالگری، با استفاده از توالییابی عمیق، میتوان فراوانی هر gRNA را تعیین و ژنهای مؤثر را شناسایی کرد.
این روش باعث کشف تنظیمکنندههای کلیدی در مسیرهایی مانند ترمیم DNA، پاسخ ایمنی و بقای سلولهای سرطانی شده است.
نوآوریهای جدید در استراتژیهای Knockout
پیشرفتهای جدید باعث افزایش کنترل زمانی و مکانی در حذف ژنها شدهاند:
-
سیستمهای القایی و بافتویژه:
-
سیستم Cas9 القایی با دگزاسیکلین امکان Knockout تحت شرایط کنترلی را فراهم میکند
-
سیستمهای مبتنی بر Cre-Lox، حذف ژن در بافتهای خاص در مدلهای جانوری را ممکن میسازند
-
-
ویرایشگرهای پایه (Base Editors) و ویرایشگرهای نخست (Prime Editors):
با اینکه بیشتر برای ایجاد تغییرات نقطهای استفاده میشوند، اما میتوانند کدون توقف زودهنگام یا اختلال در نواحی برش و اتصال RNA ایجاد کنند و بدون ایجاد شکست دو رشتهای، Knockout مؤثری ایجاد کنند
این ابزارها، دامنه استراتژیهای دستکاری ژن را گسترش داده و راههای جایگزینی برای حذف کلاسیک ژنها ارائه کردهاند.
پایش ژنتیکی (Genetic screening) همواره ابزاری قدرتمند برای درک عملکرد ژنها و شناسایی اهداف درمانی جدید بوده است. ظهور فناوری CRISPR این حوزه را متحول کرده و امکان ایجاد تغییرات دقیق، کارآمد و مقیاسپذیر را در سراسر ژنوم فراهم ساخته است. صفحهگذاریهای ژنتیکی مبتنی بر CRISPR به پژوهشگران اجازه میدهد که ژنها را بهصورت سیستماتیک خاموش (knockout)، فعالسازی یا سرکوب کنند تا فرآیندهای پیچیده زیستی را بررسی کرده، ژنهای حیاتی در بیماریها را شناسایی نموده و مسیرهای مرتبط با مقاومت دارویی، ایمنی و متابولیسم را کشف نمایند.
در این فصل، اصول بنیادین، روشها، کاربردها و چالشهای پایش ژنتیکی با CRISPR بررسی میشود. تفاوت میان پایشهای تجمیعی (pooled) و صفبندیشده (arrayed)، راهبردهای انتخاب مثبت و منفی، طراحی کتابخانه gRNA، روشهای خوانش نتایج (readout) و چارچوبهای تحلیل دادهها نیز معرفی خواهند شد. همچنین کاربرد این ابزار در زمینههایی مانند بیولوژی سرطان، ویروسشناسی، متابولیسم و ایمنیشناسی مورد بحث قرار میگیرد.
۴.۱ انواع صفحهگذاری CRISPR: تجمیعی در برابر صفبندیشده
۴.۱.۱ پایش تجمیعی (Pooled Screening)
در پایشهای تجمیعی، یک کتابخانه پیچیده از gRNAها که هزاران ژن را هدف قرار میدهد، به یک جمعیت سلولی وارد میشود. هر سلول معمولاً فقط یک gRNA را دریافت میکند، که منجر به جمعیتی متنوع میشود که در هر سلول یک ژن خاص خاموش شده است.
فرآیند کار: پس از ترانسداکشن، سلولها تحت یک فرآیند انتخاب قرار میگیرند (مثل درمان با دارو، عفونت ویروسی یا جداسازی بر اساس فنوتیپ). سپس DNA استخراج میشود و با توالییابی نسل جدید (NGS)، فراوانی هر gRNA اندازهگیری میشود. تغییرات در میزان gRNAها نشاندهنده ژنهایی هستند که بر فنوتیپ موردنظر تأثیر دارند.
مزایا: کمهزینه، بسیار مقیاسپذیر، مناسب برای آزمایشهای در مقیاس ژنومی، و سازگار با روشهای خوانش تجمیعی.
محدودیتها: فقط برای فنوتیپهای سلولمحور (cell-autonomous) مناسب بوده و نیاز به راهبردهای انتخابی قوی دارد.
۴.۱.۲ پایش صفبندیشده (Arrayed Screening)
در این روش، gRNAها بهصورت مجزا یا در گروههای کوچک به چاهکها یا محیطهای جداگانه منتقل میشوند و امکان مشاهده مستقیم فنوتیپ وجود دارد.
فرآیند کار: هر چاهک حاوی سلولهایی است که با یک gRNA خاص ترنسفکت یا ترانسدوس شدهاند. فنوتیپها با میکروسکوپ، فلوسایتومتری یا آزمونهای بیوشیمیایی تحلیل میشوند.
مزایا: مناسب برای فنوتیپهای پیچیده مانند تغییرات مورفولوژیک، آنالیزهای چندپارامتری یا تستهای گزارشگر (reporter assays).
محدودیتها: پرهزینه، زمانبر و دشوار برای اجرا در مقیاس ژنومی کامل.
۴.۲ انتخاب مثبت در برابر انتخاب منفی
۴.۲.۱ انتخاب مثبت (Positive Selection)
در این نوع پایش، ژنهایی شناسایی میشوند که از دست دادن یا افزایش فعالیت آنها باعث مزیت رشد یا بقا تحت شرایط انتخابی میشود.
مثال: خاموشسازی ژنی که باعث مقاومت دارویی میشود، سلولهای مقاوم را در جمعیت حفظ میکند.
نتیجه: فراوانی gRNAهایی که ژنهای مقاومتزا را هدف قرار دادهاند، افزایش مییابد.
۴.۲.۲ انتخاب منفی (Negative Selection | Dropout Screens)
در این روش، ژنهای ضروری برای بقا یا تکثیر سلولی شناسایی میشوند. سلولهایی که gRNA آنها ژنهای حیاتی را هدف قرار داده، از جمعیت حذف میشوند.
مثال: شناسایی انکوژنها یا ژنهای بقاء در سلولهای سرطانی.
نتیجه: فراوانی gRNAهای مربوط به ژنهای حیاتی کاهش مییابد.
۴.۳ طراحی کتابخانه gRNA
موفقیت یک پایش CRISPR بهشدت به کیفیت و طراحی کتابخانه gRNA بستگی دارد.
۴.۳.۱ پوشش هدف (Target Coverage)
کتابخانههای ژنومی کامل، معمولاً برای هر ژن ۳ تا ۶ gRNA مستقل دارند تا از لحاظ آماری قوی باشند.
کتابخانههای متمرکز، زیرمجموعههایی از ژنها را هدف قرار میدهند (مثلاً کینازها، فاکتورهای رونویسی یا آنزیمهای متابولیکی).
۴.۳.۲ کارایی gRNA
-
انتخاب gRNAهایی با بالاترین پیشبینی کارایی برش بر اساس توالی و ساختار دوم.
-
اجتناب از gRNAهایی با پیشبینی اثرات خارج از هدف (off-target).
۴.۳.۳ سنتز و کلونسازی کتابخانه
کتابخانهها بهصورت پول الیگونوکلئوتیدی سنتز و در وکتورهای لنتیویروسی کلون میشوند.
کنترل کیفیت با توالییابی جهت اطمینان از حضور تمام gRNAها انجام میشود.
۴.۴ کاربردهای صفحهگذاری CRISPR
CRISPR توانسته حوزههای بسیاری از زیستشناسی را دگرگون کند:
۴.۴.۱ بیولوژی سرطان
-
شناسایی ژنهای حیاتی برای بقاء و رشد تومور.
-
کشف تعاملات کشندهی ترکیبی (synthetic lethal).
-
فهم سازوکارهای مقاومت دارویی.
۴.۴.۲ ویروسشناسی
-
شناسایی فاکتورهای میزبان برای عفونت، تکثیر و فرار ایمنی ویروس.
-
یافتن اهداف دارویی ضدویروسی.
۴.۴.۳ متابولیسم
-
شناسایی ژنهای مؤثر در حسگری مواد مغذی، انرژیزایی و بازآرایی متابولیکی.
۴.۴.۴ ایمنیشناسی
-
شناسایی تنظیمکنندههای فعالسازی، تمایز و تولید سایتوکاین در سلولهای ایمنی.
-
پایش ژنهایی که مسیرهای نقطهای کنترلی ایمنی را تغییر میدهند.
۴.۵ راهبردهای خوانش نتایج (Readout)
خوانش صحیح و دقیق نتایج برای موفقیت پایش ضروری است.
۴.۵.۱ Dropout Screens با NGS
-
توالییابی بارکد gRNAها قبل و بعد از انتخاب.
-
تحلیل آماری برای شناسایی gRNAهای کاهشیافته یا افزایشیافته.
۴.۵.۲ آزمونهای گزارشگر (Reporter Assays)
-
استفاده از گزارشگرهای فلورسانس یا لومینسانس که به خروجی فنوتیپی متصلاند.
-
اندازهگیری با فلوسایتومتری یا دستگاههای خوانش چاهکی (plate readers).
۴.۵.۳ توالییابی RNA تکسلولی (scRNA-seq)
-
اتصال تغییرات CRISPR با پروفایل ترنسکریپتوم در سطح تکسلول.
-
پلتفرمهایی مانند Perturb-seq، CROP-seq و Mosaic-seq این کار را انجام میدهند.
۴.۶ تحلیل و تفسیر دادهها
۴.۶.۱ پردازش دادههای توالییابی
-
نقشهبرداری خوانشها به توالی gRNA.
-
نرمالسازی برای کنترل تفاوت در نمایندگی کتابخانه.
۴.۶.۲ روشهای آماری برای شناسایی ژنهای مهم
-
ابزارهایی مانند MAGeCK، CRISPResso، BAGEL برای تحلیل استفاده میشوند.
-
کنترل آزمون فرضیههای متعدد و نرخ کشف خطای کاذب (FDR) ضروری است.
۴.۶.۳ بررسی اثرات خارج از هدف و اعتبارسنجی
-
مقایسه با سایتهای احتمالی خارج از هدف.
-
اعتبارسنجی مستقل با آزمایشهای دیگر (orthogonal assays).
۴.۶.۴ یکپارچهسازی با دادههای Omics دیگر
-
تلفیق نتایج صفحهگذاری با پروتئومیک، ترانسکریپتومیک یا اپیژنتیک برای درک بهتر زیستشناسی.
۴.۷ چالشها و محدودیتها
-
اثرات خارج از هدف (off-target): ممکن است تفسیر نتایج را مختل کنند.
-
خاموشسازی ناقص ژن: کارایی پایین ویرایش میتواند نفوذ فنوتیپ را کاهش دهد.
-
ناهمگنی سلولی: تفاوت بین کلونها ممکن است نویز ایجاد کند.
-
مرگ سلولی ناشی از خاموشسازی ژنهای ضروری: تحلیل را دشوار میسازد.
-
کارایی انتقال: میزان انتقال gRNA به سلولها ممکن است متغیر باشد.
۴.۸ چشمانداز آینده
تکنولوژیهای نوظهور نوید بهبود هرچه بیشتر صفحهگذاریهای CRISPR را میدهند:
-
پایشهای CRISPRa/i: فعالسازی یا سرکوب ژنها در کنار خاموشسازی.
-
ویرایشگرهای باز (Base editors) و ویرایشگرهای پرایم (Prime editors): ایجاد تغییرات دقیق در نوکلئوتیدها برای بررسی اثرات موتاسیونها.
-
تحریکات همزمان چندگانه (Multiplexing): بررسی برهمکنش بین چند ژن.
-
ترکیب با هوش مصنوعی: طراحی کتابخانه و تحلیل دادهها با کمک یادگیری ماشین.
فصل ۵: رویکردهای ویرایش چندگانه ژنی (Mulagene)
مقدمه
ویرایش همزمان چند ژن با هدفگیری و اصلاح همزمان چند ناحیه ژنومی در یک سلول یا موجود، بهعنوان رویکردی پیشرفته شناخته میشود. این استراتژی تحت عنوان Mulagene نیز مطرح است و توانایی CRISPR را فراتر از ویرایش یکژن برده و امکان بررسی شبکههای ژنی، تعاملات اپیستاتیک، کاربردهای زیستساختبُنی و مدلسازی بیماریهای پیچیده را فراهم میآورد.
در این فصل، مبانی، ملاحظات طراحی و نوآوریهای فناوری مربوط به ویرایش چندگانه ژن بررسی میشوند. موضوعاتی چون چالشها و راهحلهای بیان همزمان چند gRNA، استفاده از گونههای Cas بهینهسازیشده برای هدفگیری چندگانه، کنترل زمانی و مکانی ویرایشها و ابزارهای زیستساختبنی مانند CRISPRa و CRISPRi که امکان تنظیم مولتیژن را فراهم میکنند، پوشش داده خواهد شد.
۵.۱ دلیل و کاربردهای ویرایش چندگانه ژن
۵.۱.۱ چرا ویرایش چندگانه؟
ویرایش تکژنی گرچه مفید است، اما فرآیندهای زیستی عموماً شامل تعامل پیچیده بین چندین ژن و عناصر تنظیمی هستند. ویرایش چندگانه امکان موارد زیر را فراهم میکند:
-
تحلیل تعاملات ژنتیکی: بررسی همکُشی مصنوعی (synthetic lethality)، اپیستازی یا کارکرد موازی با حذف یا تنظیم همزمان چند ژن
-
مدلسازی بیماریهای چندژنی: بسیاری از بیماریها مثل سرطان یا اختلالات عصبی، دارای تغییرات ژنتیکی متعدد هستند؛ ویرایش چندگانه این ترکیبها را واقعیتر بازسازی میکند
-
مهندسی مدارهای مصنوعی: کنترل دقیق و برنامهپذیر بر چند ژن، پایهای برای کاربردهای زیستساختبنی است
-
بهینهسازی درمانها: اصلاح همزمان چند هدف در یک سیستم میتواند اثربخشی را افزایش داده و مقاومت را کاهش دهد
۵.۱.۲ کاربردهای رایج
-
تحقیقات سرطان: حذف همزمان ژنهای سرکوبگر تومور یا فعالسازی آنکوژنها برای مدلسازی تومورزایی
-
ایمونوتراپی: حذف همزمان ژنهای نقطه کنترل ایمنی و تقویت سیگنالدهی T‑cell receptor
-
مهندسی متابولیک: تنظیم مسیرهای زیستی با ویرایش همزمان چند آنزیم یا ژن تنظیمی
-
زیستفناوری کشاورزی: اصلاح همزمان چند صفت مانند عملکرد محصول، مقاومت به استرس و ارزش غذایی در گیاهان
۵.۲ استراتژیهای طراحی gRNA برای Mulagene
تحویل مؤثر و قابل اعتماد چند gRNA، یکی از مهمترین چالشها در ویرایش چندگانه ژن است.
۵.۲.۱ آرایههای Tandem gRNA
چند توالی gRNA در یک وکتور پشت سر هم قرار میگیرند و با عناصر پردازشی مانند ریبوزیمهای خودبُرنده یا توالیهای tRNA جدا میشوند تا gRNAهای مستقل آزاد گردند.
-
استفاده از سایتهای Csy4 endoribonuclease یا سیستم tRNA processing
-
مزایا: کاهش سایز وکتور، هماهنگی در بیان gRNAها
۵.۲.۲ سیستمهای بیان Polycistronic
یک رونویس RNA حاوی چند gRNA با اسپیسهای کوتاه منتشر میکند. آنزیمهای داخل سلول یا مهندسیشده، این رونویس را به gRNAهای مستقل تبدیل میکنند.
-
مثال: استفاده از Csy4، ریبوزیمها یا سیستم پردازش tRNA
-
مزایا: تولید همزمان gRNAهای متعدد از یک رونویس
۵.۲.۳ پروموتر مستقل برای هر gRNA
هر gRNA توسط پروموتر جداگانه (مانند U6 یا H1 Pol III) بیان میشود، حتی در داخل یک وکتور مشترک.
-
مزایا: کنترل مستقل بر بیان هر gRNA
-
معایب: افزایش حجم وکتور
۵.۳ گونهها و سیستمهای Cas مناسب Mulagene
۵.۳.۱ Cas9 و نسخههای آن
-
Cas9 معمولترین پروتئین Cas است و میتواند با چند gRNA برای هدفگیری چند ناحیه استفاده شود
-
اما هنگام استفاده از چند gRNA، رقابت بین آنها ممکن است کارایی را کاهش دهد
-
نسخههای Cas9 با دقت بالا مانند SpCas9-HF1 یا eSpCas9، خطر برخود اشتباه را کاهش میدهند
۵.۳.۲ Cas12a (Cpf1)
-
Cas12a بهطور طبیعی CRISPR RNA array را خودش پردازش میکند و به همین دلیل برای ویرایش چندگانه مناسبتر است
-
یک رونویس شامل چند crRNA تولید شده و Cas12a آنها را به gRNAهای مستقل تبدیل میکند
-
PAM موردنیاز برای Cas12a حاوی TTTV است که گستره هدفگیری را افزایش میدهد
۵.۳.۳ Cas13 برای هدفگیری RNA
-
Cas13 بهجای DNA، RNA را هدف قرار میدهد
-
با چند crRNA میتواند بهصورت همزمان چند روند RNA را تخریب یا تنظیم کند
-
مناسب برای کاربردهایی که قصد ویرایش دائمی ژنوم نیست
۵.۳.۴ سیستمهای Dual-Cas
-
ترکیب دو نوع پروتئین Cas (مثلاً Cas9 و Cas12a) امکان ویرایش، فعالسازی یا سرکوب همزمان چند ژن با قابلیتهای متفاوت را فراهم میکند
-
سیستمهای کاملاً مجزا و ارتوگونال برای کنترل دقیقتر
۵.۴ کنترل زمانی و مکانی ویرایشها
۵.۴.۱ کنترل زمانی
-
استفاده از پروموترهای القایی مانند سیستم Tet‑On القایی با دگزاسیکلین
-
سامانههای اپتوژنتیک برای کنترل وابسته به نور
-
استفاده از مولکولهای شیمیایی مانند راپامایسین برای فعالسازی زمانبندی شده ویرایش
۵.۴.۲ کنترل مکانی
-
استفاده از پروموترهای بافتی یا سلولینوعویژه برای محدودسازی بیان Cas یا gRNA به بافت یا نوع سلول خاص
-
روشهای تحویل مانند وکتورهای ویروسی با تروپیزم سلولی خاص یا نانوذرات هدفمند
-
اتصال CRISPR به سیگنالهای مکانیابی زیرسلولی برای هدایت به کمپارتمنتهای داخل سلول
۵.۵ ابزارهای زیستساختبنی برای تنظیم مولتیژن: CRISPRa و CRISPRi
علاوه بر Knockout، ویرایش چندگانه میتواند شامل تنظیم برنامهریزیشده بیان ژنها نیز باشد.
۵.۵.۱ فعالسازی CRISPR (CRISPRa)
-
استفاده از dCas9 (Cas9 غیرکاتالیتیکی) که به فعالکنندههای رونویش (مانند VP64 یا p300) متصل است
-
gRNAهای همزمان، dCas9‑فعالکننده را به پروموتر یا Enhancer ژنها هدایت میکنند تا بیان چندین ژن همزمان افزایش یابد
۵.۵.۲ مداخله CRISPR (CRISPRi)
-
dCas9 به دامینهای مهارکننده (مانند KRAB) متصل است و وقتی به پروموترها هدایت شود، رونویسی را مسدود میکند
-
چندین gRNA برای سرکوب همزمان چند ژن استفاده میشوند
۵.۵.۳ ترکیب CRISPRa/i ترکیبی
-
استفاده از Casهای ارتوگونال یا ماژولهای chemically inducible برای ترکیبی از فعالسازی و سرکوب در یک سلول
-
امکان تنظیم دقیق شبکههای ژنی پیچیده
۵.۶ چالشها و راهکارهای بهینهسازی
۵.۶.۱ رقابت و کارایی gRNA
-
چند gRNA ممکن است با هم بر سر Cas رقابت کنند و کارایی را کاهش دهند
-
تعادل در سطح بیان gRNA یا استفاده از نسخههای Cas با فرآیندسازی مؤثرتر مفید است
۵.۶.۲ اثرات خارج از هدف
-
ویرایش چندگانه خطر تجمعی اثرات خارج از هدف را افزایش میدهد
-
استفاده از نسخههای Cas دقیقتر و طراحی خوب gRNAها این ریسک را کاهش میدهد
۵.۶.۳ پیچیدگی در انتقال
-
تحویل وکتورهای بزرگ حاوی چند gRNA چالشبرانگیز است
-
استفاده از وکتورهای ویروسی با ظرفیت بالا (مانند لنتیویروس یا آدنوویروس) یا سیستمهای تقسیمشده (split systems) کمککننده است
۵.۶.۴ سمیت سلولی
-
آسیب بیش از حد DNA از برشهای متعدد ممکن است سمّیت سلولی ایجاد کند
-
بهینهسازی تعداد و زمانبندی برشها میتواند عوارض منفی را کاهش دهد
۵.۷ مطالعات موردی در ویرایش مولتیژن
۵.۷.۱ مدلسازی تکوین تومور با Knockout چندگانه
-
حذف همزمان چند ژن سرکوبگر تومور در ارگانوئیدهای موشی برای بازسازی مدلهای پیشرفت سرطان
۵.۷.۲ مهندسی سلولهای CAR‑T با ویرایش مولتیژن
-
Knockout همزمان ژنهای نقطه کنترل ایمنی و افزودن ژنهای گیرنده آنتیژن کایمریک (CAR) برای افزایش کارایی و پایداری سلولها
۵.۷.۳ بهبود محصولات کشاورزی از طریق Mulagene
-
اصلاح همزمان چند ژن کنترلکننده عملکرد محصول، مقاومت به بیماری و تحمل استرس برای تسریع در اصلاح گیاهان
۵.۸ مسیرهای آینده در ویرایش مولتیژن
-
توسعه وکتورهای فشرده و کارآمدتر برای تحویل چند gRNA
-
ادغام با multi-omics تکسلولی برای ارتباط دادن ویرایش مولتیژن با فنوتیپ سلولی
-
ترکیب ویرایشگرهای پایه و نخست برای ایجاد تغییرات دقیق نوکلئوتیدی چندگانه
-
استفاده از ماشین لرنینگ برای بهینهسازی طراحی gRNA و پیشبینی نتایج ویرایش
-
ترجمه بالینی ویرایش مولتیژن برای درمان بیماریهای ژنتیکی پیچیده
فصل ۷: چالشهای اخلاقی و مقرراتی
ویرایش ژن زایا (Germline) در برابر سوماتیک (Somatic):
-
ویرایش ژن سوماتیک تنها بر سلولهای بدن تأثیر میگذارد و به نسل بعد منتقل نمیشود، بنابراین از نظر اخلاقی بیشتر پذیرفته شده است.
-
در مقابل، ویرایش ژن زایا باعث تغییرات دائمی در نسلهای آینده میشود و نگرانیهایی مثل ایجاد نوزادان طراحیشده، پیامدهای پیشبینینشده و تغییر در ذخیره ژنتیکی بشر را به همراه دارد.
بحثبرانگیز بودن ویرایش جنین انسانی:
-
یک دانشمند چینی در سال ۲۰۱۸ اعلام کرد دو نوزاد با ژن ویرایششده برای مقاومت در برابر HIV به دنیا آمدهاند. این اقدام، به دلیل بیتوجهی به اصول اخلاقی و نبود شفافیت، موجی از محکومیت جهانی به دنبال داشت.
-
این موضوع مسائل مهمی چون عدم امکان رضایت آگاهانه از نسلهای آینده، نابرابری در دسترسی و مرز نامشخص بین درمان و تقویت را مطرح میکند.
چارچوبهای قانونی در کشورهای مختلف:
-
قوانین مربوط به CRISPR در کشورها متفاوت است.
-
در آمریکا، سازمان FDA و در اروپا، EMA نظارت دقیقی بر استفاده درمانی دارند.
-
برخی کشورها فقط ویرایش سوماتیک را اجازه میدهند و ویرایش زایا را ممنوع کردهاند.
-
نبود قوانین روشن در برخی کشورها، باعث شکلگیری «پناهگاههای قانونی» میشود.
نگرانیهای امنیت زیستی (Biosecurity):
-
فناوری CRISPR علاوه بر کاربردهای پزشکی، در کشاورزی و زیستفناوری نیز استفاده میشود، اما میتواند برای اهداف مخرب مثل ساخت عوامل بیماریزا مورد سوءاستفاده قرار گیرد.
-
نهادهای امنیتی به CRISPR بهعنوان یک فناوری دوگانه (Dual-Use) نگاه میکنند که ممکن است تهدیدات زیستی ایجاد کند.
-
رعایت اصول ایمنی در آزمایشگاه، شفافیت در پژوهش، و همکاری بینالمللی برای پیشگیری از خطرات ضروری است.
ابعاد اخلاقی غربالگریهای ژنتیکی گسترده (High-Throughput):
-
استفاده از CRISPR در غربالگریهای گسترده میتواند باعث کشف اهداف دارویی شود، اما چالشهایی مانند حفظ حریم خصوصی اطلاعات ژنتیکی، رضایت آگاهانه و مواجهه با یافتههای ناخواسته را ایجاد میکند.
-
استفاده از سلولهای مشتق از بیماران نیز خط بین تحقیقات و درمان را مبهمتر میکند.
جمعبندی:
ویرایش ژن با CRISPR نیازمند بررسیهای اخلاقی عمیق، نظارت بینالمللی، شفافیت در پژوهش و مشارکت عمومی است تا تعادل میان نوآوری و ایمنی برقرار شود. بهویژه در مورد ویرایش زایا و جنینی، همکاری جهانی و وضع قوانین روشن حیاتی است.