جهش ژنتیکی
اپیژنتیک مطالعه تغییرات قابل ارث در بیان ژن یا فنوتیپ سلولی است که بدون تغییر در توالی اصلی DNA رخ میدهد. این تغییرات میتوانند نحوه فعال یا غیرفعال شدن ژنها را تنظیم کنند و نقش بسیار مهمی در رشد، تمایز سلولی و بروز بیماریها ایفا کنند. برخلاف جهشهای ژنتیکی که باعث تغییر کد DNA میشوند، تغییرات اپیژنتیکی از طریق تغییرات شیمیایی روی DNA یا ساختار کروماتین بر فعالیت ژنها تأثیر میگذارند، که این تغییرات اغلب در پاسخ به عوامل محیطی ایجاد میشوند.
اصطلاح «اپیژنتیک» برای اولین بار توسط کانراد وادینگتون در دهه ۱۹۴۰ مطرح شد تا تعامل بین ژنها و محصولات آنها که باعث شکلگیری فنوتیپ میشود را توصیف کند. از آن زمان، این حوزه به طور چشمگیری گسترش یافته و مکانیزمهای پیچیدهای مانند متیلاسیون DNA، تغییرات روی هیستونها، بازآرایی کروماتین و RNAهای غیرکدکننده را آشکار ساخته است.
درک اپیژنتیک تحول بزرگی در تحقیقات زیستی و پزشکی ایجاد کرده است. این مفهوم توضیح میدهد که چرا دوقلوهای همسان با یک ژنوم میتوانند ویژگیهای متفاوتی داشته باشند، چگونه مواجهه با عوامل محیطی میتواند اثرات ماندگاری بر بیان ژنها داشته باشد، و چگونه بیماریهایی مانند سرطان، اختلالات عصبی و مشکلات متابولیکی میتوانند از طریق اختلال در اپیژنتیک ایجاد شوند.
در این مقاله، ما به بررسی مکانیزمهای اساسی اپیژنتیک، ابزارهای مطالعه آن و کاربردهای گستردهاش در سلامت، کشاورزی و بیوتکنولوژی خواهیم پرداخت.
فهرست مطالب
-
چشمانداز تاریخی اپیژنتیک
-
مفاهیم و تعاریف پایه
-
مکانیزمهای کلیدی اپیژنتیک
-
متیلاسیون DNA
-
تغییرات روی هیستونها
-
بازآرایی کروماتین
-
RNAهای غیرکدکننده
-
-
تنظیم اپیژنتیکی بیان ژن
-
اپیژنتیک در رشد و تمایز
-
تأثیرات محیطی بر اپیژنتیک
-
اپیژنتیک و بیماریها
-
سرطان
-
اختلالات عصبی
-
بیماریهای متابولیک
-
-
وراثت اپیژنتیکی و اثرات چندنسلی
-
تکنیکهای مطالعه اپیژنتیک
-
کاربردهای درمانی اپیژنتیک
-
داروهای اپیژنتیکی
-
پزشکی شخصی
-
-
اپیژنتیک در کشاورزی و بیوتکنولوژی
-
جهتگیریها و چالشهای آینده
-
نتیجهگیری
1. چشمانداز تاریخی اپیژنتیک
مفهوم اپیژنتیک از زیستشناسی توسعهای اولیه به درک مولکولی مدرن تنظیم ژنها تکامل یافته است.
-
کانراد وادینگتون (دهه ۱۹۴۰): اصطلاح «اپیژنتیک» را برای توصیف نحوه تعامل ژنها با محیطشان جهت تولید فنوتیپ به کار برد. این مفهوم به صورت تصویری به شکل «چشمانداز اپیژنتیک» ارائه شد.
-
دهههای ۱۹۷۰–۱۹۸۰: کشف متیلاسیون DNA و نقش آن در تنظیم ژنها. مطالعات نشان دادند که متیلاسیون میتواند باعث خاموشی ژنها شود.
-
دهه ۱۹۹۰: شناسایی تغییرات روی هیستونها و مطرح شدن فرضیه «کد هیستون»، که بیان میکند دنبالههای هیستونی حامل نشانههای شیمیاییای هستند که ساختار کروماتین و فعالیت ژن را تنظیم میکنند.
-
دهه ۲۰۰۰: آغاز پروژه «اپیژنوم انسانی» برای نقشهبرداری الگوهای متیلاسیون DNA در سراسر ژنوم. پیشرفت در تکنولوژی توالییابی شتاب قابل توجهی به تحقیقات اپیژنتیکی بخشید.
-
امروزه: اپیژنتیک به عنوان یک لایه اساسی در تنظیم ژنوم شناخته شده است که در تقریباً تمام زمینههای زیستشناسی و پزشکی اهمیت دارد.
2. مفاهیم و تعاریف پایه
-
اپیژنوم: مجموعه کامل تغییرات اپیژنتیکی روی ماده ژنتیکی یک سلول.
-
کروماتین: ترکیب DNA و پروتئینها (عمدتاً هیستونها) که DNA را در هسته سلول بستهبندی میکند.
-
بیان ژن: فرآیندی که در آن اطلاعات یک ژن برای ساخت محصولات عملکردی مانند پروتئینها استفاده میشود.
-
نشانههای اپیژنتیکی: تغییرات شیمیایی روی DNA یا هیستونها که بدون تغییر توالی DNA، بر بیان ژن تأثیر میگذارند.
3. مکانیزمهای کلیدی اپیژنتیک
3.1 متیلاسیون DNA
-
تعریف: اضافه شدن یک گروه متیل (CH3) به کربن ۵ سیتوزین، عمدتاً در جایگاههای CpG (جفت باز سیتوزین-گوانین).
-
آنزیمها: DNA متیلترانسفرازها (DNMTs) از جمله DNMT1، DNMT3A و DNMT3B مسئول این فرآیند هستند.
-
وظیفه: معمولاً باعث خاموشی ژنها میشود؛ این کار از طریق جلوگیری از اتصال فاکتورهای رونویسی یا جذب پروتئینهایی که کروماتین را فشرده میکنند، انجام میشود.
-
نقش: متیلاسیون در پدیدههایی مانند ایمپرینتینگ ژنومی، غیرفعالسازی کروموزوم X و سرکوب عناصر متحرک نقش حیاتی دارد.
-
تنظیم دینامیک: الگوهای متیلاسیون DNA میتوانند به صورت فعال توسط آنزیمهای TET که باعث اکسیداسیون متیلسیتوزین میشوند، حذف گردند.
3.2 تغییرات روی هیستونها
-
انواع: استیلاسیون (آستیلدار شدن)، متیلاسیون، فسفریلاسیون، یوبیکوئیتیناسیون، سامویلاسیون روی دنبالههای هیستون.
-
آنزیمها: شامل هیستون استیلترانسفرازها (HATs)، هیستون داستیلازها (HDACs)، متیلترانسفرازها و دمتیلآزها.
-
تأثیرات: استیلاسیون معمولاً با فعالسازی ژن همراه است زیرا باعث باز شدن ساختار کروماتین میشود؛ اثرات متیلاسیون بسته به جایگاه و نوع آن متفاوت است.
-
فرضیه کد هیستون: الگوی تغییرات روی هیستونها یک کد است که وضعیت کروماتین و فعالیت ژن را تعیین میکند.
3.3 بازآرایی کروماتین
-
مجموعههای وابسته به ATP مانند SWI/SNF موقعیت یا حذف نوکلئوزومها را تغییر میدهند تا دسترسی به DNA تنظیم شود.
-
هدف: تسهیل یا ممانعت از اتصال ماشینآلات رونویسی، ترمیم DNA و رونویسی.
3.4 RNAهای غیرکدکننده
-
انواع: شامل microRNAs (miRNAs)، RNAهای بلند غیرکدکننده (lncRNAs) و RNAهای کوچک مداخلهگر (siRNAs).
-
وظایف: تنظیم بیان ژن پس از رونویسی یا جذب عوامل اپیژنتیکی به مناطق خاص ژنومی.
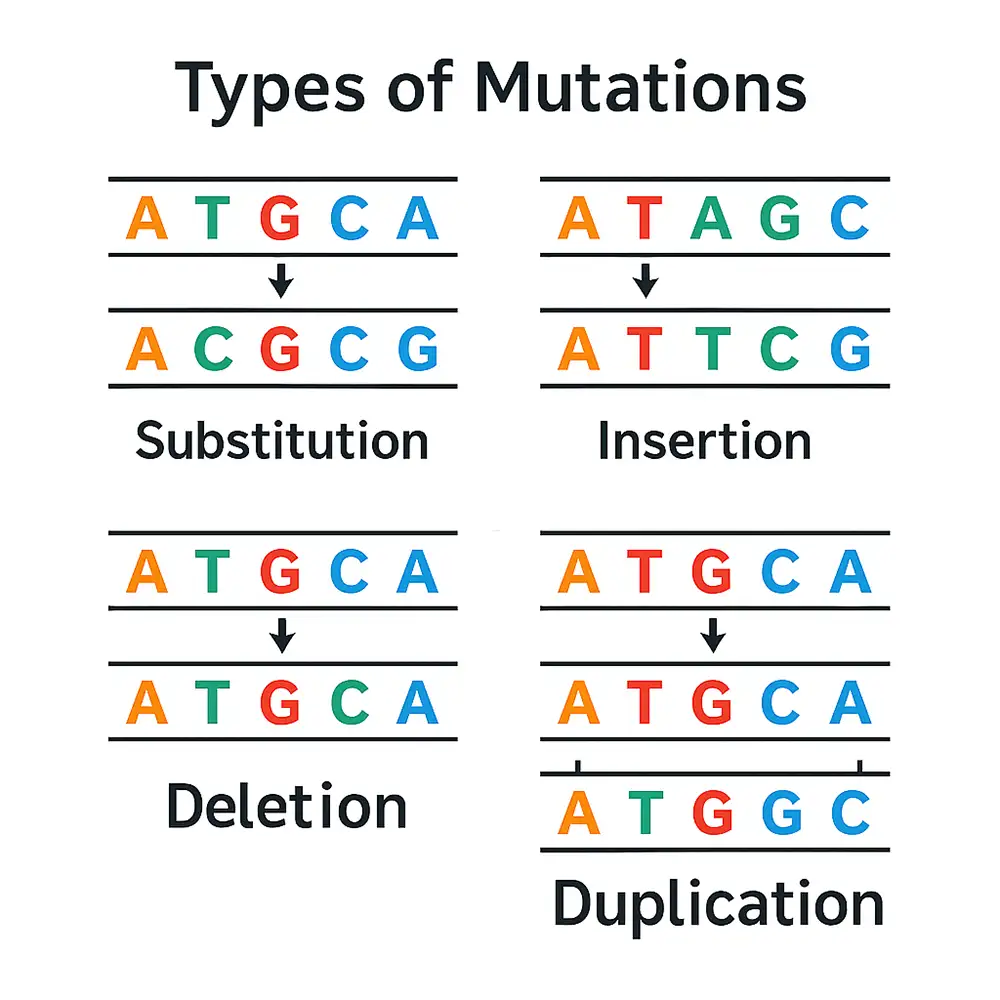
انواع جهش:
🔹 I. بر اساس مقیاس جهش
🔹 1. جهشهای نقطهای (تکنوکلئوتیدی – SNVs)
تعریف: جهشی که تنها یک باز نوکلئوتیدی (A، T، C یا G) را تحت تأثیر قرار میدهد. این نوع، شایعترین شکل تغییر ژنتیکی است و بسته به نوع و مکان جهش، میتواند عملکرد پروتئین را تحت تأثیر قرار دهد.
✅ جهشهای جانشینی (Substitution)
الف. جهش ساکت (Silent Mutation)
-
مکانیسم: تغییر یک نوکلئوتید که منجر به تغییر در اسید آمینه نمیشود، به دلیل خاصیت «کدگذاری تکراری» ژنتیکی.
-
اثر: معمولاً خنثی تلقی میشود، اما ممکن است بر پایداری mRNA، اتصال اگزونها (splicing)، یا کارایی ترجمه تأثیر بگذارد.
-
مثال:
-
DNA: AAA → AAG
-
هر دو کد برای لیزین (lysine) هستند.
-
زمینهٔ بیماری: یک جهش ساکت در ژن MDR1 میتواند تاخیر در تاخوردگی پروتئین و مقاومت دارویی در سلولهای سرطانی ایجاد کند.
-
ب. جهش معناساز (Missense Mutation)
-
مکانیسم: تغییر نوکلئوتید که باعث جایگزینی یک اسید آمینه با اسید آمینهای دیگر در زنجیرهٔ پروتئین میشود.
-
اثر: بسته به اینکه اسید آمینهٔ جدید ساختار یا عملکرد پروتئین را تغییر میدهد یا نه، میتواند بیضرر، مضر یا حتی مفید باشد.
-
مثال:
-
بیماری کمخونی داسیشکل (Sickle Cell Disease)
-
تغییر: GAG (گلاتامیک اسید) → GTG (والین) در ژن β-گلوبین (HBB)
-
اثر: هموگلوبین ساختار غیرطبیعی پیدا میکند و گلبولهای قرمز به شکل داس درمیآیند.
-
ج. جهش بیمعنا (Nonsense Mutation)
-
مکانیسم: تغییر یک نوکلئوتید که کدونی را به کد پایان زودرس (مثل UAG، UGA، UAA) تبدیل میکند.
-
اثر: تولید یک پروتئین ناقص و معمولاً غیرفعال.
-
مثال:
-
دیستروفی عضلانی دوشن (Duchenne Muscular Dystrophy)
-
جهش، یک کد پایان را در ژن Dystrophin وارد میکند که منجر به از دست دادن عملکرد پروتئین میشود.
-
✅ درج یا حذف یک باز (Indels)
د. جهش تغییر چهارچوب (Frameshift Mutation)
-
مکانیسم: درج یا حذف نوکلئوتیدهایی که مضرب سه نیستند و چهارچوب خواندن mRNA را جابهجا میکنند.
-
اثر: توالی اسیدهای آمینهٔ پاییندست بهکلی تغییر میکند و اغلب منجر به کد پایان زودرس و پروتئینی غیرعملکردی میشود.
-
مثال:
-
بیماری تای-سَکس (Tay-Sachs Disease)
-
درج ۴ باز در ژن HEXA
-
اثر: تولید آنزیم غیرعملکردی → تجمع لیپید در سلولهای عصبی.
-
🔹 2. جهشهای در مقیاس کوچک
هـ. گسترش میکروماهوارهای (Microsatellite Expansions)
-
مکانیسم: افزایش تعداد تکرارهای کوتاه DNA (مثل CAG) بهعلت لغزش DNA پلیمراز هنگام همانندسازی.
-
اثر: تکرارهای زیاد میتوانند عملکرد پروتئین را تغییر دهند یا باعث خاموشی ژن شوند.
-
مثال:
-
بیماری هانتینگتون (Huntington’s Disease)
-
گسترش تکرار CAG در ژن HTT
-
بیش از 36 تکرار → تجمع پروتئینهای سمی → تحلیل نورونی.
-
و. درجها یا حذفهای کوچک (Small Indels)
-
مکانیسم: درج یا حذف چند باز تا چند ده باز نوکلئوتیدی.
-
اثر: ممکن است باعث تغییر چهارچوب (frameshift) یا اختلال در نواحی تنظیمی یا ساختاری ژن شود.
-
مثال:
-
فیبروز کیستیک (Cystic Fibrosis)
-
جهش شایع: ΔF508 در ژن CFTR
-
حذف سه باز که باعث حذف فنیلآلانین میشود → پروتئین CFTR تا نمیخورد → اختلال در انتقال یون کلر.
-
🔹 3. جهشهای بزرگمقیاس (کروموزومی)
ز. دوبرابر شدن (Duplications)
-
مکانیسم: بخشی از کروموزوم تکرار میشود و نسخهٔ اضافی از ژن ایجاد میشود.
-
اثر: افزایش بیان ژن، اختلال در تنظیم، یا اختلال در نمو.
-
مثال:
-
بیماری شارکوت-ماری-توث نوع 1A
-
دوبرابر شدن ژن PMP22 در کروموزوم 17 → آسیب اعصاب محیطی.
-
ح. حذفها (Deletions)
-
مکانیسم: ناحیهٔ بزرگی از کروموزوم حذف میشود.
-
اثر: حذف چندین ژن → بروز سندرمهای پیچیده.
-
مثال:
-
سندرم دیجورج (DiGeorge Syndrome)
-
حذف ناحیهٔ 22q11.2 → مشکلات قلب، تیموس، صورت و تأخیر رشد.
-
ط. وارونگی (Inversion)
-
مکانیسم: بخشی از کروموزوم جدا میشود و به صورت معکوس دوباره بههم متصل میشود.
-
اثر: اختلال در ژنها در محل شکست یا تداخل در نوترکیبی ژنتیکی.
-
مثال:
-
هموفیلی A
-
وارونگی در اینترون 22 ژن F8 → اختلال در تولید فاکتور VIII انعقادی.
-
ی. درجهای بزرگ (Insertions)
-
مکانیسم: یک بخش بزرگ DNA از یک کروموزوم دیگر بهطور تصادفی وارد کروموزوم جدید میشود.
-
اثر: اختلال در ژنهای میزبان یا نواحی تنظیمی.
-
مثال:
-
درج رتروترانسپوزونهای LINE-1 در ژن F8 → ایجاد هموفیلی A.
-
ک. جابهجاییها (Translocations)
الف. جابهجایی متقابل (Reciprocal)
-
مکانیسم: تبادل بخشهایی از دو کروموزوم غیرهمولوگ.
-
اثر: در صورت تعادل، ممکن است بیاثر باشد ولی در برخی موارد منجر به سرطان یا فرزند دارای اختلال ژنتیکی میشود.
-
مثال:
-
لوسمی میلوئیدی مزمن (CML)
-
جابهجایی t(9;22) → ایجاد ژن ترکیبی BCR–ABL → تقسیم کنترلنشده سلولها.
-
ب. جابهجایی رابرتسونی (Robertsonian)
-
مکانیسم: اتصال دو کروموزوم آکروسنتریک از طریق سانترومر.
-
اثر: در حاملان ممکن است بیاثر باشد اما در نسل بعدی باعث ناهنجاری شود.
-
مثال:
-
جابهجایی رابرتسونی بین کروموزومهای 14 و 21 → افزایش خطر سندرم داون خانوادگی.
-
ل. کروموزومهای حلقوی (Ring Chromosomes)
-
مکانیسم: کروموزوم در دو نقطه میشکند و دو انتهای آن بههم میچسبند و ساختار حلقهای میسازند.
-
اثر: از دست رفتن ژنها در نقاط شکست و ناپایداری در تقسیم سلولی.
-
مثال:
-
سندرم کروموزوم حلقوی 14 → تشنج، تأخیر رشدی و مشکلات بینایی.
-
م. ایزوکروموزومها (Isochromosomes)
-
مکانیسم: کروموزومی با دو بازوی مشابه (دو p یا دو q) به دلیل تقسیم ناصحیح سانترومر.
-
اثر: عدم تعادل ژنی.
-
مثال:
-
سندرم ترنر با ایزوکروموزوم Xq → دو بازوی بلند X، بدون بازوی کوتاه → تأثیر بر رشد و تولید مثل.
-
ن. کروموترپسی (Chromothripsis)
-
مکانیسم: رویدادی فاجعهبار که یک یا چند کروموزوم به چندین تکه شکسته و بهصورت تصادفی دوباره سرهم میشوند.
-
اثر: بازآراییهای عظیم، حذف و اتصالهای جدید ژنتیکی → اغلب در سرطان.
-
مثال:
-
سرطان کلیه نوع Clear Cell
-
شکست کروموزوم 3p و حذف ژن سرکوبگر VHL.
-
🔹 4. جهشهای در سطح ژنوم
س. آنئوپلوئیدی (Aneuploidy)
-
مکانیسم: از دست رفتن یا اضافه شدن یک کروموزوم کامل، معمولاً بهدلیل عدم جدایی در میوز.
-
اثر: عدم تعادل دوز ژنی.
-
مثال:
-
سندرم داون (تریزومی 21)
-
سه نسخه از کروموزوم 21 → ناتوانی ذهنی، ویژگیهای چهرهای خاص، نقایص قلبی.
-
ش. پلیپلوئیدی (Polyploidy)
-
مکانیسم: افزایش کامل مجموعه کروموزومها (مثلاً 3n یا 4n). در گیاهان رایج، در انسان نادر.
-
اثر: افزایش اندازهٔ ژنوم؛ در حیوانات معمولاً کشنده یا باعث ناباروری میشود.
-
مثال:
-
گندم با ژنوم هگزاپلوئید (6n) → تنوع ژنتیکی بیشتر و مقاومت در برابر خشکی و بیماریها.
1. جهشهای خودبهخودی (Spontaneous Mutations)
این جهشها بهطور طبیعی و بدون تأثیر عوامل خارجی رخ میدهند، اغلب بهدلیل خطا در تکثیر DNA یا ناپایداری شیمیایی نوکلئوتیدها.
مکانیسمها:
-
خطاهای DNA پلیمراز
حتی با وجود مکانیزم تصحیح (proofreading)، پلیمراز ممکن است نوکلئوتید اشتباه وارد کند. -
دئآمیناسیون باز (Base Deamination)
سیتوزین میتواند بهطور خودبهخودی یک گروه آمینو را از دست بدهد و به اوراسیل تبدیل شود، که پس از همانندسازی باعث انتقال C→T میشود.
🔬 مثال: دئآمیناسیون خودبهخودی 5-متیلسیتوزین منجر به تبدیل CpG به TpG در نقاط داغ جهش در ژنوم انسان میشود. -
جابجایی تاوتومری (Tautomeric Shifts)
اشکال نادر بازهای DNA بهطور غیرعادی جفت میشوند (مثلاً A* با C یا T* با G)، که منجر به جفتشدن اشتباه میگردد.
🔬 مثال: جهشهای انتقالی مانند A·T → G·C بهدلیل تاوتومریسم در هنگام همانندسازی.
2. جهشهای القاشده (Induced Mutations)
این جهشها توسط عوامل خارجی (عاملهای ایجاد جهش یا موتاژنها) ایجاد میشوند.
الف. موتاژنهای فیزیکی (Physical Mutagens)
-
اشعه UV
ایجاد دوپلهای تیمین که DNA را دچار پیچش میکند و خطا در همانندسازی بهوجود میآورد.
🔬 مثال: Xeroderma pigmentosum – بیماریای ناشی از ناتوانی در تعمیر آسیب DNA القاشده توسط اشعه UV. -
اشعه یونیزهکننده (X-ray، اشعه گاما)
ایجاد شکست در زنجیرههای DNA، که منجر به حذفها و جابهجاییهای کروموزومی میشود.
🔬 مثال: بازماندگان بمب اتمی افزایش ناهنجاریهای کروموزومی و خطر بالاتر ابتلا به سرطان را نشان میدهند.
ب. موتاژنهای شیمیایی (Chemical Mutagens)
-
مآخذ بازها (Base Analogs) مانند ۵-برومیوراسیل (5-bromouracil)
مشابه بازهای طبیعی هستند اما در همانندسازی جفتگیری اشتباه انجام میدهند.
🔬 مثال: ۵-BU با آدنین جفت میشود اما میتواند تاوتومریسم داشته باشد و با گوانین جفت شود → جهشهای انتقالی. -
عوامل آلکیلهکننده (Alkylating Agents) مانند EMS یا گاز خردل
گروههای آلکیل را به بازها میافزایند → جفتگیری اشتباه.
🔬 مثال: O⁶-اتیلگوانین بهجای سیتوزین با تیمین جفت شود. -
عوامل بیننشین (Intercalating Agents) مانند اتیدیوم بروماید
بین بازها قرار میگیرند و باعث جهشهای تغییر چارچوب (frameshift) میشوند.
🔬 مثال: بهطور آزمایشی برای القای جهش در باکتریها و مخمرها استفاده میشود.
ج. موتاژنهای بیولوژیکی (Biological Mutagens)
-
ویروسها
میتوانند DNA خود را وارد ژنوم میزبان کنند و ژنها را مختل نمایند.
🔬 مثال: ویروس HPV وارد ژنوم سلول میزبان میشود و باعث سرطان دهانه رحم میگردد. -
عناصر متحرک (Transposable Elements)
ژنهای جهشزا که به نواحی کدکننده یا تنظیمی وارد میشوند.
🔬 مثال: رتروترانسپوزونهای LINE-1 در برخی سرطانها ژنهای سرکوبگر تومور را مختل کردهاند.
🔹 III. بر اساس تأثیر بر عملکرد ژن
1. جهشهای از دست دادن عملکرد (Loss-of-Function, LoF)
محصول ژنی فعالیت طبیعی خود را از دست میدهد. میتواند:
-
ناپلئس (Null): از دست دادن کامل عملکرد
-
هیپومورفیک (Hypomorphic): کاهش جزئی عملکرد
🔬 مثال:
دیستروفی عضلانی دوشن (Duchenne Muscular Dystrophy) – جهش LoF در ژن dystrophin → فقدان پروتئین عملکردی → تحلیل عضلات.
2. جهشهای کسب عملکرد (Gain-of-Function, GoF)
به محصول ژن کارکرد جدید یا افزایشیافته میبخشد. غالباً صفت غالب (dominant) است.
🔬 مثال:
آکندروپلازی (Achondroplasia) – جهش GoF در ژن FGFR3 منجر به فعالیت مستمر گیرنده میشود و رشد استخوان را مهار میکند.
3. جهشهای غالب منفی (Dominant Negative)
محصول جهشیافته با محصول نرمال تداخل میکند و عملکرد آن را مختل میسازد.
🔬 مثال:
سندرم مارفان (Marfan Syndrome) – فیبریلین-۱ جهشیافته در ساخت بافت پیوندی تداخل ایجاد میکند، حتی در حضور فیبریلین طبیعی.
4. جهشهای کشنده (Lethal Mutations)
باعث مرگ موجود میشوند، اغلب در دوره جنینی یا اوایل پس از تولد.
🔬 مثال:
جهش LoF هموزیگوت در ژن HPRT در موشهای مدل Lesch-Nyhan syndrome غالباً در مراحل اولیه تکامل کشنده است.
🔹 IV. بر اساس تأثیر بر پروتئین
1. جهشهای خنثی (Neutral Mutations)
هیچ تأثیر قابلمشاهدهای بر عملکرد یا فنوتیپ ندارند.
🔬 مثال:
جهشهای ساکت مانند AAA → AAG که هر دو لیزین را رمز میکنند – عملکرد پروتئین بدون تغییر میماند.
2. جهشهای مفید (Beneficial Mutations)
تناسب یا بقا را در محیطهای خاص بهبود میبخشند.
🔬 مثال:
جهش CCR5-Δ32 – حذف ۳۲ جفت باز در ژن CCR5 از ورود HIV به سلولهای T جلوگیری میکند و مقاومت به HIV ایجاد میکند.
3. جهشهای مضر یا بیماریزا (Harmful/Pathogenic Mutations)
عملکرد ژن را مختل کرده و اغلب باعث بیماری میشوند.
🔬 مثالها:
-
کمخونی داسیشکل (Sickle Cell Anemia) – جهش معناساز در ژن HBB → ساختار غیرعادی هموگلوبین.
-
فیبروز کیستیک (Cystic Fibrosis) – حذف سه باز (ΔF508) در ژن CFTR → پروتئین تا نمیخورد و کانال کلر عملکرد ندارد → تجمع مخاط در ریهها.
🔹 V. انواع خاص جهشها (Special Mutation Types)
۱. جهشهای گسترش تکراری (Repeat Expansion Mutations)
این جهشها زمانی رخ میدهند که توالیهای کوتاه DNA (معمولاً ۳ تا ۶ نوکلئوتید) بیش از حد نرمال تکرار شوند، به دلیل لغزش در روند همانندسازی DNA. این تکرارها ناپایدار هستند و اغلب در نسلهای متوالی افزایش مییابند (پدیدهی پیشروی یا anticipation).
🧬 مکانیسم:
در طول همانندسازی DNA، پلیمراز ممکن است روی نواحی غنی از تکرار بلغزد، که منجر به افزایش تکرارهای ترینوکلئوتیدی یا تترانوکلئوتیدی میشود.
🔬 مثالها:
-
بیماری هانتینگتون (Huntington’s disease): گسترش تکرار CAG در ژن HTT → عملکرد سمی حاصل از افزایش فعالیت پروتئین هانتینگتین.
-
سندروم ایکس شکننده (Fragile X syndrome): گسترش CGG در ژن FMR1 → خاموشی ژن به وسیلهی متیلاسیون.
-
دیستروفی میوتونیک (Myotonic dystrophy): تکرار CTG در ژن DMPK → سمی شدن RNA و اختلال در پردازش اسپلایسینگ.
۲. جهشهای موزاییکی (Mosaic Mutations یا Somatic Mosaicism)
این جهشها پس از لقاح (پسازیگوتی) رخ میدهند و منجر به فردی میشوند که دارای جمعیتهای سلولی با ژنومهای متفاوت است.
🧬 مکانیسم:
جهش در یکی از سلولهای اولیه جنینی ایجاد شده و به تعداد محدودی از سلولها منتقل میشود.
🔬 مثال:
-
سندروم مککون-آلبرایت (McCune-Albright syndrome): جهش فعالکننده در ژن GNAS بهصورت پسازیگوتی رخ میدهد → توزیع موزاییکی از ناهنجاریهای استخوانی، رنگدانههای پوستی و تومورهای غدد درونریز.
۳. جهشهای لاین زایشی در برابر جهشهای سوماتیکی (Germline vs. Somatic Mutations)
• جهشهای لاین زایشی (Germline):
در اسپرم یا تخمک وجود دارند → ارثی هستند و در تمام سلولهای فرزند مشاهده میشوند.
🔬 مثال: جهش در ژن BRCA1 که موجب سرطان ارثی پستان و تخمدان میشود.
• جهشهای سوماتیکی (Somatic):
در طول زندگی بهدست میآیند، ارثی نیستند و فقط به بافتهای خاصی محدود میشوند.
🔬 مثال: جهش در ژن p53 در سلولهای ریه به دلیل مصرف سیگار → سرطان ریه.
۴. جهشهای اپیژنتیکی (Epigenetic Mutations یا Epimutations)
این جهشها باعث تغییر در تنظیم بیان ژنها میشوند بدون آنکه توالی نوکلئوتیدی DNA تغییر کند.
🧬 مکانیسمها:
-
متیلاسیون DNA (اغلب باعث خاموشی ژن میشود)
-
تغییرات در هیستونها (دسترسی به کروماتین را تغییر میدهند)
-
RNAهای غیرکُدکننده (مثل miRNAها که ترجمه را تنظیم میکنند)
🔬 مثال:
-
خاموشی ژن MLH1 از طریق متیلاسیون پروموتر → باعث ناپایداری میکروستلیت در سرطان کولورکتال اسپوردیک میشود.
🔹 VI. بر اساس زمینهی جهش (Based on Mutation Context)
۱. جهشهای سیس و ترنس (Cis vs. Trans Mutations)
• جهشهای سیس (Cis):
در عناصر تنظیمی مانند پروموتر یا تقویتکننده رخ میدهند و روی همان مولکول DNA که ژن مورد نظر را دارد، اثر میگذارند.
🔬 مثال:
-
جهش در پروموتر ژن β-گلوبین → کاهش رونویسی → تالاسمی β.
• جهشهای ترنس (Trans):
بر ژنهایی اثر میگذارند که پروتئینهای تنظیمکننده مانند فاکتورهای رونویسی را تولید میکنند که میتوانند بر چندین ژن مختلف اثر بگذارند.
🔬 مثال:
-
جهش در PAX6 (فاکتور رونویسی) → باعث آنیریدیا میشود و بر توسعهی چشم اثر میگذارد.
۲. جهشهای تنظیمی (Regulatory Mutations)
این جهشها نواحی غیرکدکننده را که بیان ژن را کنترل میکنند تحت تاثیر قرار میدهند، از جمله: پروموترها، تقویتکنندهها، مهارکنندهها، جایگاههای اسپلایس، و نواحی UTR.
🔬 مثالها:
-
جهش در پروموتر ژن TERT (تلومراز ریورس ترانسکریپتاز) → افزایش فعالیت تلومراز در ملانوم.
-
جهش در جایگاه اسپلایس ژن SMN2 → حذف اگزون → ایجاد آتروفی عضلانی نخاعی (SMA).
-
جهش در ناحیه 3' UTR ژن HMGA2 → اختلال در اتصال miRNAها → افزایش بیان این ژن در برخی تومورها.
۳. تغییرات ساختاری (Structural Variants یا SVs)
تغییرات بزرگی در DNA که ساختار ژنوم را تغییر میدهند (بیشتر از ۵۰ جفتباز). شامل موارد زیر است:
-
حذفها (Deletions)
-
تکثیرها (Duplications)
-
درجها (Insertions)
-
وارونگیها (Inversions)
-
جابجاییها (Translocations)
🔬 مثالها:
-
کروموزوم فیلادلفیا: جابجایی t(9;22)(q34;q11) → تشکیل ژن ترکیبی BCR-ABL → لوسمی میلوئیدی مزمن (CML).
-
تغییر در تعداد نسخهها (CNV) در ژن PMP22 → تکثیر → بیماری شارکوت-ماری-توث نوع 1A.
-
حذف در ناحیه 22q11.2 → سندروم دیجورج → با نقصهای قلبی، شکاف کام و نقص سیستم ایمنی همراه است.
جهش چیست؟
بهطور کلی، واژهی «جهش» به معنی تغییر یا دگرگونی است. اما در علم زیستشناسی، «جهش» به فرایندهایی اطلاق میشود که منجر به ایجاد تغییراتی در «ژنها» (Gene) و «کروموزومها» (Chromosome) — به عنوان اجزای اصلی مادهی ژنتیکی — میشوند. این تغییرات معمولاً در ویژگیهای ظاهری یا «فنوتیپ» (Phenotype) ارگانیسمها قابل مشاهده هستند.
در ژنتیک، جهش به معنی آسیب دیدن یا دگرگونی در ساختار مادهی ژنتیکی است؛ این تغییرات ممکن است عملکرد یک ژن را مختل کنند، باعث از بین رفتن آن شوند، یا کارایی آن را تغییر دهند. اثر نهایی هر جهش، وابسته به محل وقوع آن در توالی ژنتیکی است. برای نمونه، سادهترین نوع جهش، نوعی جهش نقطهای است که طی آن، تنها یک جفت باز آلی با باز دیگری تعویض میشود. اگر این تغییر باعث تغییر در توالی اسید آمینهها نشود، اثر خاصی بر عملکرد پروتئین نداشته و ممکن است کاملاً بیضرر باشد.
با این حال، برخی جهشها میتوانند بسیار جدی و آسیبزا باشند. بهعنوان مثال، جهشهایی مانند جهشهای حذفی (Deletion) یا جایگیری (Insertion)، بهطور مستقیم در ساختار پروتئین نهایی دخالت کرده و ممکن است منجر به تولید پروتئینهایی ناقص، معیوب و یا غیرقابل استفاده شوند.
از سوی دیگر، جهشها فقط محدود به یک نقطه خاص از ژنوم نیستند و میتوانند در مقیاسهای بسیار وسیعتری نیز رخ دهند. در چنین حالاتی، بخشهای بزرگی از DNA یا RNA دچار تغییر میشوند. این نوع از جهشها شامل موارد زیر هستند:
-
وارونگی (Inversion): قسمتی از ماده ژنتیکی برعکس شده و در جای خود قرار میگیرد.
-
جایگیری (Insertion): قطعهای جدید از DNA به توالی موجود افزوده میشود.
-
مضاعف شدن (Duplication): بخشی از ماده ژنتیکی چند بار تکرار میشود.
-
حذف (Deletion): بخشهایی از DNA یا RNA کاملاً حذف میشوند.
-
جابجایی (Translocation): قطعاتی از کروموزومها جابهجا شده و به موقعیتی جدید منتقل میشوند.
نتایج این نوع جهشها میتواند بسیار متنوع باشد. برخی از آنها میتوانند باعث بروز بیماری، اختلال عملکرد سلولی یا حتی مرگ ارگانیسم شوند. در مقابل، گاهی جهشها سودمند بوده و به سازگاری بیشتر موجود زنده با محیط کمک میکنند. همچنین، در برخی موارد خاص، تغییرات ژنتیکی ایجاد شده توسط جهش، هیچ اثر محسوسی بر فنوتیپ ارگانیسم ندارند؛ به این نوع از جهشها، جهش خاموش یا جهش خنثی (Silent Mutation) گفته میشود.
در نهایت، بسته به نوع، محل، و شدت جهش، ممکن است عملکرد یک ژن از بین برود، تقویت شود، یا به شکلی تغییر کند که میزان بیان ژن کاهش یا افزایش یابد. در شرایط خاص، جهشها حتی میتوانند ساختار و ترکیب ژنوم را بهگونهای تغییر دهند که برای ارگانیسم کشنده باشد.
انواع جهش
جهشها را میتوان با توجه به علت ایجاد جهش، تأثیر آن بر عملکرد محصول ژن یا نوع تغییری که در ساختار ژن ایجاد میشود، به شیوههای مختلفی طبقهبندی کرد.
عوامل مختلفی به عنوان جهشزا (Mutagen) شناخته میشوند؛ این عوامل شامل ترکیبات سرطانزا، پرتوهای پرانرژی مانند پرتوهای یونیزان، شرایط محیطی نظیر آلودگیها و حتی برخی مواد غذایی خاص هستند که قادرند ساختار ماده ژنتیکی ارگانیسمها را تغییر دهند. علاوه بر این عوامل خارجی، بعضی از جهشها به صورت طبیعی و در فرآیند همانندسازی یا تکثیر DNA و RNA به وقوع میپیوندند. در این موارد، آنزیمها و دیگر اجزای دخیل در همانندسازی ممکن است در قرار دادن بازهای نوکلئوتیدی در رشته جدید دچار خطا شوند و در نتیجه، توالی ژنتیکی تغییر کند.
جهشها را میتوان بر اساس تأثیر آنها بر ظاهر و فنوتیپ (Phenotype) افراد نیز دستهبندی کرد. بر اساس این معیار، جهشها به سه گروه اصلی تقسیم میشوند:
-
جهش مضر (Harmful Mutation): این نوع جهش باعث بروز صفاتی در فرد میشود که برای بقای او مضر هستند. در نتیجه، افراد دارای چنین جهشهایی معمولاً توسط فرایند انتخاب طبیعی از جمعیت حذف میشوند.
-
جهش خنثی (Neutral Mutation): این نوع جهشها معمولاً تغییری مشهود یا قابل توجه در صفات ظاهری فرد ایجاد نمیکنند و اثر مشخصی بر بقای او ندارند؛ نه مفید و نه مضر هستند.
-
جهش مفید (Beneficial Mutation): در این نوع جهش، صفاتی در فرد ایجاد میشود که مزایایی برای بقا و تولید مثل او به همراه دارد. در این موارد، انتخاب طبیعی افراد دارای این نوع جهشها را ترجیح داده و زمینه را برای بقای بهتر و تولید نسل بیشتر آنها فراهم میکند.
از منظر عملکردی، جهشها میتوانند به صورت زیر تقسیم شوند:
-
جهش از دست دادن عملکرد (Loss-of-Function Mutation): در این حالت، فعالیت ژن کاهش مییابد یا کاملاً از بین میرود.
-
جهش افزایش عملکرد (Gain-of-Function Mutation): این نوع جهش باعث افزایش فعالیت ژن یا بروز عملکرد جدیدی میشود که در حالت طبیعی وجود نداشته است.
در موجوداتی که به صورت هتروزیگوت هستند (دارای دو نسخه مختلف از یک ژن)، برخی از ژنهای جهشیافته ممکن است عملکرد آلل نوع وحشی (Wild-Type Allele) یا غالب را مختل کنند. به این نوع جهشها، جهش منفی غالب (Dominant Negative Mutation) گفته میشود.
تمام این اثرات، ناشی از تغییرات ساختاری در ژن یا ماده کروموزومی مرتبط با آن هستند. این تغییرات ساختاری معمولاً به شکلهای زیر دستهبندی میشوند:
-
جهشهای جایگزینی (Substitution Mutations)
-
جهشهای حذف (Deletion)
-
جهشهای جایگیری (Insertion)
-
جهشهای مضاعفشدن یا تقویت (Duplication/Amplification)
-
جهشهای جابجایی (Translocation)
جهشهای جایگزینی
جهشهای جایگزینی یا تعویضی (Substitution Mutations) زمانی رخ میدهند که یک نوکلئوتید منفرد در توالی DNA یا RNA با نوکلئوتید دیگری جایگزین شود. در موجوداتی که دارای ماده ژنتیکی دو رشتهای هستند، این تغییر نوکلئوتیدی به معنی تغییر جفت باز مکمل نیز خواهد بود. برای مثال، یک جفت باز A:T ممکن است به G:C یا حتی T:A تغییر یابد.
تأثیر این نوع جهش بسته به محلی که در آن رخ داده است، بسیار متفاوت خواهد بود. اگر جهش در نواحی محافظتشده ژنوم اتفاق بیفتد—مانند بخشهایی از ژن که پروتئینهای ضروری یا حساس را کد میکنند، یا نواحی تنظیمی مانند پروموتورها—نتیجه میتواند بسیار زیانبار باشد. در مقابل، اگر چنین جهشی در نواحی غیر حیاتی یا کمتر حساس ژنوم رخ دهد، اثرات آن معمولاً کمخطر و حتی گاهی بیاهمیت هستند.
برای نمونه، اگر جهش جایگزینی در ناحیه پروموتور یا سایر بخشهای تنظیمی ژن رخ دهد، میتواند باعث شود که بیان ژن (Expression) یا پاسخ آن به عوامل محرک تغییر کند.
در نواحیای از ژن که پروتئینها را کد میکنند، اگر تعویض نوکلئوتید در وضعیت سوم از کدون اتفاق بیفتد (کدون: توالی سهتایی از بازها که یک اسید آمینه را رمزگذاری میکند)، در بسیاری از موارد تغییری در اسید آمینه تولیدشده ایجاد نمیشود. به این نوع تغییرات، جهشهای خاموش (Silent Mutations) گفته میشود، چرا که اگرچه توالی DNA تغییر کرده، اما پروتئین نهایی دستنخورده باقی میماند.
جابجایی روبرتسونی (Robertsonian Translocation)
جابجایی روبرتسونی نوعی تغییر کروموزومی است که طی آن دو کروموزوم غیرهمولوگ به یکدیگر متصل میشوند. به عبارت دیگر، بخشی از یک کروموزوم از یک جفت و بخشی از کروموزوم دیگری از جفتی متفاوت به هم میچسبند و یک کروموزوم منفرد و جدید را تشکیل میدهند. این رویداد در نتیجهی شکست در ناحیهی سانترومری (مرکز کروموزوم) و اتصال بازآراییشدهی بازوهای بلند کروموزومها رخ میدهد.
در برخی موارد، این جابجاییها بدون حذف مواد ژنتیکی صورت میگیرند و عملکرد ژنها دچار اختلال نمیشود. به این وضعیت، جابجایی متعادل (Balanced Translocation) گفته میشود. در چنین حالتی، اگرچه توزیع ژنها تغییر کرده است، اما اطلاعات ژنتیکی بهطور کامل حفظ شده و معمولاً فرد حامل فاقد نشانههای بالینی است.
اما اگر طی فرآیند جابجایی بخشی از ژنها از بین برود یا حذف شود، جابجایی نامتعادل (Unbalanced Translocation) رخ میدهد. این نوع از جابجایی میتواند منجر به از دست رفتن عملکرد ژنها و بروز ناهنجاریهای کروموزومی و اختلالات فنوتیپی شود.
جهش مضاعفشدگی (Gene Duplication)
جهش مضاعفشدگی یکی از مهمترین مکانیسمهای ایجاد تنوع ژنتیکی و پایهای برای تکامل موجودات زنده محسوب میشود. این جهش زمانی رخ میدهد که بخشی از DNA، شامل یک یا چند ژن، بهطور غیرطبیعی تکرار و در جایگاه دیگری از ژنوم وارد شود. در نتیجه، یک نسخه اضافی از ژن یا توالی ژنی در ژنوم ظاهر میشود.
منشأ این نوع جهش میتواند شامل خطا در همانندسازی DNA، اختلال در مکانیزمهای ترمیم ژنتیکی، یا بازآراییهای کروموزومی مانند کراساور نابرابر (Unequal Crossover) در حین میوز باشد.
از دیگر عوامل موثر میتوان به رتروترانسپوزونها (Retrotransposons) اشاره کرد؛ این عناصر متحرک ژنتیکی با توانایی تکثیر و جایگیری مجدد در بخشهای مختلف ژنوم، میتوانند باعث ایجاد نسخههای اضافی از توالیهای ژنی شوند. همچنین، پدیدههای کروموزومی نظیر آنیوپلوئیدی (تغییر در تعداد کروموزومها) و پلیپلوئیدی (وجود چندین مجموعه کامل از کروموزومها) نیز از دیگر عوامل موثر در مضاعفشدگی ژنها هستند.
جهشهایی در مقیاس بزرگ (Large-scale Mutations)
تغییرات ژنتیکی تنها به سطح نوکلئوتیدی محدود نمیشوند و ممکن است در مقیاس وسیعتری رخ دهند. این نوع جهشها شامل تغییرات گستردهای در ساختار ژنوم هستند و میتوانند هزاران جفت باز را درگیر کنند.
از مهمترین انواع جهشهای بزرگمقیاس میتوان به مضاعفشدگی، حذفهای بزرگ (Large Deletions) و جابجاییهای کروموزومی (Translocations) اشاره کرد. در جهشهای مضاعفشدگی، بخشهایی از ژنوم در چندین نسخه تکرار میشوند، در حالیکه در جهشهای حذفی، بخشهایی وسیع از DNA حذف شده و از ژنوم خارج میشوند.
جابجاییهای کروموزومی در این مقیاس ممکن است بخشهایی از ژنوم را به کروموزوم دیگری منتقل کرده یا همان بخش را در جهت معکوس در همان کروموزوم قرار دهند که به آن وارونگی (Inversion) گفته میشود.
چنین بازآراییهایی میتوانند پیامدهای عملکردی بسیار قابل توجهی داشته باشند؛ برای مثال، ژنهایی که در حالت طبیعی بسیار دور از هم قرار دارند ممکن است در کنار هم قرار گیرند. این نزدیکی جدید میتواند منجر به ترکیب بخشهایی از دو ژن مختلف و تولید پروتئینهای موزاییکی (Chimeric Proteins) شود. همچنین، این بازآراییها ممکن است تنظیمکنندههای ژنی جدیدی را وارد مدار فعالیت ژنها کنند که بهکلی الگوی بیان ژن را تغییر دهد.
جهشزایی ژنتیکی فرآیند ایجاد عمدی تغییرات در توالی DNA ژنوم یک موجود زنده است. چه در تحقیقات پایه، چه در زیستفناوری، پزشکی یا کشاورزی، جهشزایی به دانشمندان اجازه میدهد عملکرد ژنها را بررسی کنند، ویژگیهای جدیدی ایجاد کنند و خطاهای ژنتیکی را اصلاح نمایند. در طول دههها، این حوزه از روشهای تصادفی ابتدایی به سیستمهای برنامهپذیر پیچیدهای مانند CRISPR-Cas9 تکامل یافته است. این مقاله روشهای اصلی جهشزایی—از جمله جهشزایی هدفمند، مبتنی بر CRISPR و درج DNA—را بررسی کرده و کاربردها، مزایا و محدودیتهای هر یک را شرح میدهد.
2. مفهوم جهشزایی
جهشزایی را میتوان به طور کلی به دو نوع تقسیم کرد:
-
جهشزایی تصادفی: تغییرات بدون هدفگیری توالی خاصی ایجاد میشوند. نمونههایی از آن شامل تابش، مواد شیمیایی جهشزا، و جهشزایی ترانسپوزونی هستند.
-
جهشزایی هدفمند: تغییرات خاص و عمدی در توالیهای شناختهشده DNA ایجاد میشود. این شامل جهشزایی هدفمند و ویرایش ژنی مبتنی بر CRISPR است.
توسعه روشهای هدفمند، انقلابی در تحقیقات زیستی و نوآوریهای درمانی ایجاد کرده است.
3. جهشزایی هدفمند (Site-Directed Mutagenesis – SDM)
3.1 تعریف و اصول
جهشزایی هدفمند (SDM) تکنیکی مولکولی است که اجازه میدهد تغییرات دقیقی مانند جایگزینی، حذف یا درج بازهای نوکلئوتیدی در موقعیتهای خاصی از DNA صورت گیرد. این روش برای مطالعه عملکرد ژنها، رابطه ساختار-عملکرد پروتئینها و ایجاد گونههای بهبودیافته بسیار مهم است.
3.2 تکنیکها
-
جهشزایی با استفاده از الیگونوکلئوتیدها: از پرایمرهای سنتتیک حامل جهش برای تکثیر و القای تغییرات در توالی هدف استفاده میشود.
-
جهشزایی مبتنی بر PCR: جهشها از طریق پرایمرهای تغییر یافته در یک واکنش زنجیرهای پلیمراز (PCR) وارد میشوند و سپس DNA الگو توسط آنزیمهایی مانند DpnI هضم میگردد.
-
جهشزایی به روش Kunkel: از DNA تکرشتهای حاوی اوراسیل و الیگونوکلئوتیدهای جهشزا در یک سیستم باکتریایی استفاده میشود.
3.3 کاربردها
-
تحلیل عملکرد پروتئینها و آنزیمها
-
تغییر ویژگی یا فعالیت آنزیمها نسبت به سوبسترا
-
بررسی توالیهای تنظیمی پروموتورها
-
توسعه درمانها از طریق مهندسی پروتئینها
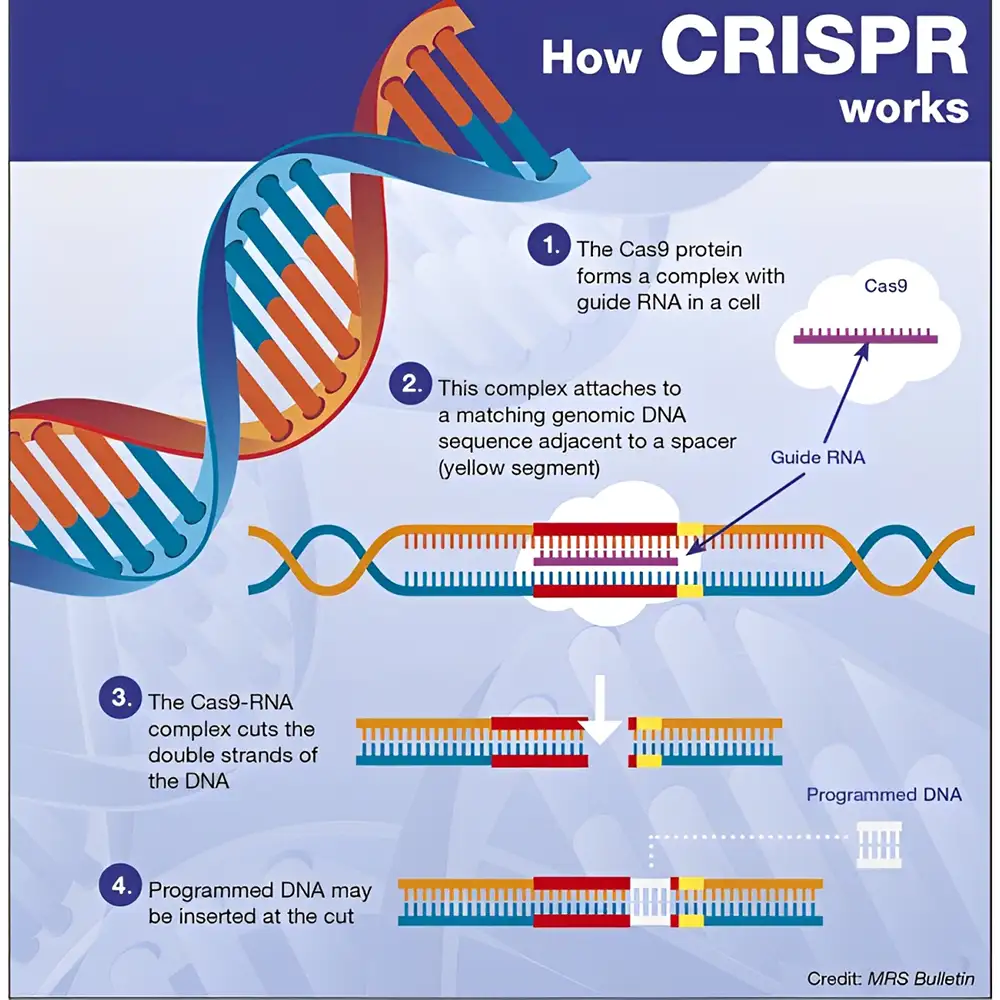
4. سیستمهای CRISPR-Cas: ویرایش ژنوم با دقت بالا
4.1 مرور کلی
CRISPR (تکرارهای کوتاه با فاصله منظم خوشهای) به همراه پروتئینهای Cas (مرتبط با CRISPR)، بهویژه Cas9، به ابزار تحولآفرینی در زیستشناسی مولکولی تبدیل شده است. این سیستم امکان ایجاد تغییرات هدفمند و برنامهریزی شده را فراهم میکند.
4.2 سازوکار عملکرد
سیستم CRISPR-Cas9 از دو مؤلفه کلیدی استفاده میکند:
-
RNA راهنما (gRNA): که به توالی مکمل DNA متصل میشود.
-
آنزیم Cas9: که در محل هدف شکست دو رشتهای (DSB) ایجاد میکند.
DSBها به دو روش ترمیم میشوند:
-
اتصال انتهای غیرهمولوگ (NHEJ): معمولاً منجر به درج یا حذف (indel) میشود.
-
ترمیم با الگوی همولوگ (HDR): امکان درج یا تصحیح دقیق با استفاده از الگوی DNA فراهم میشود.
4.3 پیشرفتها و انواع مختلف
-
CRISPR-Cas12 و Cas13: به ترتیب DNA و RNA را هدف قرار میدهند.
-
ویرایشگرهای باز: بازهای DNA را بدون بریدن رشته DNA تغییر میدهند (مثلاً A به G).
-
ویرایش نخستین (Prime Editing): روشی همهکاره که ویرایش نوع «جستجو و جایگزینی» را امکانپذیر میکند.
4.4 کاربردها
-
ناکاوت ژنها و مطالعه عملکردی
-
ایجاد مدلهای بیماری در حیوانات
-
اصلاح بیماریهای ژنتیکی (مثلاً کمخونی داسیشکل)
-
مهندسی محصولات مقاوم به تنش
-
توسعه «ژن درایوها» و ابزارهای زیستشناسی مصنوعی
5. جهشزایی درجشونده (Insertional Mutagenesis)
5.1 اصل عملکرد
در این روش، با درج یک قطعه DNA خارجی درون توالی ژن، عملکرد آن مختل میشود. این DNA میتواند یک ژن نشانهگر (مثلاً مقاومت آنتیبیوتیکی) یا یک گزارشگر باشد.
5.2 ابزارها
-
ترانسپوزونها: «ژنهای پرشی» که بهطور تصادفی وارد ژنوم میشوند.
-
رتروویروسها / لنتیویروسها: برای وارد کردن DNA به سلولهای پستانداران استفاده میشوند.
-
ژنترپها (Gene traps): ساختارهای ویژهای که هنگام درج، فعالیت ژن را گزارش میکنند.
5.3 کاربردها
-
ژنومیکس عملکردی و کشف ژن
-
شناسایی ژنهای مرتبط با سرطان
-
ایجاد ناکاوت در سلولهای بنیادی جنینی
-
مطالعه ژنهای ضروری در میکروبها و مدلهای حیوانی
6. سایر روشهای جهشزایی ژنتیکی
6.1 جهشزایی تصادفی با مواد شیمیایی یا تابش
-
اتیل متانسولفونات (EMS)، نیتروزوگوانیدین: ایجاد جهشهای نقطهای
-
اشعه فرابنفش و تابشهای یونیزان: القای شکستها یا حذفها در DNA
اگرچه این روشها هدفمند نیستند، اما برای غربالگری فنوتیپهای جدید مفید هستند.
6.2 جهشزایی هدایتشده با RNA و فناوری آنتیسنس
استفاده از الیگونوکلئوتیدهای آنتیسنس یا RNAi برای خاموش کردن بیان ژن، بدون تغییر مستقیم در توالی DNA
7. کاربردها در حوزههای مختلف
7.1 پزشکی و درمان
-
ژندرمانی: اصلاح هدفمند نقصهای ژنتیکی
-
سلولهای CAR-T: سلولهای ایمنی مهندسیشده برای درمان سرطان
-
مدلسازی بیماریهای ژنتیکی: ایجاد مدلهای حیوانی با استفاده از CRISPR یا جهشزایی درجشونده
7.2 زیستفناوری کشاورزی
-
توسعه محصولات مقاوم به خشکی یا آفات
-
بهبود پروفایل تغذیهای محصولات
-
ایجاد گیاهان یا حیوانات عقیم برای کنترل زیستی
7.3 زیستشناسی صنعتی و مصنوعی
-
مهندسی میکروبها برای تولید سوخت زیستی، آنزیمها یا داروها
-
ساخت ژنومهای مصنوعی یا طراحی ژنومهای حداقلی
-
تغییر آنزیمها برای بهرهوری یا ویژگیهای جدید
8. ایمنی، اخلاق و نظارتهای قانونی
8.1 اثرات خارج از هدف (Off-target effects)
بهویژه در روشهای CRISPR و درج DNA اهمیت دارد. راهکارهای کاهش این اثرات شامل:
-
طراحی بهینه gRNA
-
استفاده از آنزیمهای Cas با دقت بالا
-
تحلیل گسترده برای شناسایی اثرات خارج از هدف
8.2 نگرانیهای مربوط به ویرایش ژن در سلولهای جنسی (Germline)
تغییرات ارثی، بهویژه در انسان، مسائل اخلاقی مهمی را به همراه دارند. تولد نوزادانی با ژن ویرایششده در چین موجب بحثهای جهانی شد.
8.3 قوانین و مقررات
بین کشورها متفاوت است: اروپا مقررات سختگیرانهای بر GMOs دارد؛ در حالیکه ایالات متحده از رویکرد مبتنی بر محصول استفاده میکند.
درمانهای مبتنی بر CRISPR در مرحله آزمایشهای بالینی هستند و تأیید نهایی نیازمند دادههای ایمنی درازمدت است.
9. چالشها و مسیرهای آینده
9.1 موانع فنی
-
سیستمهای کارآمد برای انتقال ژن (مثلاً وکتورهای ویروسی، نانوذرات)
-
کنترل مکانیزمهای ترمیم (HDR در مقابل NHEJ)
-
ویرایش DNA میتوکندری هنوز چالشبرانگیز است
9.2 فناوریهای نوظهور
-
ویرایش نخستین (Prime Editing) برای اصلاحات همهکاره
-
سیستمهای CRISPR-Cas3، Cas13 و CasΦ برای کاربردهای جدید
-
ویرایش اپیژنتیکی: تنظیم بیان ژن بدون تغییر توالی DNA
-
ویرایشگرهای باز درونزنده و سیستمهای انتقال مانند AAV و نانوذرات لیپیدی
9.3 نوآوری اخلاقمدار
آینده جهشزایی تنها به قدرت فناوری وابسته نیست، بلکه نیازمند مشارکت عمومی، هوشمندی قانونگذاری و پایبندی اخلاقی است.
10. نتیجهگیری
جهشزایی ژنتیکی دیگر محدود به پتریدیش یا آزمایشگاه تحقیقاتی نیست—بلکه در حال بازآفرینی پزشکی، کشاورزی و صنعت است. از جهشزایی هدفمند دقیق تا ابزارهای انقلابی مانند CRISPR، توانایی دستکاری ژنومها با دقت و هدفمندی هر روز قدرتمندتر و در دسترستر میشود. با رشد کاربردها، درک ما از خطرات و مسئولیتها نیز باید رشد یابد.