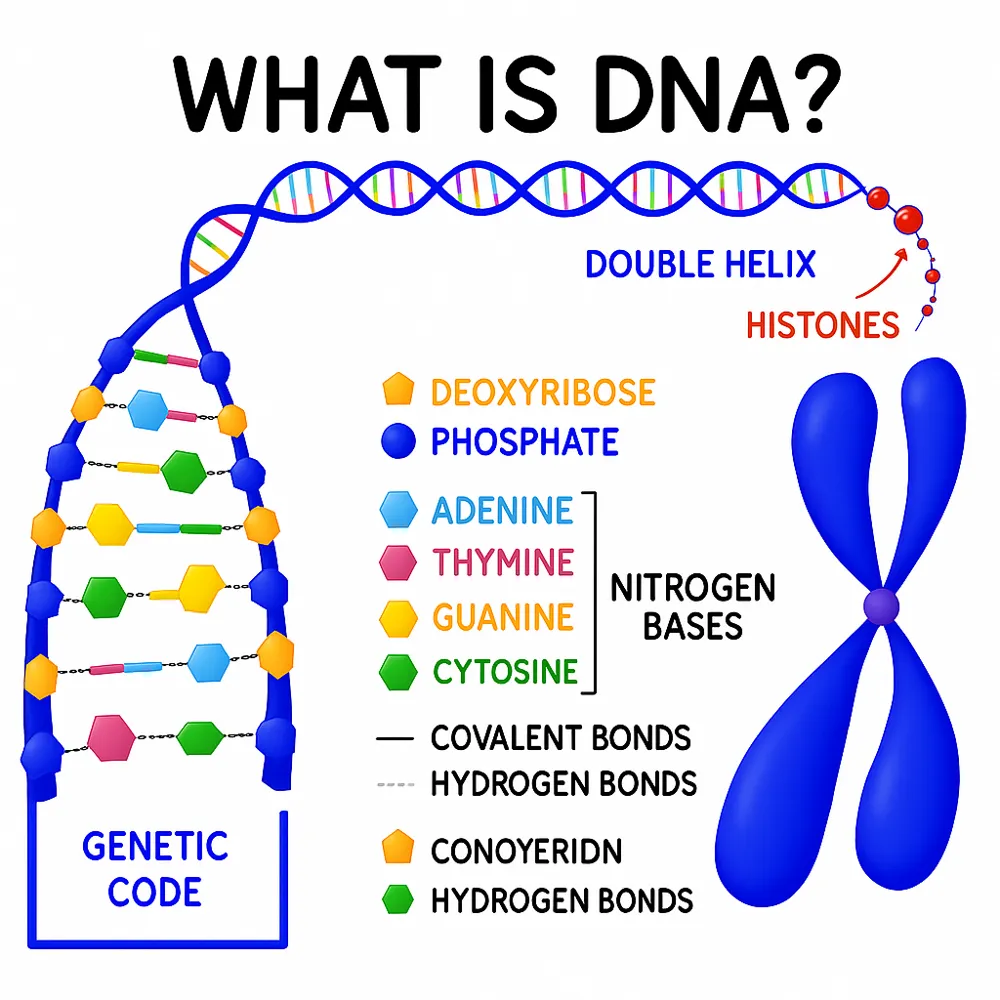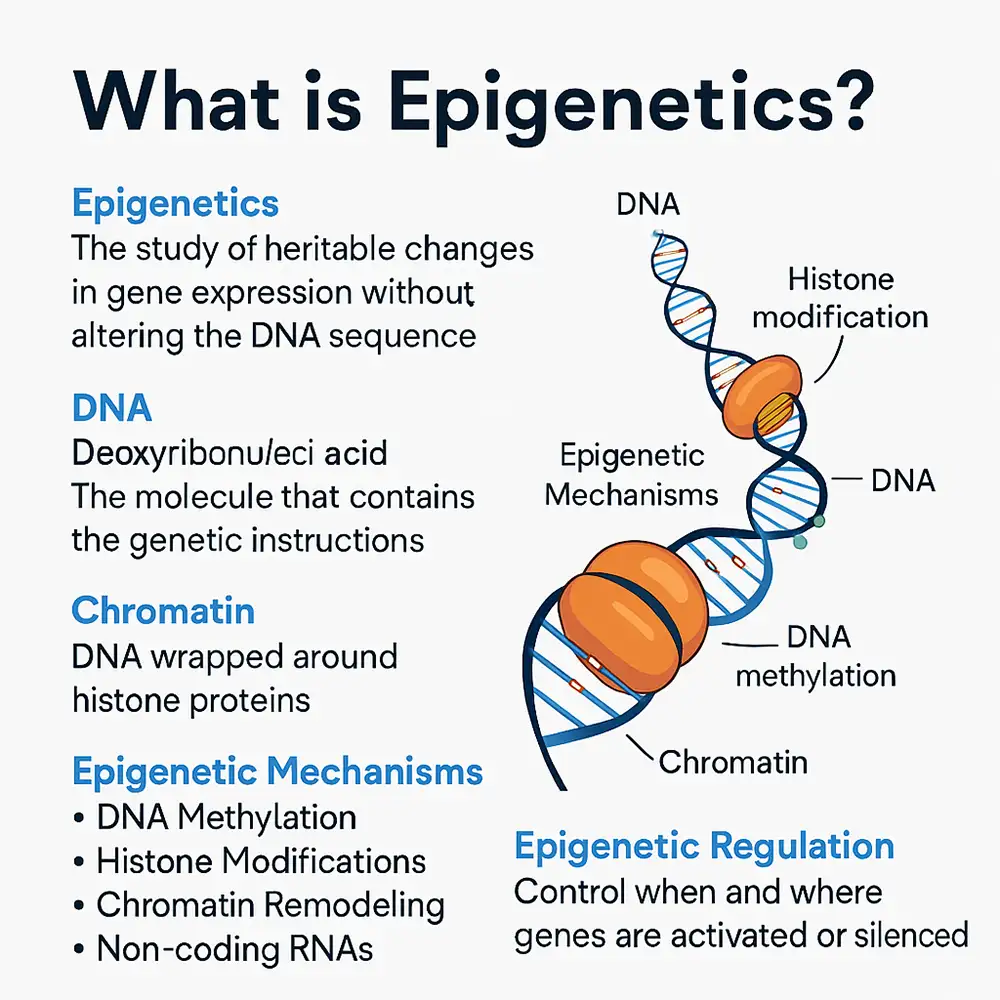
اپی ژنتیک چیست؟
اپیژنتیک مطالعه تغییرات قابل ارث در بیان ژن یا فنوتیپ سلولی است که بدون تغییر در توالی اصلی DNA رخ میدهد. این تغییرات میتوانند نحوه فعال یا غیرفعال شدن ژنها را تنظیم کنند و نقش بسیار مهمی در رشد، تمایز سلولی و بروز بیماریها ایفا کنند. برخلاف جهشهای ژنتیکی که باعث تغییر کد DNA میشوند، تغییرات اپیژنتیکی از طریق تغییرات شیمیایی روی DNA یا ساختار کروماتین بر فعالیت ژنها تأثیر میگذارند، که این تغییرات اغلب در پاسخ به عوامل محیطی ایجاد میشوند.
اصطلاح «اپیژنتیک» برای اولین بار توسط کانراد وادینگتون در دهه ۱۹۴۰ مطرح شد تا تعامل بین ژنها و محصولات آنها که باعث شکلگیری فنوتیپ میشود را توصیف کند. از آن زمان، این حوزه به طور چشمگیری گسترش یافته و مکانیزمهای پیچیدهای مانند متیلاسیون DNA، تغییرات روی هیستونها، بازآرایی کروماتین و RNAهای غیرکدکننده را آشکار ساخته است.
درک اپیژنتیک تحول بزرگی در تحقیقات زیستی و پزشکی ایجاد کرده است. این مفهوم توضیح میدهد که چرا دوقلوهای همسان با یک ژنوم میتوانند ویژگیهای متفاوتی داشته باشند، چگونه مواجهه با عوامل محیطی میتواند اثرات ماندگاری بر بیان ژنها داشته باشد، و چگونه بیماریهایی مانند سرطان، اختلالات عصبی و مشکلات متابولیکی میتوانند از طریق اختلال در اپیژنتیک ایجاد شوند.
در این مقاله، ما به بررسی مکانیزمهای اساسی اپیژنتیک، ابزارهای مطالعه آن و کاربردهای گستردهاش در سلامت، کشاورزی و بیوتکنولوژی خواهیم پرداخت.
فهرست مطالب
-
چشمانداز تاریخی اپیژنتیک
-
مفاهیم و تعاریف پایه
-
مکانیزمهای کلیدی اپیژنتیک
-
متیلاسیون DNA
-
تغییرات روی هیستونها
-
بازآرایی کروماتین
-
RNAهای غیرکدکننده
-
-
تنظیم اپیژنتیکی بیان ژن
-
اپیژنتیک در رشد و تمایز
-
تأثیرات محیطی بر اپیژنتیک
-
اپیژنتیک و بیماریها
-
سرطان
-
اختلالات عصبی
-
بیماریهای متابولیک
-
-
وراثت اپیژنتیکی و اثرات چندنسلی
-
تکنیکهای مطالعه اپیژنتیک
-
کاربردهای درمانی اپیژنتیک
-
داروهای اپیژنتیکی
-
پزشکی شخصی
-
-
اپیژنتیک در کشاورزی و بیوتکنولوژی
-
جهتگیریها و چالشهای آینده
-
نتیجهگیری
1. چشمانداز تاریخی اپیژنتیک
مفهوم اپیژنتیک از زیستشناسی توسعهای اولیه به درک مولکولی مدرن تنظیم ژنها تکامل یافته است.
-
کانراد وادینگتون (دهه ۱۹۴۰): اصطلاح «اپیژنتیک» را برای توصیف نحوه تعامل ژنها با محیطشان جهت تولید فنوتیپ به کار برد. این مفهوم به صورت تصویری به شکل «چشمانداز اپیژنتیک» ارائه شد.
-
دهههای ۱۹۷۰–۱۹۸۰: کشف متیلاسیون DNA و نقش آن در تنظیم ژنها. مطالعات نشان دادند که متیلاسیون میتواند باعث خاموشی ژنها شود.
-
دهه ۱۹۹۰: شناسایی تغییرات روی هیستونها و مطرح شدن فرضیه «کد هیستون»، که بیان میکند دنبالههای هیستونی حامل نشانههای شیمیاییای هستند که ساختار کروماتین و فعالیت ژن را تنظیم میکنند.
-
دهه ۲۰۰۰: آغاز پروژه «اپیژنوم انسانی» برای نقشهبرداری الگوهای متیلاسیون DNA در سراسر ژنوم. پیشرفت در تکنولوژی توالییابی شتاب قابل توجهی به تحقیقات اپیژنتیکی بخشید.
-
امروزه: اپیژنتیک به عنوان یک لایه اساسی در تنظیم ژنوم شناخته شده است که در تقریباً تمام زمینههای زیستشناسی و پزشکی اهمیت دارد.
2. مفاهیم و تعاریف پایه
-
اپیژنوم: مجموعه کامل تغییرات اپیژنتیکی روی ماده ژنتیکی یک سلول.
-
کروماتین: ترکیب DNA و پروتئینها (عمدتاً هیستونها) که DNA را در هسته سلول بستهبندی میکند.
-
بیان ژن: فرآیندی که در آن اطلاعات یک ژن برای ساخت محصولات عملکردی مانند پروتئینها استفاده میشود.
-
نشانههای اپیژنتیکی: تغییرات شیمیایی روی DNA یا هیستونها که بدون تغییر توالی DNA، بر بیان ژن تأثیر میگذارند.
3. مکانیزمهای کلیدی اپیژنتیک
3.1 متیلاسیون DNA
-
تعریف: اضافه شدن یک گروه متیل (CH3) به کربن ۵ سیتوزین، عمدتاً در جایگاههای CpG (جفت باز سیتوزین-گوانین).
-
آنزیمها: DNA متیلترانسفرازها (DNMTs) از جمله DNMT1، DNMT3A و DNMT3B مسئول این فرآیند هستند.
-
وظیفه: معمولاً باعث خاموشی ژنها میشود؛ این کار از طریق جلوگیری از اتصال فاکتورهای رونویسی یا جذب پروتئینهایی که کروماتین را فشرده میکنند، انجام میشود.
-
نقش: متیلاسیون در پدیدههایی مانند ایمپرینتینگ ژنومی، غیرفعالسازی کروموزوم X و سرکوب عناصر متحرک نقش حیاتی دارد.
-
تنظیم دینامیک: الگوهای متیلاسیون DNA میتوانند به صورت فعال توسط آنزیمهای TET که باعث اکسیداسیون متیلسیتوزین میشوند، حذف گردند.
3.2 تغییرات روی هیستونها
-
انواع: استیلاسیون (آستیلدار شدن)، متیلاسیون، فسفریلاسیون، یوبیکوئیتیناسیون، سامویلاسیون روی دنبالههای هیستون.
-
آنزیمها: شامل هیستون استیلترانسفرازها (HATs)، هیستون داستیلازها (HDACs)، متیلترانسفرازها و دمتیلآزها.
-
تأثیرات: استیلاسیون معمولاً با فعالسازی ژن همراه است زیرا باعث باز شدن ساختار کروماتین میشود؛ اثرات متیلاسیون بسته به جایگاه و نوع آن متفاوت است.
-
فرضیه کد هیستون: الگوی تغییرات روی هیستونها یک کد است که وضعیت کروماتین و فعالیت ژن را تعیین میکند.
3.3 بازآرایی کروماتین
-
مجموعههای وابسته به ATP مانند SWI/SNF موقعیت یا حذف نوکلئوزومها را تغییر میدهند تا دسترسی به DNA تنظیم شود.
-
هدف: تسهیل یا ممانعت از اتصال ماشینآلات رونویسی، ترمیم DNA و رونویسی.
3.4 RNAهای غیرکدکننده
-
انواع: شامل microRNAs (miRNAs)، RNAهای بلند غیرکدکننده (lncRNAs) و RNAهای کوچک مداخلهگر (siRNAs).
-
وظایف: تنظیم بیان ژن پس از رونویسی یا جذب عوامل اپیژنتیکی به مناطق خاص ژنومی.
4. تنظیم اپیژنتیکی بیان ژن
بیان ژن فرآیندی است که طی آن اطلاعات ژنتیکی به محصولات عملکردی مانند پروتئینها ترجمه میشود. تنظیم اپیژنتیکی نقش مهمی در کنترل این فرآیند دارد و میتواند ژنها را در زمان و مکانهای خاص فعال یا خاموش کند.
4.1 نقش متیلاسیون DNA در تنظیم بیان ژن
-
متیلاسیون در نواحی پروموتر ژنها معمولاً با سرکوب بیان آنها مرتبط است.
-
متیلاسیون باعث جذب پروتئینهای مهاری مانند MBD (Methyl-CpG binding domain proteins) میشود که کروماتین را به فرم فشرده تغییر میدهند و از دسترسی عوامل رونویسی به DNA جلوگیری میکنند.
-
در نواحی داخل ژن (ژن بادی)، متیلاسیون میتواند نقشهای پیچیدهتری داشته باشد، مانند تنظیم برش RNA یا جلوگیری از شروع رونویسی در نقاط غیرمجاز.
-
4.2 تغییرات روی هیستون و بیان ژن
-
هیستونهایی که با استیلاسیون همراه هستند، معمولاً نشانگر مناطق فعال ژنی هستند. این تغییر باعث باز شدن کروماتین و دسترسی بهتر فاکتورهای رونویسی میشود.
-
متیلاسیون هیستونها میتواند هم باعث فعال شدن و هم سرکوب ژنها شود، بسته به اینکه کدام اسید آمینه و کدام نوع متیلاسیون انجام شود. به عنوان مثال:
-
متیلاسیون H3K4 (هیستون H3، لیزین 4) معمولاً با فعال بودن ژن مرتبط است.
-
متیلاسیون H3K27 معمولاً با خاموشی ژن همراه است.
-
-
4.3 بازآرایی کروماتین و بیان ژن
-
کمپلکسهای بازآرایی کروماتین مانند SWI/SNF میتوانند موقعیت نوکلئوزومها را تغییر دهند و به این ترتیب مناطق ژنی را باز یا بسته کنند.
-
این تغییرات ساختاری، بهخصوص در نواحی پروموتر و انهانسر، دسترسی فاکتورهای رونویسی را تسهیل یا محدود میکنند.
-
4.4 RNAهای غیرکدکننده و تنظیم بیان ژن
-
miRNAها پس از تولید، به mRNAهای هدف متصل میشوند و باعث تجزیه آنها یا جلوگیری از ترجمه میشوند.
-
برخی از lncRNAها میتوانند به کروماتین متصل شده و آنزیمهای اپیژنتیکی را به محل خاصی هدایت کنند تا بیان ژن را تغییر دهند.
5. اپیژنتیک در رشد و تمایز سلولی
رشد و تمایز سلولی فرایندهایی هستند که طی آن سلولهای اولیه یا سلولهای بنیادی به سلولهای تخصصی با عملکردهای خاص تبدیل میشوند. این فرآیندها توسط تنظیم دقیق بیان ژن کنترل میشوند و اپیژنتیک نقش کلیدی در این تنظیم ایفا میکند.
5.1 نقش اپیژنتیک در جنینزایی (Embrogenesis)
-
در اوایل جنینزایی، سلولها تقریباً توانایی تمایز به همه نوع سلول را دارند (تکتوانی).
-
به مرور، الگوهای متیلاسیون DNA و تغییرات هیستونی تغییر میکند و باعث فعال یا خاموش شدن گروههای ژنی خاص میشود.
-
این تغییرات اپیژنتیکی مسیر تمایز سلولی را هدایت میکنند، به گونهای که سلولها به تدریج توانایی تبدیل شدن به انواع مختلف بافتها و اندامها را پیدا میکنند.
5.2 تمایز سلولی و تثبیت هویت سلولی
-
پس از تمایز، سلولها به یک وضعیت نسبتاً پایدار اپیژنتیکی میرسند که هویت و عملکرد خاص آنها را حفظ میکند.
-
این تثبیت با الگوهای ماندگار متیلاسیون DNA و نشانههای هیستونی مشخص اتفاق میافتد.
-
به عنوان مثال، سلولهای عصبی دارای الگوهای خاصی از هیستوناستیلاسیون و متیلاسیون هستند که با سلولهای عضلانی متفاوت است.
5.3 ایمپرینتینگ ژنتیکی (Genomic Imprinting)
-
ایمپرینتینگ یک پدیده اپیژنتیکی است که در آن تنها یکی از دو آلل (پدر یا مادر) یک ژن بیان میشود، در حالی که آلل دیگر خاموش است.
-
این پدیده از طریق متیلاسیون انتخابی DNA و تغییرات روی هیستون تنظیم میشود.
-
مثال: ژن IGF2 که تنها آلل پدری آن فعال است. اختلال در ایمپرینتینگ میتواند منجر به بیماریهایی مثل سندرم پرادر-ویلی شود.
5.4 غیرفعالسازی کروموزوم X
-
در سلولهای ماده، برای جلوگیری از اضافه بودن بیان ژنهای کروموزوم X، یکی از دو کروموزوم X به صورت اپیژنتیکی خاموش میشود.
-
این فرآیند شامل متیلاسیون DNA، تغییرات هیستونی و RNA غیرکدکننده XIST است که کروموزوم X را به شکل فشرده در میآورد و از بیان ژنها جلوگیری میکند.
-
این مکانیسم اطمینان میدهد که سلولهای ماده مانند سلولهای نر فقط یک نسخه فعال از ژنهای کروموزوم X دارند.
5.5 نقش RNAهای غیرکدکننده در تمایز
-
برخی lncRNAها به تنظیم فرآیند تمایز کمک میکنند، مثلاً با هدایت آنزیمهای اپیژنتیکی به ژنهای خاص.
-
miRNAها نیز میتوانند بیان ژنهای مرتبط با تمایز را تنظیم کنند.
6. تاثیر عوامل محیطی بر اپیژنتیک
اپیژنتیک به عنوان پلی بین ژنها و محیط عمل میکند. تغییرات اپیژنتیکی میتوانند تحت تأثیر عوامل محیطی مختلف قرار بگیرند و به این ترتیب، محیط بیرونی میتواند به صورت مستقیم یا غیرمستقیم بر بیان ژنها و سلامت فرد تاثیرگذار باشد.
6.1 تغذیه و رژیم غذایی
-
مواد غذایی مختلف میتوانند به عنوان منابع گروههای متیل (مثل فولیک اسید، ویتامین B12، کولین) عمل کنند که برای متیلاسیون DNA ضروری هستند.
-
تغییر در رژیم غذایی میتواند الگوهای متیلاسیون را تغییر دهد و در نتیجه بر رشد، سلامت و حتی خطر بیماریهای مزمن تاثیر بگذارد.
-
مثال: پژوهشهای انجام شده روی موشها نشان دادهاند که کمبود فولیک اسید در دوران بارداری میتواند باعث تغییرات اپیژنتیکی شود که رشد جنین را تحت تاثیر قرار میدهد.
6.2 سموم و آلودگیها
-
قرار گرفتن در معرض مواد شیمیایی مضر مانند دود سیگار، آفتکشها، فلزات سنگین و آلودگیهای هوا میتواند تغییرات اپیژنتیکی ایجاد کند.
-
این تغییرات ممکن است منجر به اختلال در بیان ژنها و افزایش خطر ابتلا به بیماریهایی مانند سرطان، بیماریهای تنفسی و اختلالات عصبی شوند.
-
مثال: مواجهه با دود سیگار باعث افزایش متیلاسیون ژنهایی میشود که در سرطان ریه نقش دارند.
6.3 استرس و رفتار
-
استرس مزمن روانی و شرایط زندگی ناسالم میتواند منجر به تغییرات اپیژنتیکی در مغز شود.
-
این تغییرات میتوانند بر تنظیم هورمونهای استرس و عملکرد نورونها تاثیر گذاشته و در ایجاد اختلالات روانی مانند افسردگی و اضطراب نقش داشته باشند.
-
مثال: مطالعات روی حیوانات نشان دادهاند که کمبود مراقبت مادرانه منجر به تغییرات در متیلاسیون ژنهای مرتبط با پاسخ به استرس میشود.
6.4 فعالیت بدنی و سبک زندگی
-
ورزش و فعالیت بدنی منظم میتواند الگوهای اپیژنتیکی را تغییر دهد و به بهبود سلامت متابولیک، عملکرد قلبی و مغزی کمک کند.
-
سبک زندگی سالم با کاهش تنش اکسیداتیو و التهاب مزمن، تاثیرات مثبت بر اپیژنتیک دارد.
-
مثال: ورزش منظم باعث افزایش استیلاسیون هیستونهایی میشود که ژنهای محافظتکننده از سلول را فعال میکنند.
7. اپیژنتیک و بیماریها
اپیژنتیک نقش بسیار مهمی در ایجاد و پیشرفت بسیاری از بیماریها دارد. تغییرات اپیژنتیکی میتوانند باعث تنظیم نادرست بیان ژنها شوند که در نهایت منجر به بروز بیماریهای مختلفی از جمله سرطانها، اختلالات عصبی و بیماریهای متابولیک میشود. در این بخش به مهمترین بیماریهایی که ارتباط قوی با اپیژنتیک دارند، میپردازیم.
7.1 سرطان
-
متیلاسیون غیرطبیعی DNA در سرطانها بسیار رایج است. معمولاً مناطق تنظیمی ژنهای سرکوبگر تومور دچار هایپرمتیلاسیون (افزایش بیش از حد متیلاسیون) میشوند که باعث خاموشی این ژنها میشود.
-
برعکس، مناطق دیگری از ژنوم ممکن است دچار هیپومتیلاسیون (کاهش متیلاسیون) شوند که منجر به فعال شدن ژنهای سرطانزا میگردد.
-
تغییرات در هیستونها و RNAهای غیرکدکننده نیز در تنظیم بیان ژنهای سرطان نقش دارند.
-
مثال: در سرطان سینه، متیلاسیون بیش از حد ژن BRCA1 باعث کاهش بیان این ژن و افزایش خطر سرطان میشود.
7.2 اختلالات عصبی
-
اپیژنتیک در رشد و عملکرد مغز بسیار حیاتی است. اختلالات اپیژنتیکی میتواند باعث بیماریهای عصبی و روانی شود.
-
بیماریهایی مانند اسکیزوفرنی، افسردگی، بیماری آلزایمر و بیماری هانتینگتون با تغییرات در الگوهای اپیژنتیکی مرتبط هستند.
-
مثال: در بیماری آلزایمر، تغییرات در متیلاسیون و استیلاسیون هیستونها باعث تغییر بیان ژنهای مرتبط با نورونها و التهاب مغزی میشود.
7.3 بیماریهای متابولیک
-
تغییرات اپیژنتیکی در ژنهایی که در متابولیسم گلوکز، لیپید و انرژی نقش دارند، میتواند منجر به بیماریهایی مانند دیابت نوع 2 و چاقی شود.
-
عوامل محیطی مانند رژیم غذایی ناسالم میتوانند این تغییرات را ایجاد کنند.
-
مثال: متیلاسیون غیرطبیعی ژن PGC-1α که در متابولیسم انرژی نقش دارد، با دیابت نوع 2 مرتبط است.
8. وراثت اپیژنتیکی و تأثیرات بین نسلی
وراثت اپیژنتیکی به انتقال تغییرات اپیژنتیکی از یک نسل به نسل بعد بدون تغییر در توالی DNA گفته میشود. برخلاف ژنهای معمولی که از طریق توالی DNA منتقل میشوند، تغییرات اپیژنتیکی میتوانند به نسلهای بعدی منتقل شوند و بر بیان ژنها و ویژگیهای فنوتیپی تأثیر بگذارند.
8.1 وراثت اپیژنتیکی بین نسلی
-
برخی از نشانههای اپیژنتیکی مانند الگوهای متیلاسیون DNA و اصلاحات هیستونی میتوانند در سلولهای زایا (گامتها) حفظ شوند و به فرزندان منتقل گردند.
-
این وراثت باعث میشود که اثرات محیطی (مثل تغذیه یا استرس) که بر والدین تأثیر گذاشتهاند، بتواند نسل بعد را نیز تحت تأثیر قرار دهد.
-
مثال: مطالعههای روی موشها نشان دادهاند که رژیم غذایی فقیر یا استرس در والدین میتواند باعث تغییرات اپیژنتیکی در فرزندان و حتی نوهها شود.
8.2 بازبرنامهریزی اپیژنتیکی (Epigenetic Reprogramming)
-
در دورههای مختلف رشد (مثل پیش از لقاح و در سلولهای بنیادی جنینی)، بیشتر نشانههای اپیژنتیکی پاکسازی و بازتنظیم میشوند تا ژنوم آماده شود.
-
این بازبرنامهریزی باعث میشود که اکثر نشانههای اپیژنتیکی که از والدین میآیند از بین بروند، اما برخی نشانهها (مانند ژنهای "imprinted") میتوانند از این پاکسازی فرار کنند و حفظ شوند.
8.3 حافظه اپیژنتیکی (Epigenetic Memory)
-
برخی سلولها میتوانند نشانههای اپیژنتیکی را حفظ کرده و به سلولهای دختر منتقل کنند، که این امر به آنها کمک میکند تا هویت سلولی و برنامه عملکردی خود را حفظ کنند.
-
مثال: سلولهای ایمنی که پس از یک عفونت، حافظه اپیژنتیکی ایجاد میکنند تا پاسخ سریعتر و مؤثرتری در مواجهه مجدد با عامل بیماریزا داشته باشند.
9. ابزارها و تکنیکهای مطالعه اپیژنتیک
برای درک دقیق مکانیزمهای اپیژنتیکی و نقش آنها در تنظیم ژنها، دانشمندان از تکنیکهای متنوعی استفاده میکنند که امکان شناسایی و تحلیل تغییرات اپیژنتیکی در سطح مولکولی را فراهم میکنند. در این بخش، مهمترین روشها و ابزارهای پژوهشی اپیژنتیک را بررسی میکنیم.
9.1 توالییابی بایسولفیت (Bisulfite Sequencing)
-
هدف: شناسایی و نقشهبرداری دقیق متیلاسیون DNA.
-
روش کار: در این روش، DNA با سدیم بایسولفیت تیمار میشود که باعث تبدیل سیتوزینهای غیرمتیله به اوراسیل میشود، در حالی که سیتوزینهای متیله دستنخورده باقی میمانند. سپس DNA تیمار شده توالییابی میشود و با مقایسه آن با توالی اصلی، محلهای متیلاسیون مشخص میشوند.
-
کاربرد: این روش دقیقترین و استاندارد طلایی برای مطالعه متیلاسیون DNA است و در تحقیقات بیماریها، توسعه دارو و اپیژنتیک تک سلولی کاربرد دارد.
9.2 توالییابی ایمنیرسوب کروماتین (ChIP-Seq)
-
هدف: تعیین مکانهای اتصال پروتئینهای خاص به DNA، مانند هیستونهای اصلاح شده یا فاکتورهای رونویسی.
-
روش کار: ابتدا پروتئینهای متصل به DNA در سلولها تثبیت (Crosslink) میشوند. سپس DNA به قطعات کوچک شکسته میشود و با استفاده از آنتیبادیهای خاص پروتئین مورد نظر، این بخشها جدا میشوند (ایمنیرسوب). نهایتاً این DNA جدا شده توالییابی میشود تا محلهای اتصال پروتئینها مشخص گردد.
-
کاربرد: شناسایی الگوهای اصلاح هیستون، فاکتورهای رونویسی و مکانهای فعال یا غیرفعال ژنها.
9.3 توالییابی دسترسی کروماتین (ATAC-Seq)
-
هدف: شناسایی مناطق باز و در دسترس کروماتین که امکان اتصال فاکتورهای رونویسی را دارند.
-
روش کار: آنزیم ترانسپوزاز به DNA نفوذ میکند و بخشهای باز کروماتین را برش میدهد و نشانهگذاری میکند. سپس این بخشها توالییابی میشوند.
-
کاربرد: تعیین ساختار کروماتین و مناطق فعال ژنی، مطالعه دینامیک کروماتین در شرایط مختلف.
9.4 توالییابی RNA و پروفایلینگ miRNA (RNA-Seq)
-
هدف: تحلیل بیان ژنها و RNAهای غیرکدکننده مانند miRNAها.
-
روش کار: RNA استخراج شده و تبدیل به cDNA میشود، سپس توالییابی میشود. دادهها برای تعیین میزان بیان ژنها و RNAهای کوچک پردازش میشوند.
-
کاربرد: بررسی تأثیرات اپیژنتیکی بر بیان ژن، شناسایی RNAهای تنظیمکننده اپیژنتیکی.
9.5 ویرایش اپیژنتیکی با CRISPR (CRISPR-based Epigenetic Editing)
-
هدف: ایجاد تغییرات اپیژنتیکی هدفمند بدون تغییر در توالی DNA.
-
روش کار: استفاده از سیستم CRISPR-Cas9 غیرکاتالیزور (dCas9) متصل به آنزیمهای اصلاحکننده اپیژنتیکی (مثل متیلازها یا استیل ترانسفرازها) برای هدفگیری دقیق مناطق خاص ژنومی و تغییر نشانههای اپیژنتیکی.
-
کاربرد: مطالعه عملکرد ژنها، درمان بیماریهای ناشی از اختلالات اپیژنتیکی، توسعه درمانهای ژنتیکی پیشرفته.
10. کاربردهای اپیژنتیک
اپیژنتیک با درک چگونگی تنظیم بیان ژنها بدون تغییر در توالی DNA، دریچههای نوینی را در علوم زیستی و پزشکی باز کرده است. کاربردهای گسترده و متنوعی دارد که در این بخش به مهمترین آنها میپردازیم.
10.1 پزشکی دقیق (Precision Medicine)
-
تعریف: پزشکی دقیق به معنای طراحی درمانها و داروها بر اساس ویژگیهای ژنتیکی و اپیژنتیکی هر فرد است.
-
نقش اپیژنتیک: مطالعه الگوهای اپیژنتیکی میتواند کمک کند تا حساسیت بیماران به داروها مشخص شود، پیشآگهی بیماریها بهتر پیشبینی شود و درمانهای هدفمندتر و مؤثرتری توسعه یابد.
-
مثال: در سرطان، پروفایل متیلاسیون DNA و تغییرات هیستونی میتواند نوع سرطان و پاسخ به داروها را مشخص کند.
10.2 بیومارکرهای اپیژنتیکی (Epigenetic Biomarkers)
-
تعریف: نشانگرهای مولکولی که بر اساس تغییرات اپیژنتیکی شناسایی میشوند و برای تشخیص، پیشآگهی و پیگیری بیماریها کاربرد دارند.
-
کاربردها: تشخیص زودهنگام سرطان، ارزیابی پاسخ به درمان، و تعیین خطر ابتلا به بیماریهای مزمن.
-
مثال: متیلاسیون ژن MLH1 در سرطان کولورکتال به عنوان بیومارکر مهم استفاده میشود.
10.3 هدفهای درمانی (Therapeutic Targets)
-
داروهای اپیژنتیکی: داروهایی که بر آنزیمهای تغییر دهنده اپیژنتیک (مثل DNMTها و HDACها) تأثیر میگذارند.
-
کاربرد: درمان سرطانها، اختلالات عصبی، بیماریهای التهابی و دیگر بیماریها.
-
مثال: داروهای مهارکننده HDAC در درمان لنفوم و برخی سرطانها استفاده میشوند.
10.4 کشاورزی و بهبود محصولات زراعی
-
تعریف: استفاده از دانش اپیژنتیک برای افزایش مقاومت گیاهان به شرایط محیطی، بهبود کیفیت محصولات و افزایش بهرهوری.
-
روشها: تنظیم اپیژنتیکی ژنهای مقاومت به خشکی، شوری، آفات و بیماریها.
-
مثال: گیاهانی که از طریق اپیژنتیک بهبود یافتهاند، مقاومت بیشتری به تنشهای محیطی نشان میدهند بدون تغییر در DNA اصلی.
10.5 اپیژنتیک در تکامل و سازگاری
-
نقش: اپیژنتیک میتواند پاسخهای سریع به تغییرات محیطی ایجاد کند و به عنوان مکانیسمی برای سازگاری و تکامل غیرژنتیکی عمل کند.
-
مثال: تغییرات اپیژنتیکی که در نسلهای متوالی منتقل میشوند، باعث تطبیق سریعتر ارگانیسمها با محیط میشوند.