کلونینگ چیست
فهرست مطالب:
-
مقدمه
-
همسانهسازی چیست؟
-
همسانهسازی DNA
-
اهداف همسانهسازی DNA
-
روشهای همسانهسازی DNA
-
ترانسفورم کردن – جذب DNA توسط سلولهای باکتری
-
تهیه سلولهای باکتریایی مستعد
-
انتخاب سلولهای ترانسفورم شده
-
شناسایی نوترکیبها
-
انتخاب نوترکیبها با غیرفعالسازی درجی ژن مقاومت به آنتیبیوتیک در ناقل pBR322
-
انتخاب نوترکیبها با غیرفعالسازی درجی ژن lacZ
-
ترانسفورم کردن سلولهای غیرباکتریایی
-
ترانسفورم کردن سلولهای منفرد
-
واکنش زنجیرهای پلیمراز (PCR)
فصل اول: مقدمه همسانهسازی DNA یکی از پیشرفتهای بنیادی زیستفناوری نوین است که امکان بررسی، دستکاری، و استفاده از اطلاعات ژنتیکی را فراهم میسازد. با استفاده از این فناوری، میتوان ژنهای خاص را جداسازی، تکثیر و وارد میزبانهای مختلف نمود تا هم برای مقاصد پژوهشی و هم کاربردی مورد استفاده قرار گیرد. در این مقاله، قصد داریم یک بررسی جامع و عمیق از کلیه جنبههای مرتبط با همسانهسازی DNA را ارائه دهیم.
فصل دوم: همسانهسازی چیست؟ همسانهسازی در زیستفناوری به فرآیندی اطلاق میشود که در آن نسخههای دقیق و یکسانی از ماده ژنتیکی (معمولاً DNA) تولید میشود. این فرایند میتواند بهصورت طبیعی (مثلاً در دوقلوهای همسان یا همانندسازی DNA) یا بهصورت مصنوعی در آزمایشگاه انجام گیرد.
فصل سوم: همسانهسازی DNA همسانهسازی DNA به تکنیکی اطلاق میشود که در آن یک قطعه خاص از DNA استخراج و درون یک ناقل مناسب (مانند پلاسمیدها) وارد میشود و سپس به کمک یک میزبان زنده (مانند باکتریها) تکثیر میشود. هدف نهایی تولید مقادیر زیادی از یک ژن یا قطعه DNA برای مطالعه بیشتر یا تولید محصول ژنتیکی خاص است.
فصل چهارم: اهداف همسانهسازی DNA
-
بررسی ساختار و عملکرد ژنها
-
تولید پروتئینهای نوترکیب مانند انسولین انسانی
-
ایجاد ارگانیسمهای تراریخته
-
مطالعات ژنتیکی، ژندرمانی، و داروسازی
-
بررسی جهشهای ژنتیکی در بیماریها
فصل پنجم: روشهای همسانهسازی DNA
روشهای همسانهسازی DNA شامل مراحلی است که از استخراج DNA مورد نظر آغاز شده و با واردسازی آن به یک سلول میزبان بهمنظور تکثیر، بیان یا ذخیرهسازی ژن ادامه مییابد. در ادامه، گامبهگام به تشریح کامل این روشها میپردازیم.
1. استخراج و خالصسازی DNA هدف
برای شروع همسانهسازی، ابتدا باید DNA هدف از منبع ژنتیکی استخراج شود. این منبع میتواند یک سلول انسانی، گیاهی، حیوانی یا میکروبی باشد. روشهای متداول برای استخراج DNA عبارتند از:
-
لیز سلول با استفاده از شویندهها یا آنزیمها مانند SDS و پروتئیناز K.
-
خالصسازی از طریق استخراج فنول-کلروفرم یا کیتهای ستونی مبتنی بر سیلیکا.
-
رسوبدهی DNA با استفاده از الکل (اتانول یا ایزوپروپانول).
2. برش DNA با آنزیمهای محدودکننده (Restriction Enzymes)
پس از تهیه DNA، قطعه مورد نظر با آنزیمهای محدودکننده خاص بریده میشود. این آنزیمها توالیهای خاصی از DNA را شناسایی کرده و در آنجا برش ایجاد میکنند. برش ممکن است دارای انتهای چسبنده (Sticky Ends) یا صاف (Blunt Ends) باشد.
3. انتخاب ناقل (Vector)
ناقلها مولکولهای DNA هستند که قادرند قطعه DNA هدف را حمل کنند. مهمترین ویژگیهای ناقل مناسب:
-
وجود جایگاههای منحصر بهفرد برای آنزیمهای محدودکننده
-
داشتن ژنهای انتخابگر (مانند مقاومت به آنتیبیوتیک)
-
توانایی تکثیر مستقل در میزبان (وجود مبدا همانندسازی)
انواع رایج ناقلها:
-
پلاسمیدها: پرکاربردترین نوع در باکتریها
-
فاژها: مناسب برای همسانهسازی قطعات بزرگتر
-
کاسمیدها و BACs (کروموزومهای مصنوعی باکتریایی)
4. الحاق DNA هدف به ناقل
این مرحله با استفاده از آنزیم لیگاز انجام میشود:
-
DNA لیگاز پیوند فسفودیاستر بین انتهای 3' و 5' قطعات DNA را ایجاد میکند.
-
در صورت وجود انتهای چسبنده مکمل، الحاق بهصورت اختصاصی و با بازده بالا انجام میشود.
5. انتقال نوترکیب به سلول میزبان (Transformation)
DNA نوترکیب باید وارد یک سلول زنده شود. متداولترین میزبان، باکتری E. coli است.
روشهای انتقال:
-
روش شیمیایی با CaCl₂: سلولها را مستعد کرده و با شوک حرارتی DNA را جذب میکنند.
-
الکتروپوریشن: استفاده از پالس الکتریکی برای نفوذ DNA به درون سلول.
فصل پنجم: روشهای همسانهسازی DNA
روشهای همسانهسازی DNA شامل مراحلی است که از استخراج DNA مورد نظر آغاز شده و با واردسازی آن به یک سلول میزبان بهمنظور تکثیر، بیان یا ذخیرهسازی ژن ادامه مییابد. در ادامه، گامبهگام به تشریح کامل این روشها میپردازیم.
1. استخراج و خالصسازی DNA هدف
برای شروع همسانهسازی، ابتدا باید DNA هدف از منبع ژنتیکی استخراج شود. این منبع میتواند یک سلول انسانی، گیاهی، حیوانی یا میکروبی باشد. روشهای متداول برای استخراج DNA عبارتند از:
-
لیز سلول با استفاده از شویندهها یا آنزیمها مانند SDS و پروتئیناز K.
-
خالصسازی از طریق استخراج فنول-کلروفرم یا کیتهای ستونی مبتنی بر سیلیکا.
-
رسوبدهی DNA با استفاده از الکل (اتانول یا ایزوپروپانول).
2. برش DNA با آنزیمهای محدودکننده (Restriction Enzymes)
پس از تهیه DNA، قطعه مورد نظر با آنزیمهای محدودکننده خاص بریده میشود. این آنزیمها توالیهای خاصی از DNA را شناسایی کرده و در آنجا برش ایجاد میکنند. برش ممکن است دارای انتهای چسبنده (Sticky Ends) یا صاف (Blunt Ends) باشد.
3. انتخاب ناقل (Vector)
ناقلها مولکولهای DNA هستند که قادرند قطعه DNA هدف را حمل کنند. مهمترین ویژگیهای ناقل مناسب:
-
وجود جایگاههای منحصر بهفرد برای آنزیمهای محدودکننده
-
داشتن ژنهای انتخابگر (مانند مقاومت به آنتیبیوتیک)
-
توانایی تکثیر مستقل در میزبان (وجود مبدا همانندسازی)
انواع رایج ناقلها:
-
پلاسمیدها: پرکاربردترین نوع در باکتریها
-
فاژها: مناسب برای همسانهسازی قطعات بزرگتر
-
کاسمیدها و BACs (کروموزومهای مصنوعی باکتریایی)
4. الحاق DNA هدف به ناقل
این مرحله با استفاده از آنزیم لیگاز انجام میشود:
-
DNA لیگاز پیوند فسفودیاستر بین انتهای 3' و 5' قطعات DNA را ایجاد میکند.
-
در صورت وجود انتهای چسبنده مکمل، الحاق بهصورت اختصاصی و با بازده بالا انجام میشود.
5. انتقال نوترکیب به سلول میزبان (Transformation)
DNA نوترکیب باید وارد یک سلول زنده شود. متداولترین میزبان، باکتری E. coli است.
روشهای انتقال:
-
روش شیمیایی با CaCl₂: سلولها را مستعد کرده و با شوک حرارتی DNA را جذب میکنند.
-
الکتروپوریشن: استفاده از پالس الکتریکی برای نفوذ DNA به درون سلول.
فصل ششم: ترانسفورم کردن – جذب DNA توسط سلولهای باکتری
فرآیند ترانسفورمیشن به معنای جذب DNA خارجی توسط سلولهای باکتری و وارد کردن آن به درون سلول جهت تکثیر یا بیان است. این مرحله از کلونینگ بسیار حیاتی است زیرا تضمین میکند که مولکول DNA نوترکیب وارد سلول میزبان شده و قادر به تکثیر خواهد بود.
1. آمادهسازی سلولهای باکتری برای ترانسفورمیشن
سلولهای باکتری بهطور طبیعی توانایی پذیرش DNA خارجی را ندارند. بنابراین باید با روشهای خاصی "مستعد" شوند:
الف) روش شیمیایی (کلسیم کلرید - CaCl₂):
-
سلولها را در محلول CaCl₂ نگهداری میکنند تا دیواره سلولی نفوذپذیر شود.
-
سپس DNA به سلول اضافه شده و با استفاده از "شوک حرارتی" (Heat Shock) در دمای 42 درجه سانتیگراد، DNA وارد سلول میشود.
ب) الکتروپوریشن (Electroporation):
-
با استفاده از جریان الکتریکی گذرا، حفرههایی در غشای سلول ایجاد میشود که به DNA اجازه ورود میدهد.
-
این روش بازده بالاتری دارد ولی نیاز به دستگاه الکتروپوراتور دارد.
2. فاکتورهای مؤثر بر موفقیت ترانسفورمیشن
-
کیفیت DNA: خالص بودن و تمرکز مناسب DNA نوترکیب اهمیت زیادی دارد.
-
مرحله رشد سلول: سلولها باید در فاز رشد لگاریتمی باشند (OD600 حدود 0.4 تا 0.6).
-
دمای شوک حرارتی و زمان آن: معمولاً دمای 42 درجه برای 30 تا 90 ثانیه مناسب است.
3. نگهداری و بازیابی سلولهای ترانسفورم شده
پس از وارد شدن DNA به سلول:
-
سلولها در محیط بدون آنتیبیوتیک برای 30-60 دقیقه گرمخانهگذاری میشوند تا زمان لازم برای بیان ژن مقاومت فراهم شود.
-
سپس روی محیط کشت حاوی آنتیبیوتیک مناسب کشت داده میشوند تا فقط کلونیهای حاوی ناقل زنده بمانند.
در فصل بعد، به بررسی نحوه انتخاب کلونیهای ترانسفورم شده، تشخیص نوترکیبها و غربالگری کلونیهای موفق خواهیم پرداخت.
فصل هفتم: انتخاب سلولهای ترانسفورم شده
پس از انجام ترانسفورمیشن، باید سلولهایی را که واقعاً DNA نوترکیب را جذب کردهاند از سلولهایی که این کار را نکردهاند تمایز داد. برای این منظور از نشانگرهای انتخابی استفاده میشود.
1. استفاده از آنتیبیوتیکها
ناقلهای مهندسی شده حاوی ژن مقاومت به آنتیبیوتیک (مانند آمپیسیلین) هستند. تنها سلولهایی که ناقل را دریافت کردهاند، قادر به رشد در محیط حاوی آنتیبیوتیک خواهند بود.
2. غربالگری بر اساس ژن گزارشگر (Reporter Gene)
بهمنظور تشخیص سلولهایی که حاوی DNA هدف واقعی (نوترکیب) هستند، از روشهای خاصی استفاده میشود که در فصلهای آینده به تفصیل شرح داده خواهد شد.
فصل هشتم: شناسایی نوترکیبها
شناسایی کلونیهای حاوی DNA نوترکیب، مرحلهای کلیدی در همسانهسازی مولکولی است. چرا که ترانسفورمیشن ممکن است منجر به ورود ناقل بدون DNA هدف به داخل سلول شود. در این فصل، روشهای اصلی شناسایی کلونیهای نوترکیب را بررسی میکنیم.
1. بررسی حضور درج ژن از طریق PCR
یکی از روشهای دقیق برای شناسایی نوترکیبها استفاده از واکنش زنجیرهای پلیمراز (PCR) است:
-
نمونهای از کلنی روی محیط کشت گرفته میشود.
-
از آن برای انجام PCR با استفاده از آغازگرهای اختصاصی برای ژن درجشده استفاده میشود.
-
مشاهده باند PCR با اندازه مناسب در ژل الکتروفورز نشاندهنده حضور ژن هدف است.
2. آزمون آنزیمی با ژن lacZ (آبی/سفید)
در برخی ناقلها مانند pUC19، یک ژن گزارشگر بهنام lacZ وجود دارد که در صورت درج موفق ژن هدف، غیرفعال میشود:
-
کلنیهای دارای ناقل بدون درج (غیرفعال نشده) در محیط حاوی X-gal آبیرنگ میشوند.
-
کلنیهای حاوی درج موفق (غیرفعال شدن lacZ) سفید باقی میمانند.
3. آنالیز آنزیمهای محدودکننده
-
استخراج پلاسمید از کلونیها
-
هضم آن با آنزیمهای محدودکننده خاص
-
بررسی الگوهای قطعات در ژل الکتروفورز
فصل هفتم: انتخاب سلولهای ترانسفورم شده
پس از انجام ترانسفورمیشن، باید سلولهایی را که واقعاً DNA نوترکیب را جذب کردهاند از سلولهایی که این کار را نکردهاند تمایز داد. برای این منظور از نشانگرهای انتخابی استفاده میشود.
1. استفاده از آنتیبیوتیکها
ناقلهای مهندسی شده حاوی ژن مقاومت به آنتیبیوتیک (مانند آمپیسیلین) هستند. تنها سلولهایی که ناقل را دریافت کردهاند، قادر به رشد در محیط حاوی آنتیبیوتیک خواهند بود.
2. غربالگری بر اساس ژن گزارشگر (Reporter Gene)
بهمنظور تشخیص سلولهایی که حاوی DNA هدف واقعی (نوترکیب) هستند، از روشهای خاصی استفاده میشود که در فصلهای آینده به تفصیل شرح داده خواهد شد.
فصل هشتم: شناسایی نوترکیبها
شناسایی کلونیهای حاوی DNA نوترکیب، مرحلهای کلیدی در همسانهسازی مولکولی است. چرا که ترانسفورمیشن ممکن است منجر به ورود ناقل بدون DNA هدف به داخل سلول شود. در این فصل، روشهای اصلی شناسایی کلونیهای نوترکیب را بررسی میکنیم.
1. بررسی حضور درج ژن از طریق PCR
یکی از روشهای دقیق برای شناسایی نوترکیبها استفاده از واکنش زنجیرهای پلیمراز (PCR) است:
-
نمونهای از کلنی روی محیط کشت گرفته میشود.
-
از آن برای انجام PCR با استفاده از آغازگرهای اختصاصی برای ژن درجشده استفاده میشود.
-
مشاهده باند PCR با اندازه مناسب در ژل الکتروفورز نشاندهنده حضور ژن هدف است.
2. آزمون آنزیمی با ژن lacZ (آبی/سفید)
در برخی ناقلها مانند pUC19، یک ژن گزارشگر بهنام lacZ وجود دارد که در صورت درج موفق ژن هدف، غیرفعال میشود:
-
کلنیهای دارای ناقل بدون درج (غیرفعال نشده) در محیط حاوی X-gal آبیرنگ میشوند.
-
کلنیهای حاوی درج موفق (غیرفعال شدن lacZ) سفید باقی میمانند.
3. آنالیز آنزیمهای محدودکننده
-
استخراج پلاسمید از کلونیها
-
هضم آن با آنزیمهای محدودکننده خاص
-
بررسی الگوهای قطعات در ژل الکتروفورز
1. بررسی حضور درج ژن از طریق PCR
یکی از روشهای دقیق برای شناسایی نوترکیبها استفاده از واکنش زنجیرهای پلیمراز (PCR) است:
-
نمونهای از کلنی روی محیط کشت گرفته میشود.
-
از آن برای انجام PCR با استفاده از آغازگرهای اختصاصی برای ژن درجشده استفاده میشود.
-
مشاهده باند PCR با اندازه مناسب در ژل الکتروفورز نشاندهنده حضور ژن هدف است.
2. آزمون آنزیمی با ژن lacZ (آبی/سفید)
در برخی ناقلها مانند pUC19، یک ژن گزارشگر بهنام lacZ وجود دارد که در صورت درج موفق ژن هدف، غیرفعال میشود:
-
کلنیهای دارای ناقل بدون درج (غیرفعال نشده) در محیط حاوی X-gal آبیرنگ میشوند.
-
کلنیهای حاوی درج موفق (غیرفعال شدن lacZ) سفید باقی میمانند.
3. آنالیز آنزیمهای محدودکننده
-
استخراج پلاسمید از کلونیها
-
هضم آن با آنزیمهای محدودکننده خاص
-
بررسی الگوهای قطعات در ژل الکتروفورز
4. توالییابی (Sequencing)
دقیقترین روش تایید درج صحیح و جهتیابی ژن هدف، توالییابی پلاسمید استخراجشده است.
فصل نهم: انتخاب نوترکیبها با غیرفعالسازی درجی یک ژن مقاومت به آنتیبیوتیک در ناقل pBR322
ناقل pBR322 یکی از معروفترین پلاسمیدهای مورد استفاده در زیستشناسی مولکولی است که دارای دو ژن مقاومت به آنتیبیوتیک است: آمپیسیلین (ampR) و تتراسایکلین (tetR).
روش انتخاب بر پایه غیرفعالسازی درجی:
-
محل درج DNA هدف در ناحیهای است که ژن تتراسایکلین را غیرفعال میکند.
-
سلولهایی که DNA هدف را در این ناحیه دریافت کردهاند، توانایی مقاومت به تتراسایکلین را از دست میدهند، اما همچنان به آمپیسیلین مقاوم هستند.
مراحل انتخاب:
-
سلولهای ترانسفورمشده را ابتدا روی محیط حاوی آمپیسیلین کشت میدهند. تنها سلولهایی که پلاسمید را گرفتهاند رشد میکنند.
-
سپس از این کلونیها در محیط حاوی تتراسایکلین نیز کشت داده میشود.
کلونیهایی که در محیط آمپیسیلین رشد کرده اما در محیط تتراسایکلین رشد نمیکنند، احتمالاً حاوی درج موفق ژن هدف هستند.
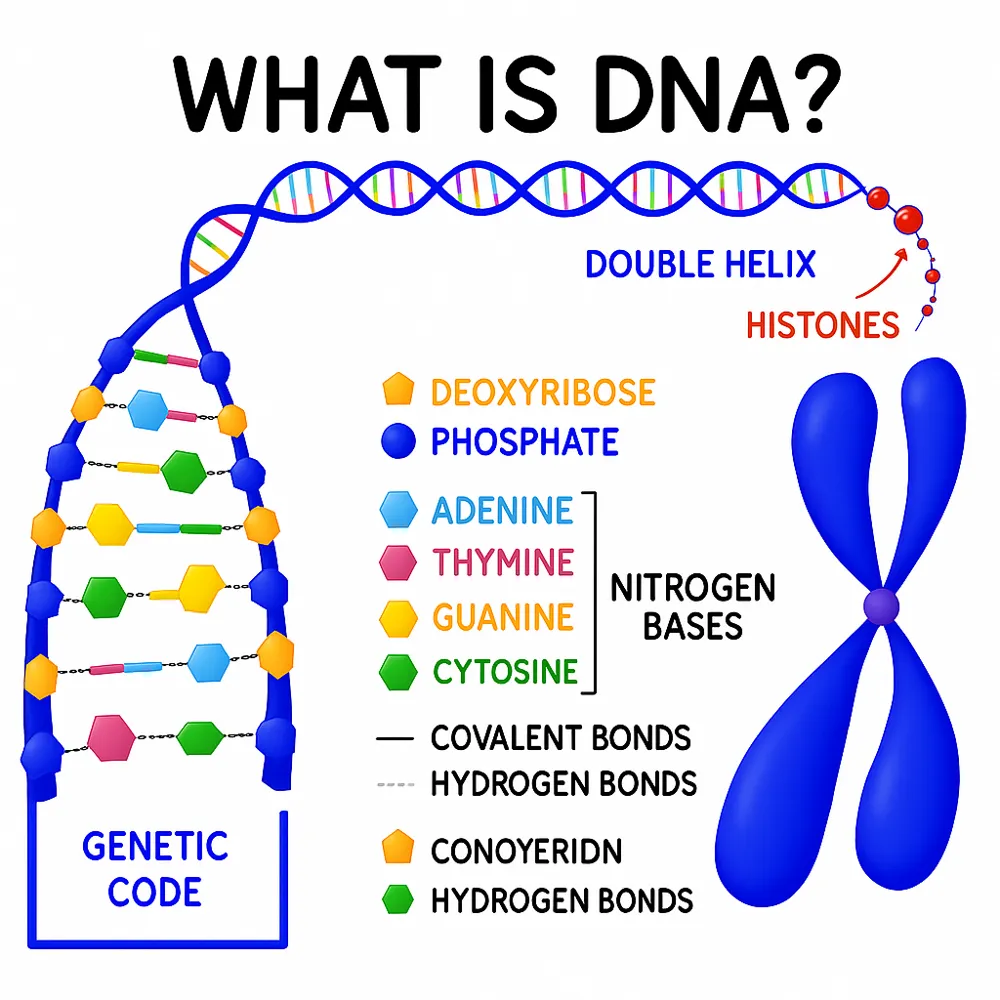
کلونها موجوداتی هستند که نسخههای ژنتیکی کاملاً یکسانی از یکدیگرند. هر ذرهای از DNA آنها با یکدیگر یکسان است.
کلونها میتوانند بهطور طبیعی بهوجود آیند—دوقلوهای همسان یکی از مثالهای رایج آن هستند. یا میتوان آنها را در آزمایشگاه ایجاد کرد. در ادامه، میخوانید که دوقلوهای همسان طبیعی چه شباهتها و تفاوتهایی با کلونهایی دارند که از طریق فناوریهای مدرن همسانهسازی ایجاد میشوند.
چگونه همسانهسازی (کلونسازی) انجام میشود؟
بسیاری از مردم برای نخستین بار زمانی با مفهوم کلونسازی آشنا شدند که «دالی»—یک گوسفند همسانهشده—در سال ۱۹۹۷ معرفی شد. اما فناوریهای مصنوعی همسانهسازی مدتها پیش از دالی وجود داشتهاند.
دو روش برای ایجاد نسخه ژنتیکی کاملاً یکسان از یک موجود زنده در آزمایشگاه وجود دارد:
-
دوقلوزایی مصنوعی جنین (Artificial Embryo Twinning)
-
انتقال هسته سلول سوماتیک (Somatic Cell Nuclear Transfer یا SCNT)
1. دوقلوزایی مصنوعی جنین
دوقلوزایی مصنوعی یک روش نسبتاً ساده و کمفناوری برای ساخت کلون است. همانطور که از نامش پیداست، این روش تقلیدی از فرآیند طبیعی دوقلوزایی همسان است.
در طبیعت، دوقلوهای همسان در مراحل اولیه رشد جنین زمانی ایجاد میشوند که جنین به دو قسمت تقسیم میشود. این اتفاق در نخستین روزهای پس از پیوستن تخمک و اسپرم رخ میدهد، زمانی که جنین تنها از چند سلول تمایز نیافته تشکیل شده است. هر نیمه از جنین بهطور مستقل به تقسیم ادامه میدهد و در نهایت به یک فرد کامل و مستقل تبدیل میشود. چون این افراد از یک تخمک بارورشده مشترک بهوجود آمدهاند، ژنتیکی کاملاً یکسان دارند.
در روش دوقلوزایی مصنوعی نیز همین روند طی میشود، اما در محیط آزمایشگاهی (داخل پتری دیش) بهجای درون بدن مادر انجام میگیرد. یک جنین در مرحله بسیار ابتدایی به سلولهای منفرد تقسیم میشود و این سلولها برای مدتی در محیط پتری دیش رشد داده میشوند. سپس این جنینها در رحم مادر جایگزین کاشته میشوند تا به رشد خود ادامه دهند. چون همه این جنینها از یک تخمک بارورشده مشترک بهدست آمدهاند، ژنتیکی کاملاً یکسان خواهند بود.
2. انتقال هسته سلول سوماتیک (SCNT)
انتقال هسته سلول سوماتیک (SCNT) که به آن انتقال هسته نیز گفته میشود، از روشی متفاوت نسبت به دوقلوزایی مصنوعی استفاده میکند، اما نتیجه نهایی همان است: نسخه ژنتیکی کاملاً یکسان یا همان کلون از یک فرد خاص. این همان روشی است که برای ایجاد گوسفند دالی بهکار گرفته شد.
اصطلاح SCNT شامل سه بخش است:
-
سلول سوماتیک (Somatic Cell): سلولهای بدن بهجز سلولهای تولیدمثلی (اسپرم و تخمک) را سلول سوماتیک مینامند. این سلولها دارای دو مجموعه کامل از کروموزومها هستند، در حالی که سلولهای جنسی (گِرمسلها) فقط یک مجموعه دارند.
-
هسته (Nuclear): هسته بخشی از سلول است که DNA را در خود نگه میدارد. DNA به صورت بستههایی به نام کروموزوم قرار دارد و شامل تمامی اطلاعات مورد نیاز برای ساخت یک موجود زنده است. تفاوتهای کوچک در DNA ما باعث منحصربهفرد بودن هر فرد میشود.
-
انتقال (Transfer): به معنای جابهجایی یک شیء از جایی به جای دیگر است. برای ساخت دالی، پژوهشگران ابتدا یک سلول سوماتیک از بدن یک گوسفند بالغ ماده جدا کردند. سپس هسته و کل DNA را از یک سلول تخمک خارج کردند. سپس هسته سلول سوماتیک را به تخمک بدون هسته منتقل کردند. با چند تحریک شیمیایی، این سلول شروع به رفتار شبیه به یک تخمک تازه بارورشده کرد. این سلول به یک جنین تبدیل شد، به رحم یک مادر جایگزین منتقل شد و تا زمان تولد در آنجا رشد یافت. (مرحله انتقال معمولاً با استفاده از جریان الکتریکی برای جوشدادن غشاهای سلولها انجام میشود.)
برهای که به دنیا آمد، «دالی»، نسخه ژنتیکی کاملاً یکسانی از همان گوسفند بالغی بود که سلول سوماتیک را اهدا کرده بود. دالی اولین پستانداری بود که از یک سلول سوماتیک بالغ کلونسازی شده بود.
تفاوت SCNT با لقاح طبیعی در تشکیل جنین چیست؟
لقاح طبیعی، که در آن تخمک و اسپرم به هم میپیوندند، و SCNT هر دو یک نتیجه دارند: یک توپ سلولی در حال تقسیم بهنام جنین. اما تفاوت اصلی این دو روش در منبع کروموزومهاست.
در لقاح طبیعی، هر یک از اسپرم و تخمک دارای یک مجموعه کروموزوم هستند. زمانی که بههم میپیوندند، جنینی با دو مجموعه کروموزومی شکل میگیرد—یکی از پدر (اسپرم) و یکی از مادر (تخمک).
در SCNT، مجموعه کروموزومی تکتایی تخمک خارج میشود و با هستهای از سلول سوماتیک جایگزین میشود که خودش دارای دو مجموعه کامل کروموزوم است. بنابراین، جنینی که از این روش ایجاد میشود، هر دو مجموعه کروموزوم خود را تنها از سلول سوماتیک دریافت میکند.
آیا کلون کردن یک موجود زنده با کلون کردن یک ژن یکسان است؟
شاید شنیده باشید که پژوهشگران ژنهایی را که مسئول بیماریهای مختلف یا صفات خاص هستند "کلون" کردهاند. تفاوت این موضوع با کلونسازی یک موجود چیست؟
وقتی دانشمندان یک موجود زنده را کلون میکنند، همانطور که در بالا شرح داده شد، نسخه ژنتیکی کاملاً یکسانی از کل بدن موجود زنده ایجاد میکنند.
اما وقتی دانشمندان یک ژن را کلون میکنند، فقط یک ژن خاص از موجود را جداسازی کرده و نسخههای دقیقی از آن ژن خاص تولید میکنند. کلون کردن ژن معمولاً شامل کپیکردن توالی DNA آن ژن درون یک قطعه کوچکتر و قابل کنترلتر از DNA مانند پلاسمید است. این فرآیند امکان بررسی و مطالعه عملکرد دقیق آن ژن خاص در آزمایشگاه را فراهم میسازد.
کلونینگ فرآیند تولید موجوداتی با ژنومهای کاملاً یکسان است که میتواند بهصورت طبیعی یا مصنوعی انجام شود. در طبیعت، برخی موجودات از طریق تولیدمثل غیرجنسی کلون تولید میکنند. این نوع تولیدمثل بدون جفت، «باکرهزایی» یا parthenogenesis نام دارد. در حوزهٔ زیستفناوری، کلونینگ شامل ساخت نسخههای همسان از سلولها و قطعات DNA است.
کلونینگ مصنوعی موجودات، که گاه «کلونسازی تولیدمثلی» نیز نامیده میشود، اغلب با استفاده از روش انتقال هستهٔ سلول سوماتیک (SCNT) انجام میشود. در این روش، یک جنین زندهقابلیت از ترکیب یک سلول سوماتیک و یک سلول تخمک تولید میشود. در سال ۱۹۹۶، گوسفند دالی به شهرت جهانی رسید چرا که نخستین پستاندار کلونشده از سلول سوماتیک بود. نوع دیگر کلونینگ مصنوعی، کلونینگ مولکولی است که در زیستشناسی مولکولی استفاده میشود و طی آن از یک سلول زنده برای تولید جمعیتی بزرگ از سلولها با DNAهای یکسان استفاده میشود.
در اخلاق زیستی، دیدگاههای گوناگونی دربارهٔ کلونینگ وجود دارد. استفاده از سلولهای بنیادی جنینی (که میتوان آنها را از طریق SCNT تولید کرد) در برخی پژوهشهای سلول بنیادی مناقشهبرانگیز بوده است. همچنین کلونینگ بهعنوان روشی برای احیای گونههای منقرضشده پیشنهاد شده است. در فرهنگ عامه، مفهوم کلونینگ – بهویژه کلونینگ انسانی – اغلب در داستانهای علمیتخیلی مطرح میشود و معمولاً به موضوعاتی مانند هویت، بازسازی شخصیتهای تاریخی یا گونههای منقرضشده، یا سوءاستفاده از کلونها (مثلاً ساخت سرباز برای جنگ) میپردازد.
ریشهشناسی واژهٔ کلون
واژهٔ «کلون» (Clone) نخستین بار توسط «هربرت جی. وبر» ابداع شد و ریشه در واژهٔ یونانی باستانی κλών (klōn) بهمعنای «شاخه» دارد؛ زیرا در گیاهشناسی، تولید گیاه جدید از یک شاخه، نمونهای از کلونسازی است. در گذشته در گیاهشناسی واژهٔ «lusus» و در باغبانی واژهٔ «clon» رایج بود. در قرن بیستم حرف «e» به انتهای واژه افزوده شد تا تلفظ آن بهصورت o کشیده (long o) مشخص شود. امروزه تنها شکل «clone» در زبان عمومی رایج است.
کلونسازی طبیعی
کلونسازی طبیعی، تولید کلونها بدون مداخلهٔ مهندسی ژنتیک یا دخالت انسان است. این نوع کلونینگ از طریق سازوکارهای طبیعی در ارگانیسمهای تکسلولی تا چندسلولی رخ میدهد و به بقای حیات در میلیونها سال گذشته کمک کرده است. این روش در گیاهان، قارچها و باکتریها رایج است و کلونیهای کلونال نیز بههمین روش تولیدمثل میکنند. مکانیسمهایی مانند تقسیم دوتایی (binary fission)، جوانهزنی (budding)، قطعهقطعه شدن (fragmentation) و باکرهزایی (parthenogenesis) از جمله مکانیسمهای طبیعی کلونینگ هستند.
برخی گیاهان شناختهشده برای توانایی کلونینگ طبیعی عبارتاند از:
-
درختان بلوبری (blueberry)
-
فندق (Hazel)
-
درختان پاندو (Pando trees)
-
درخت کنتاکی کافیتری
-
گیاه Myrica
-
درخت آمریکایی sweetgum
کلونینگ طبیعی بهصورت تصادفی نیز رخ میدهد، مانند دوقلوهای همسان که از تقسیم یک تخمک بارور شده حاصل میشوند و DNA کاملاً یکسانی دارند.
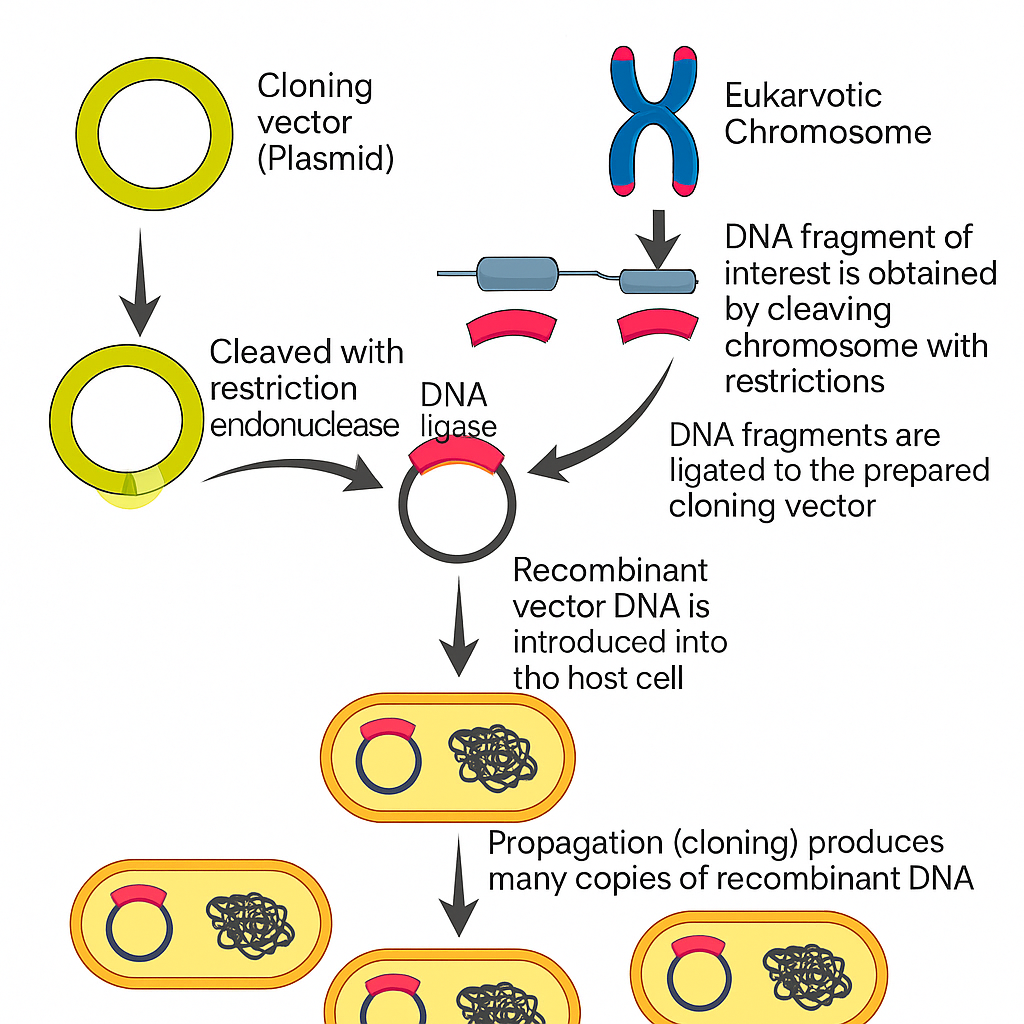
کلونسازی مولکولی
کلونینگ مولکولی به فرایند ساخت چندین نسخه از یک مولکول اطلاق میشود. این روش معمولاً برای تکثیر قطعات DNA حاوی ژنهای کامل بهکار میرود، اما میتوان هر توالی DNA از جمله پروموترها، توالیهای غیرکدکننده یا قطعات تصادفی DNA را نیز تکثیر کرد. این تکنیک در آزمایشهای زیستی و کاربردهای عملی فراوانی مانند اثر انگشت ژنتیکی و تولید پروتئین در مقیاس وسیع استفاده میشود.
مراحل اصلی کلونینگ یک قطعه DNA:
-
شکستن (Fragmentation): بریدن رشته DNA به قطعات کوچکتر
-
اتصال (Ligation): چسباندن قطعات DNA بهصورت توالی دلخواه
-
ترانسفکشن (Transfection): وارد کردن DNA نوترکیب به درون سلولها
-
غربالگری/انتخاب (Screening/Selection): شناسایی سلولهایی که با موفقیت DNA نوترکیب را دریافت کردهاند
این مراحل در اکثر روشهای کلونینگ ثابت هستند، اما مسیرهای مختلفی با توجه به استراتژی کلونینگ انتخاب میشوند. در ابتدا DNA هدف باید ایزوله شود، سپس به یک ناقل (vector) متصل گردد. این ناقلها اغلب حلقوی هستند و با استفاده از آنزیمهای محدودکننده (restriction enzymes) باز شده و با کمک آنزیم DNA لیگاز با قطعهٔ DNA هدف ترکیب میشوند.
پس از اتصال، ناقل به سلولها منتقل میشود که با روشهایی مانند تحریک شیمیایی، الکتروپوریشن، تزریق نوری یا گلولهزنی انجام میگیرد. سپس سلولها کشت داده میشوند. چون بازده این فرآیندها پایین است، باید سلولهایی که حاوی توالی صحیح DNA هستند، شناسایی شوند. برای این منظور، ناقلهای مدرن حاوی نشانگرهای مقاومت آنتیبیوتیکی و نیز نشانگرهای رنگی (مانند سیستم آبی/سفید با X-gal) هستند. در نهایت برای تأیید موفقیتآمیز بودن کلونینگ، باید روشهایی مثل PCR، آنالیز قطعات برشی یا توالییابی DNA انجام شود.
کلونینگ سلولی
کلونسازی ارگانیسمهای تکسلولی
در مورد موجودات تکسلولی مانند باکتریها و مخمرها، کلونسازی سلولی بسیار ساده است و تنها به تلقیح آنها در محیط رشد مناسب نیاز دارد. این فرایند منجر به رشد جمعیتی از سلولها میشود که همهٔ آنها از یک سلول اولیه منشأ گرفتهاند و بنابراین همسان ژنتیکی هستند.
کلونسازی ردههای سلولی با استفاده از رینگهای کلونینگ
در موجودات چندسلولی، کلونینگ سلولها دشوارتر است، زیرا بسیاری از سلولها در محیطهای استاندارد رشد نمیکنند. یک تکنیک رایج در کشت سلول برای کلونسازی ردههای سلولی خاص، استفاده از «رینگهای کلونینگ» (cloning rings) است. در این روش، سوسپانسیون تکسلولی که قبلاً در معرض ماده موتاژن یا دارویی خاص قرار گرفته است، با رقت زیاد کشت داده میشود تا کلونیهای مجزایی حاصل شود؛ هر کلونی از یک سلول منفرد و بالقوه کلونشده رشد میکند.
در مراحل ابتدایی رشد، زمانی که کلونیها فقط شامل چند سلول هستند، حلقههای پلیاستایرن استریل (رینگهای کلونینگ) که در چربی آغشته شدهاند، روی یک کلونی خاص قرار داده میشوند. سپس مقدار کمی آنزیم تریپسین به داخل حلقه افزوده میشود تا سلولها جدا شوند. سلولهای جداشده سپس به محیط جدید منتقل میشوند تا بیشتر رشد کنند.
کلونینگ سلولهای بنیادی
انتقال هستهٔ سلول سوماتیک (SCNT) که با عنوان عمومی «کلونسازی سلولهای بنیادی» شناخته میشود، میتواند برای تولید جنینهایی با هدف پژوهشی یا درمانی بهکار رود. در این نوع کلونسازی که «کلونسازی تحقیقاتی» یا «کلونسازی درمانی» نیز نامیده میشود، هدف تولید انسان کلونشده نیست، بلکه برداشت سلولهای بنیادی از جنین برای بررسی رشد انسان و درمان بیماریهاست. اگرچه یک بلاستوسیست انسانی کلونشده تاکنون ایجاد شده، اما هنوز هیچ رده سلولی بنیادی از منبع کلونشده بهدست نیامده است.
فرآیند کلونسازی درمانی از طریق ساخت سلولهای بنیادی جنینی با هدف درمان بیماریهایی مانند دیابت و آلزایمر انجام میشود. این فرآیند با خارج کردن هستهٔ دارای DNA از یک سلول تخمک و جایگزینی آن با هستهٔ سلول بزرگسال آغاز میشود. مثلاً در مورد بیماری آلزایمر، هستهٔ سلول پوستی بیمار به تخمک خالی منتقل میشود. تخمک با هستهٔ جدید واکنش نشان میدهد و شروع به رشد میکند و به جنینی بدل میشود که از نظر ژنتیکی با فرد بیمار یکسان است. سپس این جنین تبدیل به بلاستوسیست میشود که توانایی تبدیل به هر نوع سلول در بدن را دارد.
مزیت SCNT در کلونسازی این است که سلولهای سوماتیک بهراحتی قابل استخراج و کشت در آزمایشگاه هستند. این فرآیند میتواند ژنوم خاصی را به دام بیندازد یا حذف کند، بهویژه در حیوانات کشاورزی. نکتهٔ کلیدی آن است که در این روش، تخمک بدون استفاده از اسپرم، عملکرد طبیعی خود را حفظ میکند و بهجای آن، هستهٔ سلول سوماتیک در آن قرار میگیرد و تخمک با آن مانند هستهٔ اسپرم رفتار میکند.
مراحل کلونسازی حیوان مزرعهای با استفاده از SCNT تقریباً برای تمام گونهها مشابه است. ابتدا سلولهای سوماتیک از حیوان اهداکنندهٔ DNA جمعآوری میشود. این سلولها ممکن است بلافاصله استفاده شوند یا برای استفادهٔ بعدی ذخیره شوند. سختترین بخش SCNT، حذف DNA مادری از تخمک در مرحلهٔ متافاز II است. پس از آن، هستهٔ سلول سوماتیک به سیتوپلاسم تخمک منتقل میشود و یک جنین تکسلولی ایجاد میکند. سلول حاصل از ترکیب تخمک و سلول سوماتیک سپس در معرض جریان الکتریکی قرار میگیرد تا توسعه جنین شروع شود. جنینهای موفق سپس در رحم جانوران جایگزین، مانند گاو یا گوسفند، قرار داده میشوند.
کاربردهای SCNT: این روش در کلونسازی حیوانات خوراکی مانند گوسفند، گاو، بز و خوک موفقیتآمیز بوده است. همچنین SCNT بهعنوان روشی برای نجات گونههای در خطر انقراض مطرح شده است. با این حال، فشارهایی که بر تخمک و هستهٔ سلول وارد میشود، در مراحل اولیه پژوهشها باعث مرگ تعداد زیادی از سلولها میشد. مثلاً گوسفند دالی پس از استفاده از ۲۷۷ تخمک تولید شد که فقط ۲۹ جنین زنده حاصل شد، تنها ۳ عدد تا زمان تولد زنده ماندند، و فقط یکی به بزرگسالی رسید. از آنجا که این فرآیند نیاز به کار دستی زیر میکروسکوپ دارد، بسیار پرهزینه و پیچیده است. با این حال، تا سال ۲۰۱۴، دانشمندان به نرخ موفقیت ۷ تا ۸ مورد موفق از هر ۱۰ مورد دست یافتند و در سال ۲۰۱۶، شرکت کرهای Sooam Biotech گزارش کرد که روزانه ۵۰۰ جنین کلونشده تولید میکند.
نکته مهم: در روش SCNT، تمام اطلاعات ژنتیکی سلول اهداکننده منتقل نمیشود، زیرا میتوکندری سلول اهداکننده باقی نمیماند. بنابراین سلول نهایی، میتوکندریهای تخمک را حفظ میکند و به همین دلیل، کلونهایی مانند دالی، نسخهٔ کامل و دقیق اهداکنندهٔ هسته نیستند.