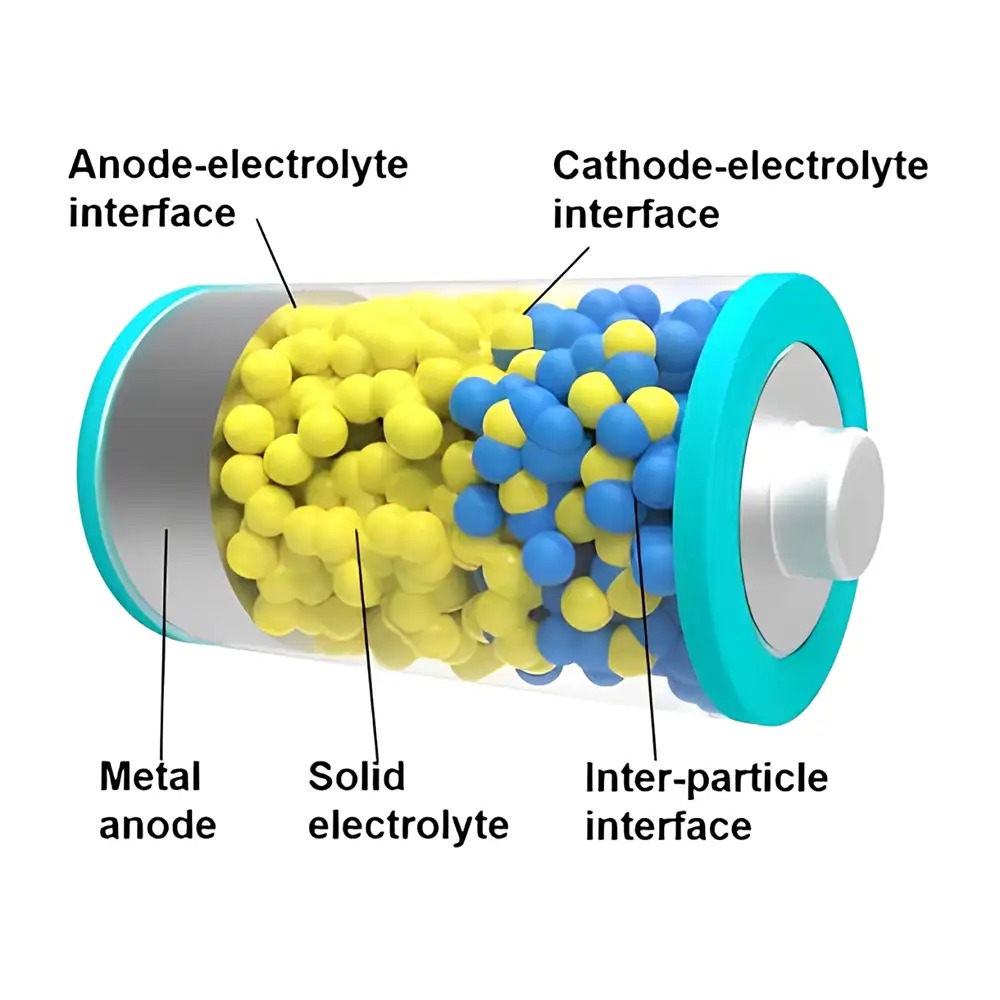
الکترولیتهای حالت جامد
الکترولیتهای حالت جامد (Solid State Electrolytes یا SSEها) موادی هستند که نقش کلیدی در انتقال یونها میان الکترودهای یک باتری را ایفا میکنند، با این تفاوت که برخلاف الکترولیتهای مایع رایج در باتریهای سنتی، این انتقال در محیطی با فاز جامد صورت میگیرد. این ویژگی ساختاری، مزایای چشمگیری در زمینه ایمنی، پایداری و عملکرد الکتروشیمیایی ایجاد میکند. در حالی که الکترولیتهای مایع با خطراتی نظیر نشت، تبخیر و احتراق مواجهاند که میتوانند به آتشسوزی یا انفجار منجر شوند، SSEها به دلیل ماهیت جامد و غیرقابل اشتعال خود، از چنین خطراتی مصوناند و ایمنی بسیار بالاتری دارند.
علاوه بر این، الکترولیتهای حالت جامد زمینهساز دستیابی به چگالی انرژی بالاتر در باتریها هستند. این ویژگی بهویژه در استفاده از آندهای فلزی لیتیوم و کاتدهای با ولتاژ بالا اهمیت دارد که به دلیل ناپایداری در مجاورت الکترولیتهای مایع، پیشتر محدود شده بودند. با این حال، SSEها نیز با چالشهایی نظیر رسانایی یونی کمتر نسبت به نمونههای مایع، و مقاومت الکتروشیمیایی بالا در سطوح مشترک الکترود-الکترولیت مواجه هستند. این مسائل بهویژه در تعاملات مرزی و تشکیل فازهای میانی در سطح تماس اجزاء تشدید مییابد و نیازمند اصلاحات در طراحی مواد و سازگاری ساختاری هستند.
با وجود این چالشها، روند تحقیق و توسعه در زمینه SSEها با شتاب فزایندهای ادامه دارد. این تلاشها با هدف بهبود ویژگیهای رسانشی، پایداری شیمیایی، انعطافپذیری مکانیکی، و سهولت ساخت در حال انجام است. پیشبینی میشود که در آیندهای نهچندان دور، باتریهای حالت جامد به بلوغ صنعتی برسند و به طور گستردهتری در حوزههایی همچون حملونقل الکتریکی، ذخیرهسازی انرژی شبکهای، و دستگاههای الکترونیکی قابلحمل مورد بهرهبرداری قرار گیرند.
۱. مزایای باتریهای حالت جامد
باتریهای حالت جامد به دلیل عدم استفاده از الکترولیتهای مایع آتشزا که در باتریهای لیتیوم-یون سنتی استفاده میشوند، ایمنی ذاتی بالاتری دارند. این ویژگی، احتمال بروز حوادث مرتبط با نشت یا اشتعال را به شدت کاهش داده و قابلیت اطمینان عملکردی باتری را افزایش میدهد. علاوه بر آن، عمر چرخهای بسیار بالای این باتریها نیز مزیت مهمی محسوب میشود؛ نمونههایی از باتریهای حالت جامد تا بیش از ۱۰,۰۰۰ چرخه عملکرد پایدار از خود نشان دادهاند که در مقایسه با باتریهای معمولی، پیشرفتی چشمگیر محسوب میشود.
الکترولیتهای جامد معدنی (Inorganic Solid Electrolytes) به دلیل پایداری حرارتی و شیمیایی بالا، میتوانند عملکرد باتری را در طیف وسیعی از دماها حفظ کرده و نوسانات رسانایی یونی را به حداقل برسانند. همچنین، استفاده از آندهای فلزی لیتیوم و کاتدهای ولتاژ بالا در کنار این الکترولیتها، امکان دستیابی به چگالی انرژی بسیار بالا را فراهم میکند. البته تحقق این مزایا در مقیاس صنعتی همچنان با چالشهایی از قبیل فرآیندهای ساخت پیچیده و سازگاری مکانیکی اجزاء همراه است.
در دهه گذشته، SSEها بهعنوان گزینههایی مهم برای فناوریهای ذخیرهسازی انرژی الکتریکی (Electrical Energy Storage یا EES) مطرح شدهاند. با گذر زمان، علاقه به SSEها پیچیدهتر شده و در پاسخ به چندین روند مهم تقویت شده است؛ از جمله پیشرفت در مواد با عملکرد بالا، افزایش نگرانیهای جهانی پیرامون ایمنی باتریها، و رشد نیازهای کاربردی در بخشهای گوناگون از جمله خودروهای برقی و ذخیرهسازی انرژی تجدیدپذیر.
نکته قابل توجه این است که برخی از کلاسهای SSE امروزه به رسانایی یونی در دمای اتاق (RT) در حدود 1 میلی زیمنس بر سانتیمتر (1 mS/cm) دست یافتهاند، که با بسیاری از الکترولیتهای مایع رایج قابل رقابت است. از سوی دیگر، الکترولیتهای غیرآلی جامد (SIEها) بهطور ذاتی دارای ویژگی تکیونی بودن (Single-ion conduction) هستند که منجر به بهبود کارآیی انتقال بار میشود. در حالی که الکترولیتهای مایع سنتی به دلیل وجود کاتیونها و آنیونهای متحرک، عدد انتقال یونی پایینی دارند، SSEها از این منظر برتری قابلتوجهی دارند.
از منظر بازار، تقاضا برای سامانههای ذخیرهسازی انرژی الکتریکی، چه در حملونقل، چه در ذخیرهسازی شبکهای، و چه در سیستمهای پشتیبانی برق خانگی، بهسرعت در حال افزایش است. در این شرایط، دیگر تنها دغدغه، ایمنی در دستگاههای کوچک نیست، بلکه باید به چالش ایمنی در سامانههای بزرگ با تراکم انرژی بالا که در مجاورت انسانها و زیرساختهای حیاتی قرار دارند نیز پاسخ داده شود.
جالب است بدانید که علاقه به سلولهای الکتروشیمیایی مبتنی بر SSE به حدود ۲۰۰ سال پیش بازمیگردد. زمانی که مایکل فارادی در قرن نوزدهم، مطالعاتی درباره انتقال یون در فاز جامد در ترکیباتی مانند PbF₂ و Ag₂S انجام داد. با این حال، مفاهیم نوین طراحی SSEها در دهه ۱۹۶۰ شکل گرفتند؛ زمانی که این حوزه وارد دورهای از رشد و توسعه سریع شد که به تفکیک الکترولیتهای جامد به دو گروه اصلی انجامید: الکترولیتهای غیرآلی جامد (SIEها) و الکترولیتهای پلیمری جامد (Solid Polymer Electrolytes یا SPEها).
در شکل 1 گاهشمار توسعه این دو خانواده از زمان فارادی تاکنون ترسیم شده است، و در شکل 2 ساختارهای شیمیایی متنوع و پرکاربرد امروز در هر دو گروه SIE و SPE با یکدیگر مقایسه شدهاند. این دستهبندیها پایهگذار استراتژیهای نوین طراحی باتریهای نسل آینده هستند و هر کدام از آنها با نقاط قوت و محدودیتهای خاص خود، در زمینههای متفاوتی از فناوری باتری به کار گرفته میشوند.
2. خواص الکترولیتهای پلیمری جامد و الکترولیتهای غیرآلی جامد
الکترولیتهای غیرآلی جامد (SIEها) به طور کلی دارای ویژگیهای ممتاز از جمله رسانایی یونی بالا (بیش از 0.1 mS/cm در دمای اتاق)، مدول مکانیکی بالا (مثلاً بیش از 1 GPa در اکسیدها)، پنجره پایداری الکتروشیمیایی گسترده و بالا (فراتر از 4 V بر اساس اندازهگیریهای ولتامتری جاروب خطی) و پایداری حرارتی عالی (پایدار در دماهای بالاتر از 100 درجه سانتیگراد) هستند. با این حال، استفاده عملی از SIEها با چالشهایی مواجه است، از جمله:
-
شکنندگی و دشواری در ساخت نمونههای بزرگمقیاس
-
تماس ضعیف بین الکترولیت و الکترود که منجر به انتقال بار محدود در سطح مشترک میشود (در مقایسه با الکترولیتهای مایع)
-
رشد و نفوذ دندریتهای فلزی در امتداد مرزهای دانهای حتی در چگالی جریانهای پایین
-
هزینه بالا و پایداری محیطی ضعیف
برای فائق آمدن بر برخی از این مشکلات، ساختار SIEها با بهکارگیری حفرات زیاد، آرایشهای لایهای و یا افزودن یونهای فلزی اضافی نظیر +Li و +Na بهینه شده است تا رسانایی یونی در حدود 1 mS/cm در دماهای عملیاتی حاصل شود. با این حال، نیروهای الکترواستاتیک شدید موجود در شبکه، انتقال کاتیونهای چندظرفیتی (مانند +2Mg، +2Zn و +3Al) را با مشکل مواجه کرده و منجر به کاهش قابل توجه رسانایی یونی میشود (معمولاً کمتر از 0.001 mS/cm در دمای اتاق).
برای کاهش این نیروها، میتوان با افزایش فاصله بین کاتیونهای متحرک و آنیونهای همسایه (نظیر O²⁻ یا S²⁻) از طریق طراحی مناسب چارچوب آنیونی، پیوندهای یونی را تضعیف کرد. به عنوان نمونه، برخی از SIEهای مبتنی بر سولفید به گونهای طراحی شدهاند که از پیوند ضعیفتر بین Li و S در مقایسه با Li-O بهرهبرداری کنند و قادر به رسانایی یونی بالایی در دمای اتاق باشند (برای مثال 25 mS/cm در Li₉.₅₄Si₁.₇₄P₁.₄₄S₁₁.₇Cl₀.₃).
علاوه بر این، یونهای لیتیوم اضافی در این ساختارها معمولاً در مکانهای پرانرژی مستقر میشوند و مهاجرت آسانتری دارند که موجب انتقال یون کئوردینهشده میشود.
در مقابل، الکترولیتهای پلیمری جامد (SPEها) مزایای خاصی دارند که آنها را برای کاربردهای خاصی برتر میسازد، از جمله:
-
سهولت سنتز و هزینه پایینتر
-
چگالی جرمی کمتر
-
پایداری شیمیایی بالا
-
سازگاری با فرایندهای تولید انبوه
-
انعطافپذیری مکانیکی ذاتی بهویژه در دماهای بالاتر از دمای انتقال شیشهای (Tg)
پلیمرهایی مانند پلیاتیلناکسید (PEO)، پلیآکریلونیتریل (PAN)، پلیمتیلمتاکریلات (PMMA) و پلیوینیلالکل (PVA) به دلیل دارا بودن گروههای جذبکننده الکترون در طول زنجیرههای کربن-کربن، قادرند با مکانیسمهای غیراکلاسیک، جداسازی جفتهای یونی را تسهیل کنند.
در این پلیمرها، تعامل دینامیکی بین کاتیونهای متحرک و زنجیرههای پلیمری، منجر به ساختارهای یونهدرونیک میشود که انتقال یونها را نسبت به SIEها، که در آنها پرش بین مکانهای اتمی در شبکه کریستالی یا در امتداد نقصهای ساختاری رخ میدهد، کندتر میکند.
با این حال، راهکارهای مختلفی برای بهبود رسانایی SPEها توسعه یافتهاند، مانند استفاده از:
-
نرمکنندههای پلیمری
-
پرکنندههای معدنی
-
نانوذرات متصل به الیگومرها
-
روشهای شیمیایی مانند همپلیمریزاسیون، شبکهایسازی و وارد کردن گروههای جانبی یونی
این رویکردها با کاهش بلورینگی پلیمر، مهاجرت یون را تسهیل میکنند و رسانایی مناسبی را در دماهای عملیاتی مختلف، بهویژه در کاربردهای حملونقل فراهم میسازند.
ترکیب مزایای منحصربهفرد SIEها و SPEها در قالب الکترولیتهای کامپوزیتی SIE-SPE، یک راهکار امیدبخش برای توسعه مواد با خواص متعادل است. ریشه این کامپوزیتها به افزودن ذرات غیرآلی خنثی به ماتریس پلیمری رسانای یون، مانند PEO، بازمیگردد که موجب:
-
بهبود استحکام مکانیکی و پایداری حرارتی
-
سرکوب بلورینگی پلیمر و تسهیل جداسازی نمک
-
ایجاد مسیرهای هدایت یون در فاز غیرآلی متصل
میشود. علاوه بر کامپوزیتهای حجمی، کامپوزیتهای هیبریدی لایهای SPE-SIE نیز توسعه یافتهاند که میتوانند تماس سطح مشترک با کاتدهای سهبعدی را بهبود بخشیده یا پایداری شیمیایی و الکتروشیمیایی در برابر آندهای فلزی فعال مانند لیتیوم را افزایش دهند.
طی پنج سال گذشته، پیشرفتهای فناورانه قابل توجهی در این حوزه حاصل شده است. با وجود آن، چالشهایی چون شکنندگی، انتقال بار ضعیف در سطح مشترک، ناپایداری محیطی، پیرشدگی، واکنشپذیری در تماس بلندمدت با الکترودها، و رسانایی الکترونی ناخواسته در مرزهای دانهای، همچنان موضوعات محوری پژوهش هستند.
3. انتقال یون در الکترولیت حالت جامد
3-1. مکانیزم انتقال یون
انتقال یون در الکترولیتهای جامد عمدتاً توسط گرادیان پتانسیل شیمیایی و الکتروشیمیایی هدایت میشود. معادله نرنست-پلانک، جریان گونههای باردار را به این گرادیانها مرتبط میسازد:
j=−F2∇φ∑μici−F∑Di∇ci+Fu∑ci(1)
در این معادله:
-
F ثابت فارادی
-
μi تحرک یونی گونه i
-
ci غلظت گونههای باردار
-
Di ضریب نفوذ
-
u سرعت جابجایی محیطی
در یک SSE، ترم جابجایی بهدلیل ویسکوزیته بالا قابل صرفنظر است، و در ولتاژهای عملیاتی نیز گرادیان غلظت ناچیز فرض میشود. در این شرایط، معادله بهصورت سادهشده برای رسانایی یونی نوشته میشود:
σ=−∇φj=F2∑iμici(2)
و چون تحرک یونی با ضریب نفوذ رابطه دارد (μi=Di/RT\mu_i = D_i / RTμi=Di/RT)، میتوان نتیجه گرفت که رسانایی بالا مستلزم هم تحرک بالا و هم غلظت زیاد یونهای متحرک است.
یونهای آزاد که از سد انرژی گذر میکنند میتوانند بین مکانها مهاجرت کنند. ضریب نفوذ به صورت زیر تعریف میشود:
Di=γa2f0exp(−RTΔGmig)(3)
که در آن:
-
γ ضریب هندسی
-
a فاصله پرش
-
0f فرکانس ارتعاشی یونها
-
{mig}ΔG انرژی آزاد مهاجرت
با جایگذاری در معادله (2)، معادله کلی رسانایی به شکل زیر درمیآید:
σi=ciγa2f0exp(−RTΔGmig)=ciγa2f0exp(RΔSmig)exp(−RTΔHmig)(4)
در صورتی که جداسازی جفت یونها نیز بهصورت فرایند حرارتی باشد، میتوان cic_ici را تابعی از آنتالپی تشکیل دانست:
ci=c0exp(−RTΔHf)(5)
در نتیجه، رسانایی را میتوان به فرم آرنیوسی نوشت:
σi=σ0exp(−RTEa)(6)
که در آن Ea=ΔHf+ΔHmigE_a = \Delta H_f + \Delta H_{mig}Ea=ΔHf+ΔHmig انرژی فعالسازی کلی است. این معادله معمولاً برای مواد کریستالی و معدنی صدق میکند.
در مورد مواد آمورف، که دارای آنتروپی بیشتر و فضای آزاد بیشتری برای حرکت هستند، مهاجرت یونها سادهتر است. بهویژه شیشهها که فاقد نظم بلندبرد هستند، در دماهایی پایینتر از دمای تبدیل شیشهای (Tg) از قانون آرنیوس پیروی میکنند. اما در دماهای بالاتر، انعطافپذیری زنجیرههای پلیمری افزایش مییابد، ویسکوزیته کاهش مییابد، و مهاجرت یونها تسهیل میشود.
معادله ووگل–فولچر–تامن این رفتار را توصیف میکند:
σi=σ0exp(−R(T−T0)Ea)(7)
که در آن T0T_0T0 دمایی حدود ۵۰ کلوین پایینتر از TgT_gTg است و نشانگر سد انرژی برای حرکت محلی زنجیرهها در سیستم آمورف است. الکترولیتهای پلیمری، بهویژه، به دلیل پیوند مستقیم بین تحرک قطعههای زنجیره و حرکت یون، از این رابطه پیروی میکنند.
3-2. مسیرهای انتقال یونی
مسیرهای درونحجمی:
ساختار بلوری و ویژگیهای فیزیکی-شیمیایی مواد بهطور مستقیم بر پارامترهای مؤثر بر انتقال یون در الکترولیتهای غیرآلی (SIEها) و پلیمری (SPEها) تأثیر میگذارند . اکثر SIEها ساختاری بلوری و دورهای متشکل از پلیهدرهای منظم دارند که یونها در آنها از طریق مکانیزمهای پرش یونی در چارچوب کریستالی جابهجا میشوند.
در سرامیکها، نقصهای ساختاری از قبیل فضای خالی، جایخالی و نقصهای بینمرزی، سهم عمدهای در تسهیل حرکت یونها دارند.
همچنین شبکه بلوری در نزدیکی مرزهای دانه یا فصل مشترکها ممکن است دچار تغییر شکل موضعی شود که موجب بازتوزیع حاملهای متحرک (یونها) بر اساس گرادیان پتانسیل الکتروشیمیایی شده و در نتیجه مسیرهای هدایت بار اضافی در این نواحی شکل گیرد.
در رساناهای سوپریونیک بلورین، توپولوژی شبکه، نحوه کئوردیناسیون مکانهای یونپذیر، و پیوستگی این مکانها، پارامترهای کلیدی در تعیین منظره انرژی و نرخ مهاجرت یونها بهشمار میروند. چارچوبهای دارای تونلها یا کانالهای باز که پیوند ضعیفتری با یونهای متحرک برقرار میکنند، شرایط مناسبتری برای رسانایی یونی بالا فراهم میسازند.
در سوی دیگر، هدایت یونی در SPEها عمدتاً به تعامل دینامیکی یونهای مثبت با زنجیرههای پلیمری وابسته است. در پلیاترهایی نظیر پلیاتیلناکسید (PEO)، یونهای لیتیوم +Li از طریق کئوردیناسیون با اتمهای اکسیژن موجود در ستون فقرات زنجیره پلیمری، بین بخشهای مختلف زنجیره مهاجرت میکنند . این فرایند شامل ترکیبی از حرکات پیچیده شامل:
-
پرش یون از یک مکان کئوردینهشده به مکان دیگر،
-
جابجایی یون از یک بخش زنجیره به بخش مجاور،
-
و در برخی موارد، حرکت جمعی بخشهایی از زنجیره پلیمری همراه با یون
میباشد. هدایت یونی در این سامانهها عمدتاً در فاز آمورف پلیمر صورت میگیرد، چرا که در این نواحی فضای آزاد بیشتری برای جابهجایی یونها وجود دارد و زنجیرههای پلیمری انعطافپذیرتر هستند.
در پلیمرهایی با وزن مولکولی بالا، درهمتنیدگی زنجیرهها و حضور یونهای هیدراته موجب محدود شدن تحرک یون میشود. در نتیجه، مکانیسم غالب، جابهجایی یون از یک بخش زنجیره به بخش دیگر است. در مقابل، در پلیمرهای با وزن مولکولی کم و الیگومرها، هدایت یونی بیشتر به انتشار یونی از نوع هیدراته شباهت دارد که مشابه رفتار الکترولیتهای مایع مبتنی بر کربنات است.
جالب است که مطالعات اولیه بر این باور بودند که نواحی بلورین نقش عمدهای در افزایش هدایت یونی دارند، زیرا زنجیرههای منظم پلیمر در این نواحی میتوانند ساختارهایی تونلمانند ایجاد کنند که یونها در آنها بهصورت پرشی حرکت کنند، در حالی که آنیونها به دلیل دافعه الکترواستاتیک در فضای بینزنجیرهای قرار دارند و جداسازی یونهای مثبت و منفی حفظ میشود. با این حال، مطالعات تجربی و نظری متعدد که در دهههای اخیر انجام شدهاند، نشان دادهاند که کاهش بلورینگی پلیمر کلید افزایش رسانایی یونی در SPEهاست، زیرا تسهیل حرکت زنجیره و افزایش فضای آزاد نقش مهمتری در مهاجرت یون دارد.
3-3. مسیرهای انتقال در مرزها و فصل مشترک
در معماری یک باتری حالت جامد، سطوح مشترک متعددی حضور دارند که میتوان آنها را به دو دسته کلی تقسیم کرد:
-
سطوح مشترک همگن: مانند مرزهای دانهای در ساختارهای پلیکریستالی؛
-
سطوح مشترک ناهمگن: مانند سطح تماس بین الکترولیت و الکترود.
انتقال یون از میان این فصل مشترکها عامل حیاتی در عملکرد باتریهای نسل بعدی محسوب میشود، بهویژه در شرایطی که از نانوساختارها استفاده شود، چرا که افزایش نسبت سطح به حجم منجر به افزایش چشمگیر تعداد فصل مشترکها در سامانه میشود.
مرزهای دانهای نوعی نقص گسترده ساختاری بهشمار میروند که میتوانند در SIEها بهعنوان مسیرهای اصلی برای مهاجرت یونها عمل کنند. در فصل مشترکهای ناهمگن، تفاوت در پتانسیلهای شیمیایی دو ماده موجب بازتوزیع یونها میشود. در نتیجه، لایهای از بار فضایی در ناحیه مرزی تشکیل میشود که بهواسطه مهاجرت موضعی یونهای جبراننشده، منجر به تجمع حاملهای بار در یک طرف مرز و کاهش آنها در طرف دیگر میگردد.
این لایههای بار فضایی نهتنها بر هدایت یونی محلی در فصل مشترک اثرگذارند، بلکه میتوانند بر هدایت کلی ماده نیز تأثیرگذار باشند. بهعنوان نمونه، در سرامیکهای شیشهای مانند LAGP (Li₁₊ₓAlₓGe₂₋ₓ(PO₄)₃؛ x = 0.5)، لایههای بار فضایی میتوانند موجب تسهیل یا، بسته به شرایط، کاهش رسانایی یونی در سطح مشترکهای مختلف شوند.
در سطح مشترک بین الکترولیت و آند فلزی (که معمولاً سطحی صاف و یکنواخت دارد)، پیوستگی و یکنواختی تماس عامل مهمی در ایجاد هدایت مؤثر است. اما در سطح مشترک با کاتدهای متخلخل، پیچیدگی ساختار بهدلیل ناپیوستگیهای فراوان، موجب افزایش مقاومت و تغییرات در مسیرهای انتقال یونی میشود که تحلیل و کنترل آن نیازمند بررسیهای دقیقتر است.
4. نتیجهگیری
الکترولیتهای جامد پلیمری (SPEها) و غیرآلی (SIEها) هر کدام مزایا، محدودیتها و چالشهای منحصربهفرد خود را دارند که استفاده بهینه از آنها در فناوریهای انرژی پیشرفته، بهویژه باتریهای حالت جامد، مستلزم طراحی دقیق و بهرهگیری ترکیبی از این دو کلاس الکترولیت است.
SIEها با فراهمسازی رسانایی یونی بالا، مدول مکانیکی بزرگ و پایداری الکتروشیمیایی گسترده، گزینهای ایدهآل برای پایداری و امنیت بیشتر باتریها هستند، اما در مقابل شکنندگی ذاتی، سختی فرایند ساخت، تماس ضعیف در سطح مشترک و رشد دندریتها محدودیتهای عملی ایجاد میکنند. در سوی دیگر، SPEها به دلیل انعطافپذیری مکانیکی، سازگاری بالا با فرایندهای صنعتی، هزینه کمتر و قابلیت اصلاح شیمیایی، بستر مناسبی برای تولید انبوه فراهم میسازند، ولی هدایت یونی محدود و حساسیت به دما چالشهای عملکردی آنها هستند.
در این میان، الکترولیتهای کامپوزیتی SPE-SIE بهعنوان راهکاری ترکیبی مطرح شدهاند که میتوانند از مزایای هر دو سیستم بهرهبرداری کرده و خواصی متعادل میان پایداری مکانیکی، رسانایی یونی و قابلیت فرایندپذیری ارائه دهند. توسعه این دسته از مواد، مسیر امیدبخشی برای بهبود عملکرد، ایمنی و طول عمر باتریهای حالت جامد فراهم میکند و میتواند گامی اساسی در تحقق باتریهای نسل آینده با کارایی بالا، چگالی انرژی بیشتر و ایمنی بالاتر باشد.